九年级化学下册 第十单元 实验活动6 酸、碱的化学性质复习(无答案)(新版)新人教版
- 格式:doc
- 大小:213.50 KB
- 文档页数:5

实验活动6 酸、碱的化学性质【实验目的】1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
【实验准备】☆知识准备1.酸的化学性质:(1)酸能使紫色石蕊溶液变红色,使无色酚酞溶液不变色。
(2)酸+活泼金属→盐+氢气。
(3)酸+某些金属氧化物→盐+水。
2.碱的化学性质:(1)碱能使紫色石蕊溶液变蓝色,使无色酚酞溶液变红色。
(2)碱+某些非金属氧化物→盐+水。
(3)碱+某些盐→新盐+新碱。
3.中和反应:酸+碱→盐+水。
【活动体验】1.酸和碱与指示剂的作用:【实验步骤】(1)取两个点滴板分别滴加稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液。
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜色的变化。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察颜色的变化。
【实验现象】(1)紫色石蕊溶液滴加在稀盐酸和稀硫酸中变红色,滴加在氢氧化钠溶液和氢氧化钙溶液中变蓝色。
(2)无色酚酞溶液滴加在稀盐酸和稀硫酸中不变色,滴加在氢氧化钠溶液和氢氧化钙溶液中变红色。
【实验结论】紫色的石蕊溶液遇酸变红色,遇碱变蓝色;无色的酚酞溶液遇酸不变色,遇碱变红色。
2.酸与金属、金属氧化物的反应:【实验步骤】(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出,洗净。
继续观察另一支试管中的现象。
(3)过一段时间将另一个铁钉取出,洗净。
比较两个铁钉。
【实验现象】(1)铁钉在稀盐酸中铁锈逐渐消失,溶液呈现黄色。
(2)除去铁锈后的铁钉在稀盐酸中表面有气泡产生。
(3)两铁钉的表面都变得光亮。
【实验结论】酸既能与金属氧化物反应,又能与活泼金属反应。
3.酸与碱的反应:【实验步骤】(1)在试管中加入约2 mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象。
然后再向试管中加入稀盐酸,观察现象。
(2)另取一支试管,加入约1 mL氢氧化钠溶液,滴入几滴酚酞溶液。


实验活动6酸、碱的化学性质【学习目标】1.知识与技能:加深对酸和碱的化学性质的认识。
2.过程与方法:体验实验探究的过程。
3.情感态度与价值观:初步学会实验操作的方法,通过实验解释生活中的一些现象。
【学习重点】盐酸、硫酸、氢氧化钠、氢氧化钙的主要性质。
【学习难点】酸、碱的化学性质的具体应用。
情景导入生成问题1.复习:盐酸、硫酸、氢氧化钠、氢氧化钙的主要化学性质有哪些?通过实验再具体认识。
2.出示学习目标,由学生对学习目标进行解读。
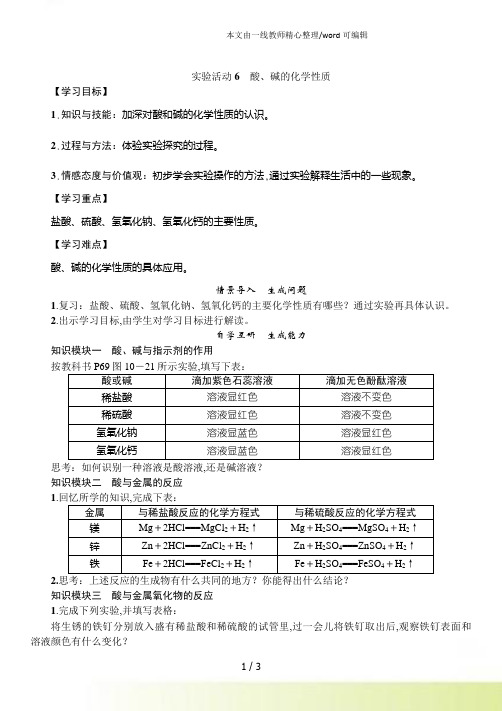
自学互研生成能力知识模块一酸、碱与指示剂的作用按教科书P69图10-21所示实验,填写下表:酸或碱滴加紫色石蕊溶液滴加无色酚酞溶液稀盐酸溶液显红色溶液不变色稀硫酸溶液显红色溶液不变色氢氧化钠溶液显蓝色溶液显红色氢氧化钙溶液显蓝色溶液显红色思考:如何识别一种溶液是酸溶液,还是碱溶液?知识模块二酸与金属的反应1.金属与稀盐酸反应的化学方程式与稀硫酸反应的化学方程式镁Mg+2HCl===MgCl2+H2↑Mg+H2SO4===MgSO4+H2↑锌Zn+2HCl===ZnCl2+H2↑Zn+H2SO4===ZnSO4+H2↑铁Fe+2HCl===FeCl2+H2↑Fe+H2SO4===FeSO4+H2↑2.思考:上述反应的生成物有什么共同的地方?你能得出什么结论?知识模块三酸与金属氧化物的反应1.完成下列实验,并填写表格:将生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管里,过一会儿将铁钉取出后,观察铁钉表面和溶液颜色有什么变化?实验现象化学方程式铁锈+稀盐酸铁锈逐渐溶解,溶液由无色变为黄色Fe2O3+6HCl===2FeCl3+3H2O铁锈+稀硫酸铁锈逐渐溶解,溶液由无色变为黄色Fe2O3+3H2SO4===Fe2(SO4)3+3H2O2.思考:根据以上实验和讨论,归纳出盐酸、硫酸等具有哪些相似的化学性质?知识模块四碱与非金属氧化物的反应1.实验室如何检验二氧化碳气体?反应的化学方程式是什么?将气体通入澄清石灰水,观察石灰水是否变浑浊;Ca(OH)2+CO2===CaCO3↓+H2O。


九年级化学下册第10单元酸和碱实验活动6 酸、碱的化学性质学案(新版)新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(九年级化学下册第10单元酸和碱实验活动6 酸、碱的化学性质学案(新版)新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为九年级化学下册第10单元酸和碱实验活动6 酸、碱的化学性质学案(新版)新人教版的全部内容。
实验活动6 酸、碱的化学性质【学习目标】1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象.3.巩固酸、碱具有相似化学性质的原因.【学习重点】盐酸、硫酸、氢氧化钠、氢氧化钙的主要性质。
【学习难点】酸碱的化学性质的具体应用。
情景导入生成问题1.复习:盐酸、硫酸、氢氧化钠、氢氧化钙的主要化学性质有哪些?通过实验再具体认识.2.出示学习目标,由学生对学习目标进行解读。
自学互研生成能力错误!按教科书P69图[10-21]所示实验,填写下表:思考:如何识别一种溶液是酸、碱溶液?知识模块二酸与金属反应1.回忆所学的知识,完成下表:2.思考:上述反应的生成物有什么共同的地方?得出什么结论?错误!1.完成下列实验,并填写表格:将生锈的铁钉和氧化铜分别放入盛有稀盐酸和稀硫酸的试管里,过一会儿将铁钉取出后,观察铁钉表面和溶液颜色有什么变化?2.思考:根据以上实验和讨论,归纳出盐酸、硫酸等具有哪些相似的化学性质?错误!1.实验室如何检验二氧化碳气体?反应的化学方程式是什么?将气体通入澄清石灰水,观察石灰水是否变浑浊;Ca(OH)2+CO2===CaCO3↓+H2O。
2.氢氧化钠与氢氧化钙具有相似化学性质,请写出相应化学方程式。
九年级化学下册第10单元实验活动6《酸、碱的化学性质》教案(新版)新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(九年级化学下册第10单元实验活动6《酸、碱的化学性质》教案(新版)新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为九年级化学下册第10单元实验活动6《酸、碱的化学性质》教案(新版)新人教版的全部内容。
第十单元实验活动6 酸和碱的化学性质三维目标:知识与技能:1加深对酸和碱的主要性质的认识,2通过实验解释生活中的一些现象,过程与方法通过学生动手实验培养学生观察、记录、分析实验现象的能力.情感态度与价值观通过亲自动手做实验,激发学生学习的兴趣,体验到学有所用的快乐。
教学模式:“1171教学模式”教学方法:实验探究实验用品:试管药匙玻璃棒点滴板稀盐酸溶液稀硫酸溶液氢氧化钠溶液氢氧化钙溶液硫酸铜溶液氢氧化钙粉末石蕊溶液酚酞溶液石棉网生锈的铁钉教学过程:一、创设情景:展示两瓶无色液体(一瓶是酸,一瓶是碱)你将如何鉴别它们呢?生答:·········注意:纠正学生语言的描述回顾:酸碱的化学性质二、引入下面我们一起动手实验验证它们之间的反应,学生实验活动一:酸碱和指示剂的反应多媒体展示实验步骤:讲解胶头滴管:1.先排空再吸液2.滴液时,.悬空垂直放在试管口滴加。
3。
使用过程中,始终保持橡胶乳头在上,以免被试剂腐蚀;4.用完后立即清洗,滴瓶的滴管除外;5。
胶头滴管使用时千万不能伸入或与器壁接触学生汇报实验现象:步骤1中稀盐酸、稀硫酸中液体变为红色,氢氧化钠、氢氧化钙中液体变为蓝色.步骤2中稀盐酸、稀硫酸中液体不变色,氢氧化钠、氢氧化钙中液体变为红色。
实验活动6酸、碱的化学性质教学目标知识与技能1.加深指示剂遇酸、碱颜色变化的认识。
2.实验探究酸、碱的化学性质。
过程与方法在实验过程中探讨实验现象与化学变化的关系。
情感、态度与价值观体验探究活动的乐趣,增强对化学现象的探知欲,加深学习化学的兴趣。
重点难点重点通过实验证明。
难点酸碱的化学性质。
教学准备试管、药匙、蒸发皿、玻璃棒、白色点滴板、胶头滴管、稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
教学进程一、引入新课1.师:紫色的石蕊遇酸、碱变成什么颜色?无色酚酞遇酸、碱变成什么颜色?生:石蕊遇酸变红,遇碱变蓝;酚酞遇碱变红,遇酸不变色。
师:这一节是实验课,把你们桌上的稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液分别滴在两个白色滴板上,然后用胶头滴管分别取石蕊试液、酚酞试液滴在白色点滴板上的各种溶液里。
学生实际操作,教师巡视指导。
师:你们能得出什么结论?生:和刚才回答的结果是一样的。
2.师:取两根生锈的铁钉放入两支试管中,然后加入约2 mL的稀盐酸,观察现象。
①当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出,洗净,继续观察另一支试管中的现象。
②过一段时间将铁钉取出洗净,比较两支铁钉。
学生实验,教师巡视指导。
师:观察现象①有怎样的反应,颜色发生了什么变化?生:铁钉上的锈逐渐没有了,溶液由无色变成了黄色,铁锈与稀盐酸反应生成了三氯化铁。
Fe2O3+6HCl(稀)===2FeCl3+3H2O师:观察②时,剩下这支试管中发生了怎样的反应和现象?生:有气泡生成,溶液颜色变绿了。
铁与稀盐酸反应,生成氢气和二氯化铁。
Fe+2HCl===FeCl2+H2↑师:铁钉大小是怎么变化的?生:由大变小。
师:通过实验能得出什么结论?生:酸能与金属氧化物反应,稀盐酸与在金属活动顺序(稀盐酸)(H)前面的金属反应可释放出氢气。
3.师:在试管中加入约2 mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象①,然后再向试管中加入稀盐酸观察现象②。
人教版九年级化学下实验活动6酸、碱的化学性质知识要点课标要求1.酸、碱的化学性质(重点) 加深对酸和碱的化学性质的认识2.体验实验探究的过程(重点) 初步学会实验操作的方法,通过实验解释生活中的一些现象【实验用品】试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴、白色点滴板。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
合作探究探究点酸、碱的化学性质提出问题1.酸的水溶液和碱的水溶液在反应前各有什么离子?反应后又有哪些微粒?2.中和反应的实质是什么呢?讨论交流学生分组讨论交流。
探究实验【实验活动1】酸、碱与指示剂的反应【实验操作】在两个白色点滴板上分别滴入稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液,向一白色点滴板上的酸碱溶液中滴加紫色石蕊溶液,向另一白色点滴板上的酸碱溶液中滴加无色酚酞溶液,观察现象。
【实验现象】加入紫色石蕊溶液后的颜色变化加入无色酚酞溶液后的颜色变化稀盐酸变红色不变色稀硫酸变红色不变色氢氧化钠溶液变蓝色变红色氢氧化钙溶液变蓝色变红色【实验结论】酸能使紫色的石蕊溶液变成红色,使无色的酚酞溶液不变色;碱能使紫色的石蕊溶液变成蓝色,使无色的酚酞溶液变成红色。
【实验活动2】酸与金属氧化物的反应【实验操作】取两个生锈的铁钉放入两支试管中,然后加入约2mL稀盐酸,观察现象。
当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出,洗净。
继续观察另一支试管中的现象,过一段时间将铁钉取出,洗净。
比较两支铁钉。
【实验现象】①铁锈慢慢消失,溶液由无色慢慢变成黄色;②铁钉表面产生气泡;③后取出的铁钉变小。
【实验结论】(1)6HCl+Fe2O3===2FeCl3+3H2O(2)2HCl+Fe===FeCl2+H2↑实验操作反应的现象结论(反应的化学方程式)向2mL硫酸铜溶液中加入几滴氢氧化钠溶液溶液中产生蓝色沉淀2NaOH+CuSO4===Cu(OH)2↓+Na2SO4再向上述试管中加入稀盐酸沉淀溶解2HCl+Cu(OH)2===CuCl2+2H2O实验操作反应的现象结论(反应的化学方程式) 向1mL氢氧化钠溶液中加入酚酞溶液,再慢慢加入稀盐酸溶液先变为红色,然后溶液由红色变为无色HCl+NaOH===NaCl+H2O取上述无色的溶液1mL置于蒸发皿中加热至液体蒸干有白色固体析出实验操作反应的现象结论(反应的化学方程式) 向少量的氢氧化钙粉末中加入1mL水,振荡,再滴入1~2滴酚酞溶液,再加入1mL水,振荡溶液变为红色,加水后颜色不变向同质量的氢氧化钙粉末中加入1mL水,振荡,再滴入1~2滴酚酞溶液,再加入1mL稀盐酸,振荡溶液变为红色,加稀盐酸后溶液红色消失2HCl+Ca(OH)2===CaCl2+2H2O(1)实验活动2中,将铁钉放入试管时应如何操作?(将铁钉放入试管时,先将试管横放,把铁钉放在试管口,然后将试管慢慢竖起。
第十单元实验活动6 酸、碱的化学性质
基础知识梳理部分
一、常见的酸:
浓盐酸能冒
,
SO
②
1、浓硫酸的特性_____________、____________、______________、_______________
2、浓硫酸的稀释操作___________________________________________
事故处理:①浓硫酸沾到皮肤或衣物上应:。
②氢氧化钠溶液沾到皮肤或衣物上应:。
3、遇水放热的物质有、、。
具有吸水性的物质有______、________、____________,可做_______剂
4、干燥剂的选择技巧
选择干燥剂的原则是:干燥剂不能与被干燥的气体反应。
二、常见的碱的化学性质:
三、H+(或酸) 和OH- (或碱)的检验(熟记)
1、H+(或酸):
方法①:将少许石蕊试液滴入被测试液,溶液变,说明含H+(或酸);
方法②:用pH试纸测定测试液的酸碱度,pH 7,说明含H+(或酸)
方法③:取少许试液加入锌粒,产生,说明含H+(或酸);;
2、 OH- (或碱):
方法①:将少许无色酚酞试液滴入被测试液,溶液变,说明含OH- (或碱);方法②:用pH试纸测定测试液的酸碱度,pH 7,说明含OH- (或碱)
四、溶液酸碱度pH的测定与应用
1、测定pH值最简单的方法是使用,测定时,先把pH试纸放在_________上,用蘸取待测溶液,滴在上,然后再与对照,便可测出溶液的pH值。
若用此法测得土壤的pH值小于5,可以施用适量的来改良土壤2.正常的雨水pH__________, 与空气中的_________有关系。
酸雨的pH___________,与空气中的__________有关系。
基础知识应用训练部分
一、考点及例题训练
(一)常见酸碱的性质的考察
例1. 2013年11月11日,青岛市一辆载有28t浓盐酸的罐车在环湾大道斜坡处抛锚,部分盐酸从罐体顶部泄漏出来,马路上迅速腐蚀蒸发,冒出白色的酸雾。
消防部门耗水近30吨对泄漏盐酸进行稀释处理,对地面撒熟石灰中和残留盐酸,并对罐体进行了重新密封加固。
(1) 浓盐酸泄露会产生白雾,该白雾是,说明浓盐酸具
有性,该性质属于为性质(填“物理”或“化学”)。
(2) 消防官兵消耗30多吨水进行抢险,解释水的作用是、。
(3) 事故处理过程中发生反应的化学方程式为
,
该反应属于反应。
罐体进行了重新密封加固时,能否用铁制材料,
请用化学方程式表示。
(4) 处理过程中要不断地检测周围水的pH,你所知道的测定溶液pH的操作方法是
[跟踪训练:]
1、下列物质久置空气中质量都会改变,其原因只.和水蒸气有关的是…………( )
A.固体烧碱 B.浓硫酸 C.生石灰 D.洁净的铁钉
2.
化学式
(2)用上表的四种具体物质,各写一个符合下列要求的化学方程式:
①置换反应________ ______________________________________;
②中和反应
(二)、利用物质的性质简单鉴别
例2、配套练习册57页19题,52页17题
【跟踪训练】
1、有两瓶失去标签的溶液,分别是氢氧化钠和稀盐酸,写出鉴别方法:
法一:____________________________________________________________
法二:____________________________________________________________
2. 现有盐酸.氢氧化钠.氢氧化钙三瓶失去标签的溶液,为了鉴别这些溶液,将它们编号为A.B.C,并按图所示步骤进行实验。
观察到以下现象:
步骤1 步骤2 (1)写出试剂的名称:a b
(2)写出三种溶液的化学式:A ;B ;C (3)写出生成白色沉淀反应的化学方程式:
红色溶液 无色溶液 白色沉淀 无明显现象
(4)本实验如果将实验“步骤1”与“步骤2”颠倒,能否达到实验目的? 。
(三)溶液酸碱度pH 的测定与应用,以及中和反应 例题3:配套练习册60页8题,61页12,13题 跟踪训练:
1.小华同学用右图所示装置进行中和反应实验,反应后为确定硫酸和氢氧化钠是否刚好完全反应,他取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论。
(1)写出该中和反应的化学方程式 。
(2)小亮认为小华的结论不准确,他认为除了“恰好中和”外还有第二种可能性,这种可能性是 。
(3)请你另外设计一个实验,探究上述烧杯中的溶液是否恰好完全中和。
填写下表(选择甲、乙中的一个作答):
(四)、气体的干燥与吸收
例题4.如图,某气体x 可能是由氢气.一氧化碳.甲烷中的一种或几种组成,将x 气体燃烧,把燃烧后生成的气体通过A 、B 两个洗气瓶,试回答:
(1)若A 洗气瓶的质量增加,B 洗气瓶的质量不变,则X 气体是(填化学式,下同) ; (2)若B 洗气瓶的质量增加,A 洗气瓶的质量不变,则气体是 ;
(3)若A .B 洗气瓶的质量都增加,则x 气体可能是 。
二、检测反馈
1.下列说法不正确的是( )
A .打开浓盐酸的试剂瓶,瓶口有白雾冒出
B .盐酸和铁粉反应后溶液呈黄色
C .盐酸遇无色酚酞试剂显红色
D .盐酸可除去铁制品表面的锈
2、某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是…………( )
盐酸
酚酞
石蕊
A B
A. B. C. D
3、氢氧化钠是一种重要的化工原料。
(1)氢氧化钠溶液长期暴露在空气中会逐渐变质,变质的原因___________________
(2)如果要使氢氧化钠溶液的pH减小,可采取的方法有:
①不发生化学反应的方法_________________。
②有化学反应发生的方法(要求各种方法中所选的物质类别不同)_________________;_______________________。