胺与酰胺
- 格式:pptx
- 大小:9.71 MB
- 文档页数:76


有机化学中的胺和酰胺的反应胺和酰胺是有机化学中常见的两类化合物,在许多化学反应中发挥着重要作用。
本文将探讨胺和酰胺的反应机理和一些重要的反应类型。
一、胺的反应1. 亲电取代反应胺可以作为亲电试剂参与取代反应。
在这类反应中,氨基(NH2)基团可以与带有亲电中心的化合物发生取代反应。
例如,胺可以与卤代烃反应,形成相应的胺类化合物。
这类反应可以通过氨基团中的孤对电子攻击带有亲电性的碳原子实现。
2. 缩合反应胺还可以参与缩合反应,形成脲、胸腺嘧啶等化合物。
在这类反应中,胺的氨基团与酮或醛的羰基进行缩合,形成C-N键。
缩合反应通常需要使用酸催化剂或碱催化剂来促进反应的进行。
3. 氧化反应胺是一种容易氧化的化合物,可以参与氧化反应。
在这类反应中,胺的氨基团会被氧化剂(如过氧化氢或过氧化苯甲酰)氧化为亚胺、亚胺氧化物等。
氧化反应通常需要在酸性或碱性条件下进行。
二、酰胺的反应1. 羟胺化反应酰胺可以与羟胺反应,形成羟基酰胺。
在这类反应中,酰胺的羰基与羟胺发生加成反应,形成新的羟基和酰胺的酰胺化合物。
这类反应在生物体内广泛存在,参与许多重要生物分子的合成过程。
2. 加氢反应酰胺可以参与加氢反应,将羰基还原为羟基。
这类反应通常需要使用氢化试剂(如氢气和催化剂)催化。
加氢反应对于合成醇和醛的羰基还原具有重要意义。
3. 脱酰反应酰胺可以发生脱酰反应,生成相应的胺和酰基化合物。
在这类反应中,酰胺的酰基与碱性条件下断裂,形成胺和酰基化合物。
这类反应在有机合成中常被用于制备新的胺类化合物。
总结起来,胺和酰胺在有机化学中具有广泛的应用。
胺可以参与亲电取代、缩合和氧化等反应,而酰胺主要参与羟胺化、加氢和脱酰等反应。
对这些反应的深入研究可以为新的有机合成方法的开发和有机化学的进一步应用提供重要的基础。

胺和酰胺的知识点总结一、胺。
1. 定义与结构。
- 胺可以看作是氨(NH_3)分子中的氢原子被烃基取代后的产物。
- 根据胺分子中氮原子上所连接的烃基数目不同,可分为伯胺(R - NH_2,氮原子上连接1个烃基)、仲胺(R_2NH,氮原子上连接2个烃基)和叔胺(R_3N,氮原子上连接3个烃基)。
当氮原子上连接4个烃基时形成季铵盐(R_4N^+X^-)或季铵碱(R_4N^+OH^-)。
2. 命名。
- 简单胺的命名:以胺为母体,在烃基名称后面加上“胺”字。
例如,CH_3NH_2称为甲胺;(CH_3)_2NH称为二甲胺;(CH_3)_3N称为三甲胺。
- 当烃基相同时,用二、三表示烃基的数目;当烃基不同时,将简单的烃基写在前面,复杂的烃基写在后面。
例如,CH_3CH_2NHCH_3称为甲乙胺。
- 对于芳香胺,若- NH_2直接连在苯环上,命名时在“胺”字前面加上芳基的名称。
例如,C_6H_5NH_2称为苯胺。
3. 物理性质。
- 低级胺(如甲胺、二甲胺、三甲胺等)为气体,丙胺以上为液体,高级胺为固体。
- 胺具有特殊的气味,低级胺有类似于氨的气味,有的还有鱼腥味。
- 胺分子间能形成氢键,但由于氮的电负性比氧小,所以胺形成的氢键比醇弱,其沸点比相对分子质量相近的醇低,但比相对分子质量相近的烃高。
4. 化学性质。
- 碱性。
- 胺分子中氮原子上有孤对电子,能接受质子,所以胺具有碱性。
- 胺的碱性强弱顺序为:脂肪族仲胺>脂肪族伯胺>脂肪族叔胺>氨>芳香胺。
脂肪族胺的碱性比氨强,是因为脂肪烃基为推电子基,使氮原子上的电子云密度增大,更容易接受质子;而芳香胺的碱性比氨弱,是因为苯环的吸电子作用,使氮原子上的电子云密度降低。
- 与酸反应。
- 胺能与酸反应生成盐。
例如,甲胺与盐酸反应生成甲胺盐酸盐:CH_3NH_2+HCl→CH_3NH_3^+Cl^-。
胺盐为离子化合物,一般为白色固体,易溶于水而不溶于有机溶剂。


《胺和酰胺》讲义一、胺胺是一类含有氮原子的有机化合物,在有机化学中具有重要的地位。
胺可以看作是氨(NH₃)分子中的氢原子被烃基取代后的产物。
根据胺分子中氮原子上所连接的烃基种类和数目不同,胺可以分为以下几类:1、脂肪胺脂肪胺是指氮原子与脂肪烃基相连的胺。
例如,甲胺(CH₃NH₂)、乙胺(CH₃CH₂NH₂)等。
脂肪胺的化学性质较为活泼,能与酸发生反应生成盐。
2、芳香胺芳香胺是指氮原子与芳香烃基相连的胺。
比如苯胺(C₆H₅NH₂)。
芳香胺通常具有特殊的气味,且在化学性质上与脂肪胺有所不同。
胺的物理性质也有一定的特点。
低级脂肪胺在常温下是气体,随着碳原子数的增加,逐渐变为液体或固体。
胺的沸点比相对分子质量相近的醇低,这是因为胺分子间的氢键作用较弱。
胺的化学性质丰富多样。
胺具有碱性,这是由于氮原子上有孤对电子,可以接受质子。
其碱性强弱与氮原子上电子云密度有关。
一般来说,脂肪胺的碱性大于芳香胺。
胺还能发生酰化反应。
例如,与酰氯或酸酐反应,生成酰胺。
胺的制备方法也有多种。
氨的烷基化是一种常见的方法,即将氨与卤代烃在一定条件下反应。
此外,硝基化合物的还原也是制备胺的重要途径。
二、酰胺酰胺是羧酸中的羟基被氨基(或胺基)取代而形成的化合物。
酰胺的结构特点使得其具有独特的性质。
从物理性质来看,除了少数低级酰胺为液体外,多数酰胺为固体。
由于酰胺分子间可以形成氢键,因此其熔点和沸点通常较高。
在化学性质方面,酰胺具有水解性。
在酸或碱的催化下,酰胺可以水解为羧酸和氨(或胺)。
酰胺的制备通常通过羧酸与胺的缩合反应来实现。
在一定条件下,羧酸和胺反应脱去一分子水,生成酰胺。
酰胺在有机合成和生物化学中都具有重要的意义。
在有机合成中,酰胺是重要的中间体,可以通过进一步的反应转化为其他化合物。
在生物化学中,许多生物大分子如蛋白质,其结构中就包含酰胺键。
三、胺和酰胺的关系胺和酰胺之间存在着密切的联系。
一方面,胺可以通过与羧酸或其衍生物反应转化为酰胺。

《胺和酰胺》讲义一、胺胺是一类含有氮原子的有机化合物,在有机化学中具有重要的地位。
胺可以根据氮原子上所连接的烃基数目分为一级胺(伯胺)、二级胺(仲胺)和三级胺(叔胺)。
如果氮原子上连接了一个烃基,就是一级胺;连接了两个烃基,就是二级胺;连接了三个烃基,就是三级胺。
胺的命名通常采用习惯命名法和系统命名法。
习惯命名法是在烃基名称后面加上“胺”字。
比如甲胺、乙胺等。
系统命名法则是把胺看作是烃的氨基衍生物,以烃为母体,氨基作为取代基。
胺具有碱性,这是由于氮原子上的孤对电子能够接受质子。
不同的胺碱性强弱有所不同。
一般来说,脂肪胺的碱性强于芳香胺。
这是因为芳香胺中氮原子上的孤对电子与苯环存在共轭作用,使得电子云密度降低,碱性减弱。
胺在生活和工业中有着广泛的应用。
例如,甲胺是合成许多农药和药物的重要原料;乙二胺常用于制造纤维和塑料等。
胺的制备方法有多种。
比如通过卤代烃与氨的反应,可以得到不同级别的胺。
此外,腈的还原也是制备胺的常用方法。
二、酰胺酰胺是羧酸中的羟基被氨基(或胺基)取代而形成的化合物。
酰胺的结构中,氮原子与羰基通过双键相连,形成了一个比较稳定的结构。
酰胺的命名通常是根据相应的羧酸和胺来命名的。
例如,乙酰胺是由乙酸和氨反应生成的。
酰胺具有较高的熔点和沸点,这是因为酰胺分子之间可以形成氢键,增加了分子间的作用力。
酰胺在化学性质上相对较为稳定,但在一定条件下也能发生水解反应。
水解可以在酸性条件下进行,也可以在碱性条件下进行。
在酸性条件下,水解生成羧酸和铵盐;在碱性条件下,水解生成羧酸盐和氨。
酰胺在生物体内也有着重要的作用。
例如,蛋白质中的肽键就是一种酰胺键,它对于维持蛋白质的结构和功能起着关键作用。
在工业上,酰胺也是许多聚合物的重要组成部分,如尼龙等。
三、胺和酰胺的相互转化胺和酰胺之间在一定条件下可以相互转化。
例如,通过羧酸和胺的缩合反应可以生成酰胺。
而酰胺在一定条件下(如强还原剂的作用)也可以被还原为胺。



有机化学胺类和酰胺的性质和反应有机化学中,氨基基团(-NH2)是常见的官能团之一。
氨基基团可以连接到碳骨架上的不同位置,形成胺类和酰胺。
本文将详细描述胺类和酰胺的性质和反应。
一、胺类的性质和反应1. 胺类的命名与分类胺类按照氨基基团的数量和位置可以分为一级胺、二级胺和三级胺。
一级胺指的是一个碳原子与一个氢原子通过一个键连接,二级胺指的是一个碳原子与两个氢原子通过一个或两个键连接,三级胺指的是一个碳原子与三个氢原子通过一个或两个键连接。
胺类的命名通常使用它们在有机分子中的名称,例如甲胺、乙胺等。
如果一个有机分子中含有多个氨基基团,将其位置和数量用前缀表示,如乙二胺表示乙醇胺。
2. 胺类的物理性质由于氨基基团的电子给予性质,胺类通常呈碱性。
一级胺和二级胺可形成氢键,使它们的沸点和溶解度较高。
与醇类相比,胺类的沸点和溶解度较低,主要是由于胺分子之间较弱的分子间作用力。
3. 胺类的化学性质和反应(1)胺的碱性反应由于氨基基团的弱碱性,胺类可以与酸反应,形成盐。
例如,乙胺与盐酸反应生成乙胺盐酸盐(C2H5NH3Cl)。
(2)胺的氧化反应一级胺在氧化剂的存在下可被氧化为亚硝胺。
例如,乙胺与亚硝酸反应生成亚硝基乙胺(C2H5NHOH)。
(3)胺的磷酸化反应胺类可与磷酰氯反应生成相应的磷酰胺。
例如,乙胺与磷酰氯反应生成乙基磷酰胺(C2H5NHP=OCl)。
(4)胺的取代反应胺类可发生取代反应,取代活泼氢原子的官能团可进一步反应。
例如,氯化乙酰与胺反应生成N-乙酰基乙胺(C2H5NHCOCH3)。
二、酰胺的性质和反应1. 酰胺的命名与分类酰胺是由酰基与胺基形成的化合物,通常按照胺基的数量和位置进行分类。
一级酰胺指的是一个碳原子与一个氨基基团通过一个键连接,二级酰胺指的是一个碳原子与两个氨基基团通过一个或两个键连接,三级酰胺指的是一个碳原子与三个氨基基团通过一个或两个键连接。
2. 酰胺的物理性质酰胺通常具有较高的沸点和溶解度,与醇类和胺类相比,酰胺分子之间的分子间作用力更强。

《胺和酰胺》知识清单一、胺胺是一类重要的有机化合物,在化学和生物领域都有着广泛的应用。
(一)胺的定义与分类胺可以看作是氨(NH₃)分子中的氢原子被烃基取代而形成的化合物。
根据取代氢原子的烃基数量不同,胺可以分为一级胺(伯胺)、二级胺(仲胺)和三级胺(叔胺)。
如果胺分子中含有一个烃基取代基,就是一级胺,例如甲胺(CH₃NH₂);含有两个烃基取代基的是二级胺,像二甲胺((CH₃)₂NH);含有三个烃基取代基的则为三级胺,比如三甲胺((CH₃)₃N)。
此外,按照胺分子中氮原子所连接的烃基种类,胺还可以分为脂肪胺和芳香胺。
脂肪胺中的氮原子连接的是脂肪烃基,比如乙胺;芳香胺中的氮原子连接的是芳香烃基,例如苯胺。
(二)胺的物理性质胺在常温下的状态与分子中所含烃基的结构和碳原子数有关。
低级脂肪胺,如甲胺、二甲胺和三甲胺等,通常为气体;中级脂肪胺,如乙胺和丙胺等,一般是液体;而高级脂肪胺和芳香胺多为固体。
胺的沸点比相对分子质量相近的非极性化合物要高,这是因为胺分子之间可以形成氢键。
但氮原子上所连接的烃基越多,形成氢键的能力就越弱,沸点也就越低。
胺在水中的溶解度与它们和水形成氢键的能力有关。
低级胺可溶于水,随着烃基的增大,其在水中的溶解度逐渐降低。
(三)胺的化学性质1、碱性胺具有碱性,这是因为氮原子上有孤对电子,可以接受质子。
脂肪胺的碱性比氨强,芳香胺的碱性则比氨弱。
在水溶液中,胺的碱性强弱顺序一般为:一级胺<二级胺<三级胺。
2、酰化反应胺可以与酰卤、酸酐等发生酰化反应,生成酰胺。
酰化反应可以用于保护氨基,也可以用于鉴别和分离胺。
3、磺酰化反应胺与苯磺酰氯反应生成相应的磺酰胺。
通过观察反应产物是否溶解于碱,可以鉴别一级胺、二级胺和三级胺。
4、与亚硝酸反应不同级别的胺与亚硝酸反应会生成不同的产物,这个反应可以用于鉴别胺的级别。
(四)胺的制备方法1、氨或胺的烃基化通过氨或胺与卤代烃在一定条件下反应,可以制备一级胺、二级胺和三级胺。
《胺和酰胺》讲义一、胺胺是一类含有氮原子的有机化合物,在有机化学中具有重要地位。
胺可以看作是氨(NH₃)分子中的氢原子被烃基取代后的产物。
根据氮原子上所连接的烃基种类和数目不同,胺可以分为以下几类:1、伯胺(一级胺)氮原子上连接一个烃基的胺称为伯胺。
例如,甲胺(CH₃NH₂)就是一种简单的伯胺。
2、仲胺(二级胺)氮原子上连接两个烃基的胺叫做仲胺。
像二甲胺((CH₃)₂NH)就属于仲胺。
3、叔胺(三级胺)氮原子上连接三个烃基的胺则为叔胺。
三甲胺((CH₃)₃N)就是常见的叔胺。
胺具有碱性,这是由于氮原子上的孤对电子能够接受质子。
胺的碱性强弱与氮原子上所连接的烃基结构有关。
一般来说,烃基给电子能力越强,胺的碱性就越强。
例如,脂肪胺的碱性通常比芳香胺强,因为脂肪烃基的给电子能力大于芳香烃基。
胺在有机合成中是非常重要的中间体。
例如,通过胺的酰化反应可以制备酰胺;胺还可以与卤代烃发生亲核取代反应,用于增长碳链。
胺在生物体内也发挥着重要作用。
许多生物活性分子,如氨基酸、生物碱等都含有胺的结构。
二、酰胺酰胺是羧酸中的羟基被氨基或胺基取代后形成的化合物。
它可以看作是羧酸和胺反应的产物。
酰胺具有以下一些重要的性质:1、物理性质酰胺分子间可以通过氢键形成较强的相互作用,因此其沸点通常比相应的羧酸和胺都要高。
大多数酰胺是固体,具有较高的熔点。
2、化学性质酰胺的化学性质相对稳定,在一般条件下不易发生水解反应。
但在强酸或强碱以及长时间加热的条件下,酰胺可以水解为羧酸和胺。
酰胺在有机合成中也有广泛的应用。
例如,通过酰胺的霍夫曼降解反应可以制备少一个碳原子的胺。
在生物体内,蛋白质就是由氨基酸通过酰胺键(肽键)连接而成的大分子。
三、胺和酰胺的相互转化胺和酰胺之间可以通过一系列反应相互转化。
1、胺制备酰胺胺与羧酸或其衍生物(如酰氯、酸酐)在一定条件下反应,可以生成酰胺。
例如,乙胺(CH₃CH₂NH₂)与乙酸酐反应,生成乙酰胺(CH₃CONHCH₂CH₃)。
5.2胺和酰胺一、教学目标1.通过与氨的类比认识胺的结构和性质。
2.能对胺类化合物进行命名。
3.能运用胺的性质解释某些制药工艺。
4.认识酰胺的结构特征,能类比酯说明酰胺的主要性质。
5.能举例说明胺、酰胺类化合物在药物合成中的重要作用。
二、教学重难点重点:1.胺的性质;2.酰胺的性质。
难点:酰胺的性质。
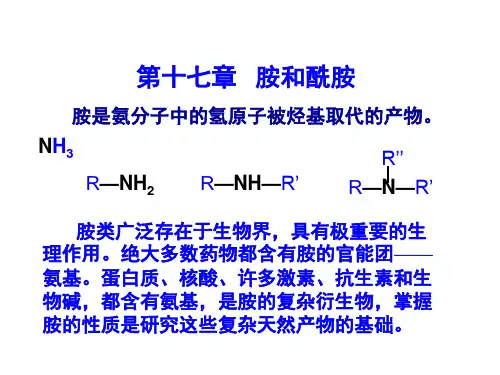
三、教学方法总结归纳法、分组讨论法等四、教学过程【导入】展示常见感冒药主要成分【生】对乙酰氨基酚一、胺的结构与应用【讲解】1.胺的定义:氨分子中的氢原子被烃基取代而形成的一系列的衍生物称为胺。
胺的分子结构:与氨气类似,都是三角锥形。
2.胺的分类(1)根据氢上被烷基取代的数目,胺可分为一级胺(伯胺)RNH2,二级胺(仲胺)R2NH,三级胺(叔胺) R3N。
(2)根据胺分子中含有氨基的数目,可以将胺分为一元胺、二元胺、三元胺等。
(3)根据烃基的不同,胺可分为脂肪胺和芳香胺。
如乙胺CH3CH2NH2、苯胺C6H5NH2。
胺类广泛存在于生物界, 许多生物碱具有生理或药理作用。
3.结构简单的胺常用普通命名法,在烃基后直接加“胺”,如乙胺、二甲胺、苯胺等。
更多的胺类化合物则采用系统命名法,以烃为母体,氨基或烃氨基(—NHR,—NR2)作为取代基。
仲胺和叔胺, 当烃基相同时, 在烃基名称之前加词头“二”或“三”。
【生】单独完成胺类的命名【讲解】命名胺类化合物时应注意“氨”“胺”“铵”字的用法。
表示基团时用“氨”,如甲氨基(CH3NH—);表示氨的烃类衍生物时用“胺”;表示胺的盐时用“铵”。
伯、仲、叔胺中分别含有氨基(—NH2)、亚氨基(—NH—) 和次氨基()。
【讲解】4.胺的物理性质状态:低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体. 芳香胺是无色高沸点的液体或低熔点的固体,并有毒性.水溶性:低级的伯、仲、叔胺都有较好的水溶性。
随着碳原子数的增加,胺的水溶性逐渐下降。
【讲解】5.胺的化学性质与应用1、胺的碱性(1)与氨气结构相似,也具有碱性,可以与酸反应生成类似的铵盐。