QP-08反馈控制程序
- 格式:doc
- 大小:42.50 KB
- 文档页数:2

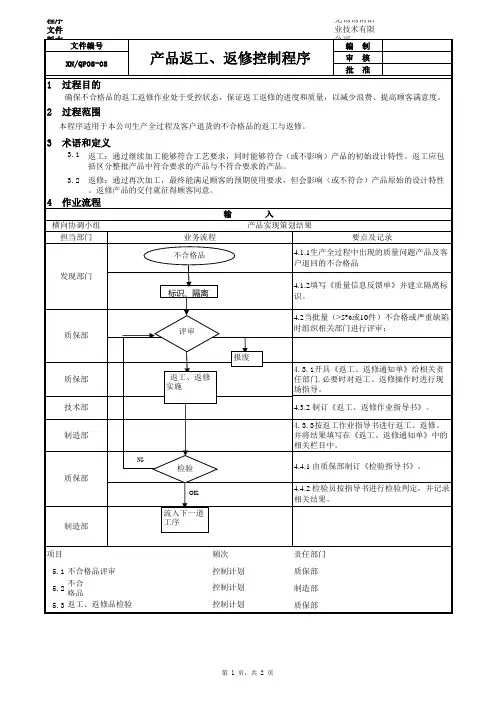

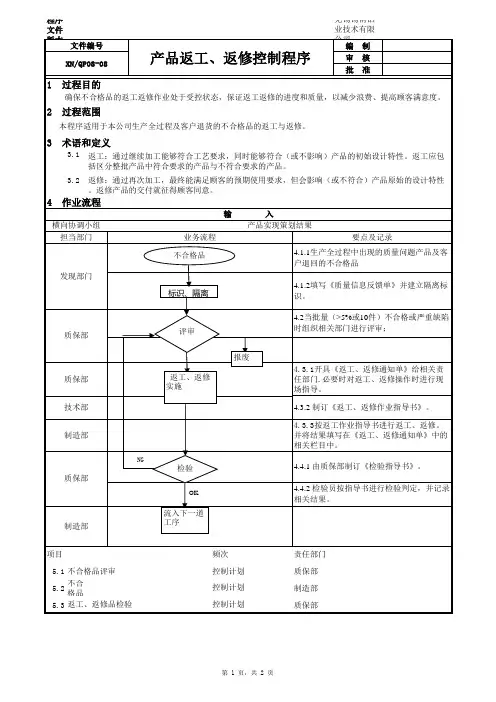
文件修订履历制/改订:日期:审核:日期:批准:日期:1.目的对生产过程中直接影响产品质量的各种因素进行控制,确保产品满足顾客的需求。
2.适用范围适用于本公司吸塑过程及相关的生产过程的控制,包括从原材料到成品入库前的过程控制。
3.职责3.1 生产部制定生产计划,负责生产设备的维护保养,生产设备的审批。
3.2工程部负责负责技术标准的制订、工艺技术文件的审核及批准。
3.4生产部确保作业现场基础设施适用及工作环境良好3.5生产部负责协调车间及各部门的生产技术活动,组织实施作业指导书、操作规程的制订和相关生产活动的协调和安排。
3.6品管部负责按照《产品检验控制程序》以及检验指导书、图纸、工艺卡等进行相关过程的产品的检验和试验控制。
4.工作程序4.1过程策划由相关人员进行工艺、设备、工装、生产、检验等的策划,如需要,相关人员应编制必要相应的工艺卡、检验指导书、作业指导书和操作规程,现场使用的各类作业指导书和用于指导生产的各种样品/样件、缺陷图片等须放置在相应工位处,使操作人员易于得到。
4.2 生产计划4.2.1 根据合同评审的结果,考虑库存情况,结合车间的生产能力,制订各车间制定生产计划并将随供应、生产、销售等情况的变动,在适当的时候进行修改。
4.2.2 车间根据生产计划安排生产,并填《领料单》向仓库领取所需物料,并统计每天的产量,以生产日报表的形式统计每月生产的完成情况。
对于调整排期后,仍然无法加工的工件,申请外发加工,按《供应商管理和采购控制程序》执行。
4.3原材料、外购、外协件控制4.3.1品管部负责对进厂的原材料、外购、外协件实施入库检验控制。
按《产品的监视和测量控制程序》的规定执行,杜绝不合格的原材料、外购、外协件被投入生产和使用。
发现不良或偏差时,应按《不合格品控制程序》或《不合格和纠正措施程序》的要求,及时发单通知车间采取相应纠正措施。
4.3.2仓库管理人员必须严格按照的规定作好产品标识和批次管理。

文件名称采购控制程序页码1/5修订覆历表NO. 更改章节更改日期更改后版本1234567891011121314151617181920文件名称采购控制程序页码2/51.0目的为了规范采购作业,对供应商进行评估和选择,确保以最适宜的品质、单价、时间、数量提供生产所需之物料,以保证所采购的物资符合规定的采购要求。
2.0适用范围本程序适用于公司所需之原材料、机器、仪器、模具、治具及非生产用物品(消耗品、办公用品)的采购作业及供方的选择、评价和控制。
3.0职责3.1.采购:3.1.1.负责供应商的开发,询价议价等工作。
3.1.2.负责生产物料、辅助物料及机器设备(含仪器)的采购。
3.1.3.与其它单位一起作供应商评估。
3.1.4.负责向供应商跟催原物料的采购进度。
3.1.5.采购单变更协调处理。
3.2.品管3.2.1.负责所有来料的质量验收和供应商送样的确认。
3.2.2.协助采购作供应商评估。
3.2.3.负责进料异常的联络处理。
3.3.仓库3.3.1.负责来料点收及存贮管理。
3.3.2.协助采购处理不良品作业。
3.3.3.配合采购跟催原物料的进度。
3.4.工程部3.4.1.协助品管对物料的特性制定检验方案,对来料品质异常做工程评估。
3.4.2.负责仪器,机器等大型设备的请购工作。
4.0定义无5.0工作程序5.1.供应商分类:采购课按照采购物料对本公司产品实现和最终产品的影响,将本公司采购的物料分为A、B、C、D四类,提供这四类物料的供应商则相应为A、B、C、D类供应商5.1.1.A类:指直接影响本公司产品最终质量和性能的物料(订单原物料)。
文件名称采购控制程序页码3/55.1.2.B类:对产品质量的辅助功能有一定影响,对最终产品质量无直接影响的物料(订单辅料),如包装材料。
5.1.3.C类:因生产出货紧急,而找的临时性供应商;5.1.4.D类:检测仪器、设备等,具体按《监视和测量设备》、《设施设备控制程序》作业。

**科技股份有限公司昆山**電子有限公司文件編號:QP08主辦部門:運籌部版本:T發行章:1.目的通過適當的控制與管理過程,使生管排程計劃得以順利進行。
2.適用範圍凡公司所生產之產品均屬之。
3.權責運籌部生物管執行管理,各單位依其職權協辦之。
4.參考文件4.1 QP07倉儲管理程序4.2 QP09製造管理程序4.3 QP13進料檢驗管理作業程序5.定義略6.內容6.1 生產排程作業程序6.1.1 產銷會議6.1.1.1 生物管固定於每週一召集業務、採購、製造等相關單位人員,召開產銷會議,討論物料&生產排程&後續出貨狀況;生管、業務異常情況提報。
6.1.2 計劃需求:6.1.2.1 物管於產銷會議前,每週三業務單位提供物控行銷預測分析資料,客戶當月&下月需求JIT(日交貨排程),物控依據資料結合原物料交期之長短進行購料,原物料L/T(訂單備貨期)超過4周以上,黑色字體依業務單位提供之行銷預測備料,紅色及藍色均需经業務確認後備料。
原物料L/T在4周之內,依業務單位提供之客戶當月&下月需求JIT備料.並彙整周需求計劃表,及時補充請購,缺料資訊提供採購單位協助確認材料交期,以提供業務單位接獲客戶訂單時之生產物料所需。
6.1.2.2 生管於產銷會議前,每週三業務單位提供生物管單位行銷預測分析資料,客戶當月&下月需求JIT,生管可依據資料在「生產排程計劃表」中進行產能之估計,以提供業務單位接獲客戶訂單時之生產產能所需。
6.1.2.3「月生產排程計劃表」應於當月之最後一周,完成下個月之「月生產排程計劃表」,並以電子郵件通知工程/品保/製造等相關單位安排生產作業事宜。
6.1.3訂單需求6.1.3.1 生管接獲業務單位之需求後,查詢製成品之庫存數量,如無法滿足業務單位之需求時,物控查詢半成品、原物料庫存、供應商在途數量、進料日期等資讯。
生管依據物料狀況及產能狀況於2個工作天內回復業務單位交期。

内部审核控制程序受控状态持有者发放号编制:日期:2011/07/01审核:日期:2011/08/01批准:日期:2011/08/01新昌恒大建设有限公司1、目的为评价质量管理体系运行的有效性和保持与ISO9001:2000标准的符合性而进行内部质量审核,制定本程序。
2、范围本程序适用于对公司质量体系进行内部审核。
3、相关/支持性文件QP-05-01 管理评审控制程序QP-08-06 纠正和预防措施控制程序4、职责4.1办公室负责本程序的制定并编制内部质量审核年度计划。
4.2管理者代表领导内部质量体系审核,任命审核组长。
4.3审核组长推荐内部审核组名单,报管理者代表批准。
编制具体的《审核日程计划》,并把审核计划分配到每个审核员。
内审结束后应根据审核结果编写审核报告。
4.4 审核员应根据《审核日程计划》的分工编写检查表,实施审核检查,编写不合格报告等。
4.5 各受审部门应积极配合审核组的工作,包括向审检组提供查看现场、文件、记录和进行访谈、调查等工作的便利条件,对提出的不合格报告制定并实施相应的纠正措施。
5、工作程序5.1内部质量体系审核的频次和范围5.1.1 频次常规内部审核由办公室每年年初编制年度的内部质量体系审核计划(每年至少一次,两次内审间隔时间不超过12个月),由管理者代表批准。
下列特殊情况下应追加审核的频次:(a)发生了严重的质量问题或用户有重大投诉;(b)公司的质量方针、内部机构等有较大的改变;(c)在第二、第三方审核前。
5.1.2 范围每年内审的范围至少应覆盖公司所有与质量有关的部门、单位和项目,及公司质量管理体系的所有过程一遍。
5.2审核依据内审的依据可包括:(a)ISO9000:2000标准;(b)国家法律法规、行业规程规范、上级有关文件;(c)公司质量手册、程序文件、规章制度;(d)合同;(e)作业指导书等。
5.3 审核准备5.3.1 审核组成员应培训合格并被公司授权。
审核员不能审核自己工作。

Document No.: Production Material Planning Control ProcedurePage of 81Document Number and Revision文件编号及版本:ZAE-QP-008 Rev · 2Document Title 文件题目:Production Material Planning Control Procedure生产、物料计划控制程序Approvals(批准)Page No.1 2 3 4 5 6 7(页码)Rev. No.2 2 2 2 2 2 2(版本号)Page. No.8(页码)Rev. No.2(版本号)生效日期Effective date:Jun 08, 2011Document No.: Production Material Planning Control ProcedurePage of 82 Revision History (更改历史):Revision (更改)From ToDate(日期)Revision Description(更改内容)Changed by(更改人)Checked by(复核人)0 1 2Mar 1, 2010Jan 10,2011Jun 08,2011New Document7.2生产计划及物料计划由PMC主管批准7.2生产与物料计划的制定Chary HuangAngus ChenDaisy LiaoLand LiangWayne GuoKobe LongDocument No.: Production Material Planning Control ProcedurePage of 83 CONTENTS (目录)1.0 目的PURPOSE2.0 范围SCOPE3.0 定义DEFINITION4.0 参考文件REFERENCE5.0 职责RESPONSIBILITY6.0 资格和培训QUALIFICATION AND TRAINING7.0 程序PROCEDURE7.1 订单的接收Receive Customer Order7.2 生产与物料计划的制定Prepare production and material plan7.3 采购申请单的审核Approve the Purchase Request7.4 物料的跟进Material tracking7.5 生产任务单的下达Release Manufacturing Order7.6 物料的发放Material Issuing7.7 生产计划的跟进Follow up the Production Schedule7.8 协助船务出货Coordinate the shipment with Shipping8.0 记录RECORD9.0 附录APPENDIXDocument No.: Production Material Planning Control ProcedurePage of 841.0 目的Purpose:为确保物料能准时到位,生产能顺利完成,合理调配相关资源,制订本程序。

目录1. 目的 (3)2. 范围 (3)3. 职责 (3)3.1 质检部 ..................................................................................................................... 错误!未定义书签。
3.2 相关单位 (3)3.3 管理者代表 (3)4. 术语定义 (3)5. 内容 (3)5.1 采取纠正及纠正措施的时机 (3)5.2 纠正和纠正措施的实施的规范和流程 (4)5.3 纠正和纠正措施的结案 (4)6. 预防措施 (4)6.1 本公司预防措施的种类 (4)6.2 预防措施的实施 (5)7. 相关文件 (5)8. 相关记录 (5)1.目的规范纠正或预防措施的制定,评审与实施,保证纠正或预防措施的有效性,实现质量管理体系的持续改进。
2.范围适用于美格尔医疗对现存或潜在的不合格品、不合格服务和质量管理体系的不合格项等的控制活动。
3.职责3.1质检部负责此程序文件的制定与修改,监督此程序的执行。
主导不合格品和质量管理体系中的不合格项的纠正和纠正措施的制度、预防措施的识别与跟踪落实。
3.2相关单位负责制定和执行相应的纠正和预防措施。
3.3管理者代表负责核准纠正及纠正措施的方案。
4.术语定义4.1纠正消除已发现的不合格而采取的措施。
4.2纠正措施为消除已发现的不合格原因,防止不合格再发生所采取的措施。
4.3预防措施为消除潜在的不合格原因,防止不合格发生所采取的措施。
5.内容5.1采取纠正及纠正措施的时机5.1.1成品检验出现批量不合格时;5.1.2物料检验批量不合格时;5.1.3较大质量事故。
5.1.4内部审核或外部审核发现不合格项;5.1.5数据分析结果所要求的纠正和预防措施;5.1.6公司年度质量目标未达成时;5.1.7各部门或人员认为需要采取纠正预防和措施的其它时机。
XX/QP-08 风险管理控制程序C版1. 目的为满足YY/T0287、YY/T 0316的要求,根据YY/T 0316标准,对产品的风险管理作出规定,通过此规定判定与产品有关的危害,估计和评价风险,控制这些风险,并监控控制的有效性,从而确保公司生产的产品按预期用途使用时,对病人和使用者的风险降低到可接受水平。
2. 范围适用于公司开发和生产的产品在医疗器械寿命周期的所有阶段的风险管理。
3. 职责3.1 技术部负责进行风险管理。
在适当的场合对产品进行风险分析,风险评价和风险控制,提出风险降低措施和对措施实施情况进行验证,并形成风险分析结果报告。
同时对生产后的信息进行定期或不定期的评审,判断再次进行风险分析、评价和控制的必要性。
风险管理必要时应有临床背景的专家等相关人员参与。
3.2 各相关部门负责相关产品信息的提供和风险降低措施的实施。
4. 正文4.1 风险管理的应用场合风险管理即对产品的开发、生产、销售、使用等各个环节中出现的影响产品安全性和有效性的风险进行风险分析和风险评价,提出风险降低措施并予实施、验证从而将风险降低到可接受水平的一系列管理活动。
其主要适用于以下场合:4.1.1 新产品和有重大变更型号规格变更品的设计开发过程中可分为三个部分:设计风险的风险管理、过程风险的风险管理、使用风险的风险管理。
a. 设计风险是指在设计输入时应考虑的产品设计中的可能存在的风险;b. 过程风险是指在设计输出时应考虑的产品试制或生产过程中可能存在的风险;c. 使用风险是指在设计确认时应考虑的产品被患者使用时的可能存在的风险。
4.1.2 对产品生产后的信息进行定期或不定期地评审,从而实施的风险管理活动,包括:a. 通过市场监督、市场调查及顾客投诉等发现了新的风险;b. 产品认证或体系认证等场合所必需进行的产品回顾性风险分析;c. 应国家法律法规的变化及新技术、新材料应用要求的过程中发现了新的风险;d. 定期评审(一般每年1次)中发现了新的风险。
QP08 确定关键控制点控制程序1 目的更有效地预防监控,使食品危害消除或降低到可接受的水平。
2 适用范围适用于对食品造成显著危害的一个点、一个步骤或过程的确定。
3 职责生产部负责对关键控制点的判断和确定。
4 程序4.1关键控制点(CCP)食品安全危害能被控制的,能预防、消除或降低到可接受水平的一个点、步骤或过程。
4.1.1 当危害能被控制和预防时,这些点可以被认为是关键控制点。
4.1.2 能将危害消除的点可以确定为关键控制点。
如:瓶内有碎玻璃、木塞碎屑、尘土等异物能通过灯检设备检出。
4.1.3 能将危害降低到可接受水平的点可以确定为关键控制点。
4.2 控制点(CP)能控制生物、物理或化学因素的任何点、步骤或过程。
在工艺流程图中除CCP点之外的许多点可以认为是控制点。
这些点可以记录对安全卫生及质量因素的控制。
4.3 多种关键控制点和危害一个关键控制点能用于控制一种以上的危害。
同样,一个以上的关键控制点可以用来控制一种危害。
4.4生产和加工的特殊性决定关键控制点的特殊性在一条加工线上确立的某一产品的关键控制点,可以与另一条加工线上的同样的产品的关键控制点不同,这是因为危害及其控制的最佳点随厂区、产品配方、加工工艺、设备、配料选择、卫生和控制程序等因素而变化。
4.5 确定CCP的方法4.5.1 可以用“CCP判断树表”来确定。
4.5.2 可以用危害发生的可能性及严重性来确定。
如果经危害分析认为是危害,应对这种危害在加工工艺过程中产生的可能性及严重性进行分析;而且经分析危害可能产生,一旦产生就具有严重性,则此种危害就必须设置为CCP点来控制。
5 相关文件及记录5.1 《HACCP计划表》。
1. 目的:规定了防错装置设计和使用的关键要求,使操作者从错误中解脱出来,消灭失误,实现零缺陷生产,集中精力增值的操作。
2. 适用范围:2.1新产品设计阶段考虑防错。
2.2现有制造过程的防错控制。
2.3纠正/预防措施的策划和实施过程。
3、定义3.1 防错:又叫防呆,顾名思义就是防止呆笨的人做错事的一种方法,是一种一经采用,错误就不会发生,可以消灭错误,或错误发生的几率减至最低程度的科学方法,它能在缺陷产生前发现错误或缺陷产生时能及时发现与分离出错误。
3.2 防错标准样件:又叫边界样件,是指通过防错装置时能证明不符合操作或者能被探测出的不合格产品,专门用于检测生产线的防错装置。
3.3 备份模式:也称备用方案,是指防错装置失效后,在保证质量的前提下,为保证正常生产而采取的临时措施,如100%的人工检测;使用其他替代性的检验工具等。
4. 职责:4.1 过程设计(包括设计变更)时:开管部负责组织包括制造、售后服务、质量、供方等人员组成的小组进行防错设计。
4.2 安全防错装置由生产部负责设计。
4.3 质量部和开管部负责对防错应用的确认和审核。
5. 工作程序:5.1 开发阶段防错装置的设立5.1.1 在产品开发的初期,依据类似产品的经验(产品不合格报告、顾客意见和抱怨、服务中反馈的信息、市场调研的信息、管理评审中的信息、审核中的信息收集产品存在的问题)、同类厂家的设立情况等来考虑防错装置的设立。
原则上但不限于以下几方面应考虑设立防错装置。
●涉及性能、安全方面的●风险系数和严重度高的●挑战件的防错●关键特殊特性优先考虑防错装置的使用5.1.2 在设计和设计验证阶段,防错是DFMEA和PFMEA的关键输出。
5.1.3 所有在设计和设计验证阶段输出的防错应体现在控制计划中,并在批量生产阶段被严格执行,同时对可行性进行确认。
5.2 防错作业指导书●立即停机;●向班组长汇报;●上次防错装置验证有效之后的产品应全数检查,并做好记录。
文件内容修订记录页1.目的明确计量及测试器具的管理要求,包括分类、检验、管理等,确保计量及测试器具得到良好的保管和使用。
2.范围公司所使用的所有计量及测试器具。
3.职责技质部负责计量及测试器具的送外校准;使用部门负责计量及测试器具的管理。
4.流程图无。
5.工作程序5.1 设备管制仪器须由技质部核实后,登记于《计量及测试器具台帐》以便管理。
所有检验、测量与试验设备应确定其准确度和精确度。
5.2 仪器校正根据检验需求,本身校正能力及追溯国家标准要求,将量规仪器校正分为三类。
1)免校正仪器:不直接影响产品质量或仅供参考时,或本公司及外部机构无校正能力时,可由该仪器供货商出示出厂合格证明,即可予以免校正,并贴上“免校正”字样标示。
2)外校仪器:本公司不可执行校正之仪器,选择外部合格校正机构进行校正。
但必须确认其校正标准可追溯国家或国际标准时方可选择。
5.3 校正周期外校仪器的校正周期依校正机构所出示的校正报告而定。
5.4 校正执行:5.4.1 外校:1)量规仪器安排外校时,由技质部统筹安排。
2)选择送校时,须注意量规仪器的装箱、搬运条件,以不损坏量规仪器为主。
5.4.2校正不合格时,由使用单位填写《报废申请单》申请报废,质检员在《计量及测试器具台帐》上注明报废。
对该设备以往测量结果的有效性再评价和记录,对任何受影响的产品追踪并记录结果。
5.5 校正标签所有仪器均应贴上标签,标签可按仪器大小缩放,亦可贴于仪器外盒。
5.6 检验,测量与试验设备的维护与保养1)日常维护保养:各使用人员在使用时前,应将仪器擦干净,保持其清晰度,并检查仪器各部位正常与否,若不正常及时送技质部安排修理。
2)维护保养:使用单位对仪器进行维护保养,技质部对其进行监督管理。
大型仪器在保修期内可由厂商进行维修,并提供证明由使用单位保存,作为仪器维护之依据。
3)各使用人员在发现仪器损坏或发生其它意外之状况时,应立即停止使用该仪器,并将具体情况知会技质部人员,适时应重新检验该仪器检验过的产品,确保不合格品不流入下一工序。