cochrane纳入的RCT文献质量评价中文版
- 格式:doc
- 大小:93.50 KB
- 文档页数:5

cochrane检索临床实验Cochrane是一个国际性的非营利性组织,致力于促进健康护理的实证医学研究和决策。
Cochrane检索是一种广泛使用的方法,用于发现、评估和综合现有的临床实验。
在现代医学研究中,随机对照试验(RCT)是最可靠的研究设计之一。
它可以最大程度地减少系统偏倚,提供有关特定干预措施的最可靠证据。
Cochrane检索就是为了找到、筛选和整合RCT研究设计提供的一种系统性方法。
Cochrane检索的目的是阐明某一特定问题或干预措施在特定人群中的效果。
该方法通过搜索和筛选已发表的RCT文章,以找到高质量的证据,并通过Meta分析的手段进行综合。
通过这种方式,研究人员可以更全面地揭示干预措施的实际效果,从而为临床决策提供更可靠的依据。
Cochrane检索一般由以下几个步骤组成:1. 研究问题的明确化:在进行Cochrane检索之前,首先需要明确研究的具体问题。
例如,我们想了解特定药物在治疗某种疾病时的有效性和安全性。
2. 检索文献:利用Cochrane Library等数据库进行文献检索,并严格遵循预先设定的搜索策略。
通过关键词和筛选条件,筛选出与研究问题相关的潜在研究。
3. 筛选文献:根据预设的纳入和排除标准,对检索到的文献进行筛选。
通常会根据文摘或全文进行初步筛选,进一步筛选出符合要求的RCT研究。
4. 评估研究质量:对筛选出的RCT研究进行质量评估,以确定其可靠性和可信度。
常用的工具包括Cochrane Risk of Bias工具等。
5. 数据抽取和分析:对纳入的RCT研究进行数据抽取和统计分析,并使用Meta分析方法进行效果估计和综合比较。
6. 结果呈现和解释:将得到的结果进行整理、解释和报道。
常见的结果指标包括相对风险、绝对风险和效果大小等。
Cochrane检索的优势在于其严谨的方法学和高质量的证据。
通过系统性的检索和综合分析,可以更准确地评估干预措施的效果,并帮助医生和决策者做出更明智的临床决策。



Cochrane文献评价手册在医学和健康领域,Cochrane文献评价手册是一个备受推崇的参考资料。
它是一个致力于提供高质量、广度和深度兼具的文献评价和系统评价信息的权威评台。
通过对临床试验和其他医学研究进行全面评估和分析,Cochrane文献评价手册为医生、医学研究者和患者提供了宝贵的参考意见。
在Cochrane文献评价手册中,我们可以查找到各种主题的文献评价和系统评价,涵盖了从疾病预防到治疗、康复的各个方面。
无论是针对特定疾病、特定干预措施或特定人群的研究,Cochrane文献评价手册都提供了可靠的信息和意见,帮助人们做出更明智的医疗决策。
对于医学研究者来说,Cochrane文献评价手册提供了一个值得借鉴和学习的标准。
他们可以通过查阅Cochrane文献评价手册,了解到如何进行高质量的文献评价和系统评价,以及如何准确地汇总和分析研究结果。
这有助于提高他们的学术水平,促进医学研究的发展和进步。
对于医生和医疗工作者来说,Cochrane文献评价手册则是一个宝贵的临床参考工具。
他们可以在这里找到与自己临床实践相关的最新研究成果和最可靠的证据,以指导自己的临床决策。
这有助于提高临床实践的质量,保证患者获得更好的医疗服务。
对于患者和公众来说,Cochrane文献评价手册提供了一个可靠的信息来源。
他们可以在这里了解到关于自己健康问题的最新研究成果和治疗建议,从而更好地了解自身疾病,做出更明智的健康决策。
Cochrane文献评价手册是一个对医学研究、临床实践和健康决策都具有重要意义的权威评台。
它以其高质量、深度和广度兼具的文献评价和系统评价信息,为医学领域的各个参与者提供了宝贵的帮助和指导。
相信随着医学研究的不断进步和发展,Cochrane文献评价手册将为我们带来更多的惊喜和启发。
Cochrane文献评价手册作为权威评台,其对医学领域具有重要意义的确无庸置疑。
在现代医学研究中,由于信息的爆炸性增长和研究成果的不断涌现,医生和研究者需要一个可靠的参考工具来指导他们的决策和实践。
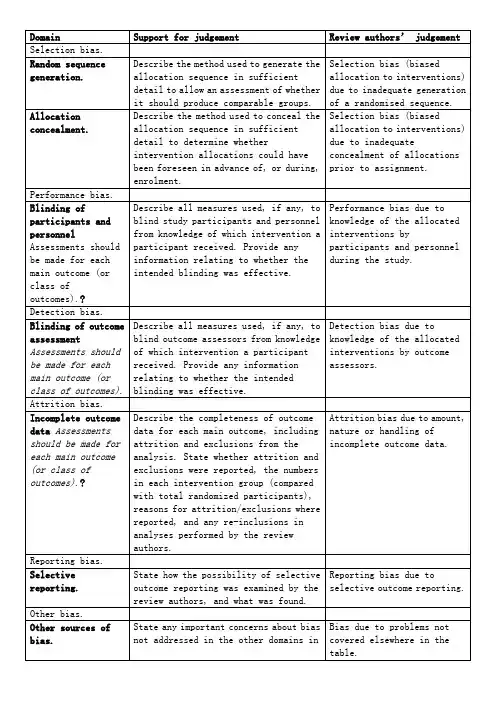
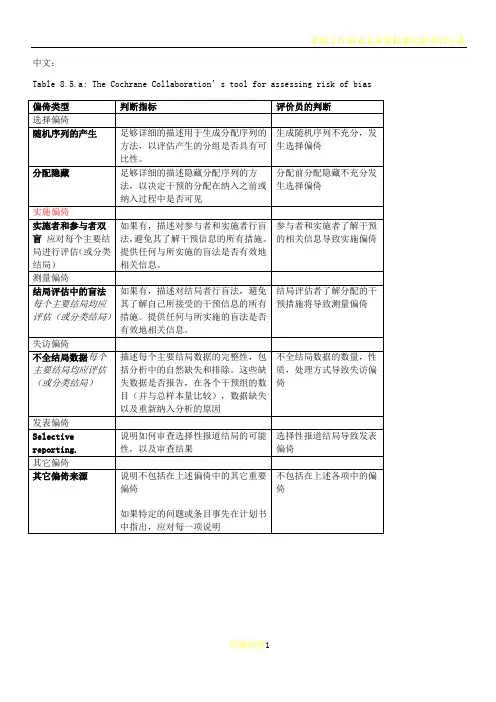
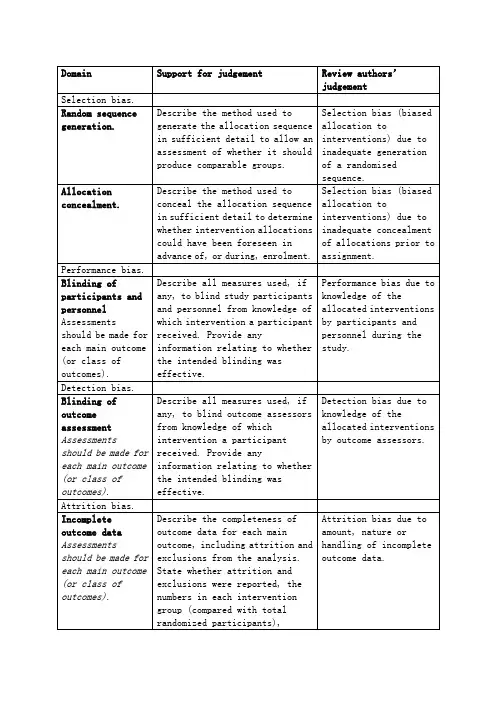
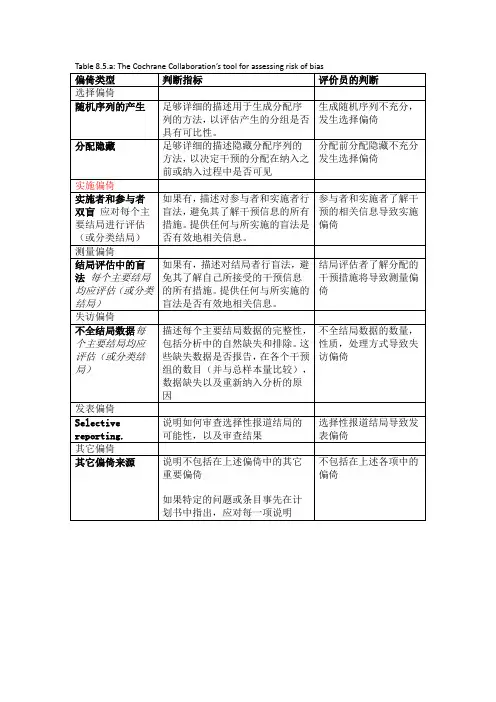
中文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment tool研究者描述随机序列产生过程譬如:参考随机数字表使用计算机随机数字生成器扔硬币洗牌的卡片和信封掷骰子抽签最小化*最小化,可实现无随机元素,被认为相当于是随机的。
研究者描述序列的产生使用的是非随机的方法。
通常是系统的非随机方法,例如:通过奇偶或出生日期产生序列通过入院日期产生序列通过类似住院号或门诊号产生序列相对于上面提到的系统方法,其它非随机的方法少见的多,也更明显。
通常包括对参与者进行判断或非随机的方法,例如:临床医生判断如何分配参与者判断如何分配基于实验室检查或系列测试的结果分配基于干预的可获取性进行分配中心分配(包括电话,网络,药房控制随机)相同外形的顺序编号的药物容器;顺序编号、不透明、密封的信封参与者以及纳入参与者的研究者可能事先知道分配,因而引入选择偏倚,譬如基于如下方法的分配:使用摊开的随机分配表(如随机序列清单)分发信封但没有合适的安全保障(如透明、非密封、非顺序编号)交替或循环出生日期病历号其它明确的非隐藏过程任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无缺失数据缺失数据的产生不大可能与真实结局相关(对于生存数据,删失不大可能引入偏倚)缺失数据的数目在各干预组相当,且各组缺失原因类似对二分类变量,与观察事件的发生风险相比,缺失比例不足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)不会大到影响观察的效应规模;缺失的数据用合适的方法进行估算任何如下标准:缺失数据的产生很大可能与真实结局相关, 缺失数据的数目及缺失原因在各干预组相差较大对二分类变量,与观察事件的发生风险相比,缺失比例足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)足以影响观察的效应规模;意向治疗分析中存在实际干预措施与随机分配的干预相违背的情况对缺失数据进行简单的不合适的估算任何如下标准:没有报道缺失或排除的情况,无法判断高风险或低风险(如未说明随机的数量,未提供数据缺失的原因)研究未描述此情况任何如下标准:实验的计划书可获取,系统评价感兴趣的所有首要或次要结局均按计划书预先说明的方式报道实验计划书不可得,但很明显发表的报告包括所有的结局,包括预先说明的结局(这种性质的有说服力的文字可能少见)任何如下标准:不是所有的预先说明的首要结局均被报道一个或多个首要结局为采用预先说明的测量方法、分析方法或数据子集来报道系统评价感兴趣的一个或多个首要结局报道不全,以至于不能纳入meta分析研究未报道此研究应当包含的主要关键结局具有与特殊试验设计相关的潜在偏倚来源或被指欺诈或其它问题可能存在偏倚风险,但存在以下两种中的一种没有足够信息评估是否存在其它重要的偏倚风险没有足够的证据认为发现的问题会引入偏倚Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies英文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment toolprocess such as:Referring to a random number table;Using a computer random number generator;Coin tossing;Shuffling cards or envelopes;Throwing dice;Drawing of lots;Minimization*.*Minimization may be implemented without a random element, and this isconsidered to be equivalent to being random.judgement The investigators describe a non-random component in the sequence generation process. Usually, the description would involve somesystematic, non-random approach, for example:Sequence generated by odd or even date of birth;Sequence generated by some rule based on date (or day) of admission;Sequence generated by some rule based on hospital or clinic recordnumber.Other non-random approaches happen much less frequently than thesystematic approaches mentioned above and tend to be obvious. Theyusually involve judgement or some method of non-random categorization ofparticipants, for example:Allocation by judgement of the clinician;Allocation by preference of the participant;Allocation based on the results of a laboratory test or a seriesof tests;Allocation by availability of the intervention.Criteria for a judgement Participants and investigators enrolling participants could not foreseeassignment because one of the following, or an equivalent method, was usedto conceal allocation:Central allocation (including telephone, web-based andpharmacy-controlled randomization);Sequentially numbered drug containers of identical appearance;Sequentially numbered, opaque, sealed envelopes.judgement Participants or investigators enrolling participants could possiblyforesee assignments and thus introduce selection bias, such as allocationbased on:Using an open random allocation schedule (e.g. a list of randomnumbers);Assignment envelopes were used without appropriate safeguards(e.g. if envelopes were unsealed or nonopaque or not sequentiallynumbered);Alternation or rotation;Date of birth;Case record number;Any other explicitly unconcealed procedure.Criteria for a judgement Any one of the following:No blinding or incomplete blinding, but the review authors judgethat the outcome is not likely to be influenced by lack of blinding;Blinding of participants and key study personnel ensured, andunlikely that the blinding could have been broken.judgementAny one of the following:No blinding or incomplete blinding, and the outcome is likely tobe influenced by lack of blinding;Blinding of key study participants and personnel attempted, butlikely that the blinding could have been broken, and the outcomeis likely to be influenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or ‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No blinding of outcome assessment, but the review authors judge thatthe outcome measurement is not likely to be influenced by lack ofblinding;Blinding of outcome assessment ensured, and unlikely that theblinding could have been broken.judgementAny one of the following:No blinding of outcome assessment, and the outcome measurement islikely to be influenced by lack of blinding;Blinding of outcome assessment, but likely that the blinding couldhave been broken, and the outcome measurement is likely to beinfluenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No missing outcome data;Reasons for missing outcome data unlikely to be related to trueoutcome (for survival data, censoring unlikely to be introducingbias);Missing outcome data balanced in numbers across interventiongroups, with similar reasons for missing data across groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk not enough to have a clinicallyrelevant impact on the intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesnot enough to have a clinically relevant impact on observed effectsize;Missing data have been imputed using appropriate methods.judgement Any one of the following:Reason for missing outcome data likely to be related to trueoutcome, with either imbalance in numbers or reasons for missingdata across intervention groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk enough to induce clinicallyrelevant bias in intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesenough to induce clinically relevant bias in observed effect size;‘As-treated’ analysis done with substantial departure of theintervention received from that assigned at randomization;Potentially inappropriate application of simple imputation.judgement ‘Unclear risk’ ofAny one of the following:Insufficient reporting of attrition/exclusions to permit judgement of ‘Low risk’ or ‘High risk’ (e.g. number ran domized not stated,no reasons for missing data provided);The study did not address this outcome.Criteria for a judgement Any of the following:The study p rotocol is available and all of the study’spre-specified (primary and secondary) outcomes that are of interestin the review have been reported in the pre-specified way;The study protocol is not available but it is clear that thepublished reports include all expected outcomes, including thosethat were pre-specified (convincing text of this nature may beuncommon).judgementAny one of the following:Not all of the study’s pre -specified primary outcomes have beenreported;One or more primary outcomes is reported using measurements,analysis methods or subsets of the data (e.g. subscales) that werenot pre-specified;One or more reported primary outcomes were not pre-specified(unless clear justification for their reporting is provided, suchas an unexpected adverse effect);One or more outcomes of interest in the review are reportedincompletely so that they cannot be entered in a meta-analysis;The study report fails to include results for a key outcome thatwould be expected to have been reported for such a study.judgementThere is at least one important risk of bias. For example, the study: Had a potential source of bias related to the specific study designused; orHas been claimed to have been fraudulent; orHad some other problem.judgement ‘Unclear risk’ ofThere may be a risk of bias, but there is either:Insufficient information to assess whether an important risk of bias exists; orInsufficient rationale or evidence that an identified problem willintroduce bias.Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。

The Joanna Briggs Institute Critical Appraisal toolsfor use in JBl Systematic Reviews澳大利亚JBI循证卫生保健中心对RCT的真实性评价RCT是原始研究中质量最高的证据,对RCT进行文献质量评价的工具有Cochrane协作网的评价工具,澳大利亚JBI循证卫生保健中心的评价工具,英国文献质量评价项目CASP的评价工具等。
澳大利亚JBI循证卫生保健中心(2016)对RCT论文的质量评价工具包含13个评价项目。
评价者需对每个评价项目做出“是”、“否”、“不清楚”、“不适用”的判断,并最终经过小组讨论,决定该研究是纳入、排除,还是需获取进一步的信息。
此评价工具具体条目如下所示。
澳大利亚JBI循证卫生保健中心对RCT的真实性评价评价项目评价结果1. 是否对研究对象真正采用了随机分组的方法?是否不清楚不适用2. 是否做到了分配隐藏?是否不清楚不适用3. 组间基线是否具有可比性?是否不清楚不适用4. 是否对研究对象实施了盲法?是否不清楚不适用5. 是否对干预者实施了盲法?是否不清楚不适用6. 是否对结果测评者实施了盲法?是否不清楚不适用7. 除了要验证的干预措施外,各组接受的其他措施是否相同?是否不清楚不适用8.随访是否完整,如不完整,是否采取措施处理失访?是否不清楚不适用9. 是否将所有随机分配的研究对象纳入结果分析?是否不清楚不适用10. 是否采用相同的方式对各组研究对象的结局指标进行测评?是否不清楚不适用11. 结局指标的测评方法是否可信?是否不清楚不适用12. 资料分析方法是否恰当?是否不清楚不适用13.研究设计是否合理?在实施研究和资料分析过程中是否有不同于标准RCT之处?是否不清楚不适用。

rct文献质量评价表
rct(随机对照试验)文献质量评价表通常包括以下几
个方面的评价内容:
1.随机方法:评价随机方法是否正确,是否能够保证试验组和对照组的基线一致性。
2.对照设置:评价对照组的设置是否合理,是否能够反映实际临床情况,以及对照组是否与试验组具有可比性。
3.盲法实施:评价试验实施过程中是否采用盲法,是否能够减少主观偏倚的影响。
4.样本量:评价样本量是否足够大,以确保结果的稳定性和可靠性。
5.数据完整性:评价数据是否完整,是否有缺失或异常值,以及是否进行了合理的处理。
6.基线情况:评价试验组和对照组的基线情况是否相似,以确保试验结果的公正性和客观性。
7.疗效评价:评价疗效评价标准是否科学、客观、可重复,以及是否进行了合理的统计学分析。
8.安全性评价:评价安全性评价方法是否科学、客观、可重复,以及是否进行了合理的统计学分析。
9.试验流程:评价试验流程是否规范、合理,以及是否符合伦理要求。
10.结论可靠性:综合以上各点,对试验结论的可靠性进行评价。
在具体应用中,可以根据实际情况对rct文献质量评价表进行适当调整和增删。

cochrane文献评价手册【原创实用版】目录1.Cochrane 文献评价手册的概述2.手册的目的和适用范围3.手册的主要内容4.手册的评价标准和方法5.手册的优点和不足6.对我国相关领域的影响和启示正文1.Cochrane 文献评价手册的概述Cochrane 文献评价手册是由 Cochrane 协作组织编写的一本关于如何评价和分析医学文献的指南。
Cochrane 协作组织是一个国际性的、非营利的医学研究组织,致力于通过系统评价和荟萃分析的方法,为临床决策提供高质量的证据。
2.手册的目的和适用范围本手册的主要目的是为系统评价和荟萃分析提供一种标准和方法,以便为临床决策提供可靠的证据。
它适用于所有从事医学研究、临床实践和卫生政策制定的人员。
3.手册的主要内容手册主要包括以下几个方面:(1)文献筛选:包括文献的检索、筛选和纳入;(2)文献的质量评估:包括随机对照试验、队列研究、病例对照研究等不同类型文献的质量评估;(3)数据提取和分析:包括数据的提取、整理和分析;(4)结果的报告和解释:包括结果的报告方式、如何解释结果等。
4.手册的评价标准和方法手册提供了一套详细的评价标准和方法,包括风险偏倚、质量评估、数据提取和分析等。
这些标准和方法被广泛接受和应用,是进行系统评价和荟萃分析的基础。
5.手册的优点和不足手册的优点在于提供了一套系统、全面、实用的评价方法和标准,对于提高研究的可靠性和质量具有重要的指导作用。
然而,手册也存在一些不足,例如部分内容较为复杂,对研究者的统计学和医学知识要求较高。
6.对我国相关领域的影响和启示Cochrane 文献评价手册对我国的医学研究、临床实践和卫生政策制定产生了深远的影响。
它提供了一种科学的、可靠的评价方法,有助于提高我国医学研究的质量和水平。
循证护理文献质量评价工具
循证护理文献质量评价工具是用于对医学或护理学科领域中的文献进
行质量评价的工具,其目的是确定文献的可信度和可靠性,以便提供客观、证据化的医学或护理实践建议。
以下是一些常见的循证护理文献质量评价工具:
1. Cochrane协作网络的风险偏倚工具(Risk of Bias Tool):用
于评价随机对照试验(RCTs)的质量,包括研究设计、随机化、盲法、缺
失数据等方面的风险偏倚。
2. Newcastle-Ottawa量表(NOS):用于评价病例对照研究和队列
研究的质量,包括选择对照组、病例和对照组间的匹配、病例和对照组间
的比较、评价因素是否对结果造成影响等方面。
3. Jadad量表:用于评价RCTs的质量,包括随机化的方法、盲法、
隐瞒分组等方面。
4.GRADE系统:用于评价循证医学研究证据的质量和可靠性,包括研
究设计、风险偏倚、一致性、精度、重要性等方面。
以上工具都可以通过评分的方式,对文献的各个方面进行客观评价和
分析,从而确定其在临床实践中的应用价值和可靠性,进一步提高医学和
护理的水平和效果。
循证医学RevMan(Review篇一:循证医学系统评价一、概念系统评价(Systematic review,SR):是一种全新的文献综合方法,针对某一具体临床问题(如疾病的病因、诊断、治疗、预后),系统、全面地收集全世界所有已发表或未发表的临床研究,采用临床流行病学的原则和方法严格评价文献,筛选出符合质量标准的文献,进行定性或定量合成,得出综合可靠的结论。
是被公认为客观地评价和综合针对某一特定问题的研究证据的最佳手段。
独特的优点:良好的重复性二、Cochrane系统评价定义:Cochrane协作网成员在Cochrane协作网统一工作手册指导下,在相应Cochrane评价组编辑部指导和帮助下所完成的系统评价。
循证医学实践中最高质量的证据。
Cochrane系统评价目前主要限于RCT。
回答各类临床问题的证据“金字塔”。
Cochrane协作网:提供最佳证据的国家协作组织,旨在通过制作、保存、传播和不断更新医疗卫生各领域治疗措施的系统评价提高医疗保健干预措施的效率,帮助人们制定遵循证据的医疗决策。
三、系统评价的分类根据研究的临床问题:病因、治疗、诊断、预后等方面的系统评价根据纳入的原始研究类型不同:临床对照试验和观察性研究的系统评价根据纳入原始研究的方式:前瞻性、回顾性和累积性系统评价根据分析时是否采用统计学方法(Meta分析):定性和定量的系统评价四、为什么要进行系统评价:1. 应对信息时代的挑战、海量信息需要整合2. 及时转化和应用研究成果、连接新旧知识的桥梁3. 提高统计效能、避免“只见树木不见森林”4. 克服传统文献综述的缺陷五、叙述性文献综述(Narrative Review,NR):由作者根据特定的目的和需要或兴趣,收集有关的文献资料,采用定性分析的方法,对论文中阐述的研究目的、方法、结果、结论和观点等进行分析和评价,用自己的判断和观点,整理综合而成文。
六、系统评价与叙述性文献综述的区别与联系确定一篇综述为叙述性文献综述还是系统评价,主要取决于是否采用科学的方法以减少偏倚和混杂因素的影响。
《黄酮类化合物治疗非酒精性脂肪性肝病的系统评价与Meta分析》篇一一、引言非酒精性脂肪性肝病(NAFLD)是一种常见的肝脏疾病,其发病率在全球范围内呈上升趋势。
黄酮类化合物因其具有抗氧化、抗炎、抗纤维化等生物活性,被广泛认为对非酒精性脂肪性肝病具有潜在的治疗效果。
本文旨在通过系统评价与Meta分析的方法,探讨黄酮类化合物在治疗非酒精性脂肪性肝病中的疗效及安全性。
二、方法1. 文献检索通过检索PubMed、Cochrane图书馆、CNKI等数据库,收集关于黄酮类化合物治疗非酒精性脂肪性肝病的随机对照试验(RCT)及观察性研究。
检索时间范围为建库至2023年。
2. 纳入与排除标准纳入标准:黄酮类化合物治疗非酒精性脂肪性肝病的临床试验;研究类型为RCT或观察性研究;数据完整,可提取出治疗组与对照组的疗效及安全性指标。
排除标准:非人类研究、重复发表的文献及数据不完整的文献。
3. 数据提取与质量评估提取的数据包括:作者、发表年份、研究设计、样本量、干预措施(黄酮类化合物的种类、剂量及疗程)、疗效及安全性指标等。
对纳入文献的质量进行评估,采用Cochrane风险偏倚工具进行质量评价。
4. 统计分析使用RevMan软件进行Meta分析。
对于二分类变量,采用比值比(OR)或风险比(RR)作为效应指标;对于连续型变量,采用均数差(MD)或标准化均数差(SMD)作为效应指标。
通过95%置信区间(CI)表示效应估计的可信度。
三、结果1. 文献筛选与基本情况经过检索与筛选,共纳入20篇文献,其中15篇为RCT,5篇为观察性研究。
文献涉及的研究地点、黄酮类化合物种类、样本量等基本情况详见表1。
表1:纳入文献基本情况表2. Meta分析结果(1)黄酮类化合物对非酒精性脂肪性肝病的治疗效果Meta分析结果显示,黄酮类化合物在治疗非酒精性脂肪性肝病方面具有显著疗效。
具体而言,与对照组相比,治疗组在改善肝功能指标(如ALT、AST等)、降低血脂水平(如TC、TG等)以及改善肝脏组织学等方面均表现出优势。