氨肽酶抑制剂
- 格式:ppt
- 大小:1.28 MB
- 文档页数:3

氨肽酶的名词解释氨肽酶,也称为氨基肽酶,是一类广泛存在于生物体内的酶。
它们在许多生物过程中发挥着重要的作用,包括消化、免疫调节、组织修复和细胞凋亡等。
本文将对氨肽酶的含义、功能和影响因素等进行详细解释。
氨肽酶是一类具有水解肽键的酶,主要催化肽链中的氨基酸与肽或蛋白酸性残基之间的化学键。
它们可以将肽链分解为较小的肽段或氨基酸,并促进消化进程,使得蛋白质分解为可被细胞吸收的基本单位。
常见的氨肽酶包括肠胃中的胃蛋白酶、肠肽酶和胰蛋白酶等。
氨肽酶在消化过程中起着重要作用。
胃蛋白酶主要在胃中活跃,催化食物蛋白质的分解。
肠肽酶则主要存在于小肠粘膜上皮细胞中,其活性与胃蛋白酶相辅相成,进一步分解未被完全降解的蛋白质残留物。
胰蛋白酶则由胰腺分泌,它的主要任务是进一步分解小肠腺细胞中生成的肽酶。
除了消化作用外,氨肽酶还在免疫调节中扮演重要角色。
它们可以调节肽激素和神经肽的生物活性,从而影响免疫细胞的功能。
例如,氨肽酶可以调节炎症反应和免疫细胞的迁移,对炎症和免疫相关疾病的防治具有重要意义。
此外,氨肽酶对组织修复和细胞凋亡也具有影响。
在组织修复过程中,氨肽酶可以促进胶原纤维生成和细胞增殖。
然而,在某些情况下,过度的氨肽酶活性可能会导致组织病理性改变。
另外,氨肽酶在细胞凋亡中起着调节作用,可以促进或抑制细胞凋亡的发生。
氨肽酶的活性受多种因素影响。
pH值是其中重要的调节因素之一,不同氨肽酶对pH的依赖性不同。
温度也会对氨肽酶活性产生影响,一般来说,温度升高会提高氨肽酶的催化活性。
此外,氨肽酶的活性还受到金属离子、蛋白质酶抑制剂等的影响。
总结起来,氨肽酶是一类广泛分布于生物体的酶,主要参与消化、免疫调节、组织修复和细胞凋亡等过程。
它们催化肽链的水解,将蛋白质分解为更小的单元,以供细胞吸收利用。
同时,氨肽酶在免疫调节、组织修复和细胞凋亡中也发挥着重要的调控作用。
因此,深入了解氨肽酶的含义、功能和调节机制对于科学研究和医学应用具有重要意义。

氨肽酶氨肽酶是一类从蛋白质或肽链的氨端选择性切割氨基酸残基的外肽酶的总称,是较早发现的一种酶。
在植物,动物和微生物界都有广泛的分布,对于维持细胞的正常生理功能有重要的作用,维持着细胞的动态平衡。
一、亮氨酸氨肽酶性质:LAP的最适温度为40 ℃.。
说明该酶在低温下具有一定活性,而LAP的热稳定性较差。
LAP的最适pH值为7.5。
在较酸或较碱的条件下都表现出较低的活性,所以, LAP是一个中性氨肽酶.,在pH值7.0~9.0范围内较稳定。
金属螯合剂EDTA 和1, 10phenanthroline 能有效抑制LAP 活性,Bestatin也对LAP产生了很强的抑制效果, 而丝氨酸蛋白酶抑制剂( PMSF) 和天冬氨酸蛋白酶抑制剂( Pep statin)则不能有效抑制其活性, 说明该酶是金属蛋白酶。
LAP对Arg-MCA、Ala-MCA和Tyr-MCA都具有一定的水解率, 但很难分解P roMCA、Val-MCA和Gly-MCA. LAP对于内切酶荧光底物没二、分离纯化1、材料:1) 实验动物鲜活草鱼,。
2) 试剂DEAE-Sephacel、Sephacryl S-200 HR和Phenyl Sepharose 6-Fast Flow,羟基磷灰石;荧光底物Arg-MCA、Boc-Phe-Se r-Arg-MCA、Boc-Leu-Arg-Arg-MCA.,蛋白酶抑制剂besta tin、PMSF、EDTA、1, 102phenanthroline monohydra te和其它荧光底物,Pep statin、SDS-PAGE 用标准蛋白;、其它试剂均为分析纯.2、方法步骤1.将鲜活草鱼敲击头部致死, 去内脏、皮、骨后洗净, 收集骨骼肌并切碎. 将500 g切碎的鱼肉放入3倍体积的含有1 mmol /L PMSF的缓冲液A中, 用组织捣碎机以15秒/次, 分12次进行捣碎.2.将捣碎后的粗酶液, 以8 000 r/min离心15 min, 取上清液.3.上清液进行硫酸铵粗分级分离, 选取的硫酸铵质量浓度为40 % ~60 %, 沉淀用最少量的缓冲液A溶解后以相同外液透析.4.将酶液上样于以缓冲液A平衡好的离子交换柱DEAE2Sephace l ( 215 cm ×25 cm) , 流洗去除杂蛋白质后, 用0~015 mol/L NaCl作线性梯度洗脱, 洗脱液的总体积为600 mL , 以5 mL /管收集. 测定A280 , 检测并收集活性较高部分, 用YM210超滤膜进行超滤浓缩.以含有012 mol /L NaCl的缓冲液A平衡凝胶过滤柱Sephac ryl S2200 HR ( 115 cm ×98 cm) , 将浓缩后的样品上样于该柱, 然后以相同的缓冲液洗脱, 每管收集1 mL. 测定样品的A280值, 检测酶活力后, 将活性部分收集并以缓冲液A透析5. 将透析后的样品上样于以缓冲液A平衡的羟基磷灰石后, 充分洗净杂蛋白质, 以25 ~100 mmol/L 磷酸缓冲液进行线性梯度洗脱, 洗脱总体积为80 mL, 每管收集1 mL. 检测蛋白含量和酶活力后, 将活性部分收集. 将活性部分边搅拌边加入硫酸铵至终浓度为1 mol/L, 上样于以含有1 mol /L (NH4 )2 SO4 的缓冲液A平衡的疏水亲和层析柱Phenyl Sepharose 62Fast Flow (1 cm ×4 cm).待流洗去除杂蛋白质后, 1~ 0 mol /L (NH4 ) 2 SO4 进行线性梯度洗脱, 洗脱总体积为50 mL, 每管收集1 mL. 样品进行A280测定和酶活测定后, 得到的活性部分进行电泳检。

氨肽酶及其抑制剂的构效关系氨肽酶(APN/CD13;gp150)是一种锌离子依赖型的外肽酶,广泛分布于各种组织和细胞表面,并且在各种肿瘤细胞表面高表达,参与了肿瘤细胞的增殖,粘附,转移,血管生成和肿瘤侵袭等过程。
因此,氨肽酶被作为肿瘤治疗中的重要靶点之一。
目前,许多课题组通过计算机辅助药物设计出了许多高效且选择性高的化合物。
本文通过介绍恶性肿瘤的转移阐述氨肽酶的作用机制,并对氨肽酶的天然抑制剂和化合物抑制剂及其构效关系进行综述。
标签:氨肽酶;氨肽酶恶性肿瘤引起的死亡率仅次于脑血管疾病,位居世界第二。
恶性肿瘤死亡率高居不下是由于其转移和侵袭的生物特征。
氨肽酶,又称CD13抗体,是M1家族的一种多功能蛋白,本身具有催化活性中心,是细胞膜或组织表面的锌离子依赖型的金属蛋白酶。
氨肽酶本身具有很强的输水结构域,在很多组织及器官中广泛分布,主要表达是在肝,肠,肾脏的单核细胞,上皮细胞中,尤其是在肿瘤细胞表面表达较高[1],并且氨肽酶在肿瘤脉管系统中的内皮的表达明显高于正常血管[2],同时在不同肿瘤中APN的作用及其表达又有一定的差别[3]。
APN分布广泛,其生物学功能较为复杂,在不同的组织中呈现出不同的功能。
氨肽酶在肿瘤细胞表面大量表达,可水解肽、酰胺等结构中的酰胺键,从而释放出不同的N端中性氨基酸。
同时,APN还可以调节与恶性肿瘤相关的肽,从而调节恶性肿瘤的转移,分化,增殖,凋亡,以及血管生成等等[3]。
1 APN的催化机制目前,APN的详细作用机制尚不明确,但是有研究表明,APN的作用与mTOR/HIF-1α信号通路有关。
Luke H. Stockwin等人,通过对缺氧条件下的黑色素瘤细胞质膜上的蛋白表达进行研究,确定了在低氧条件下,HIF-1α和APN的表达均提高[4]。
Schmitt等人,在研究APN抑制剂的时候发现,当APN表达降低的时候,HIF-1α的表达量同时降低,进一步证实了这一观点[5]。



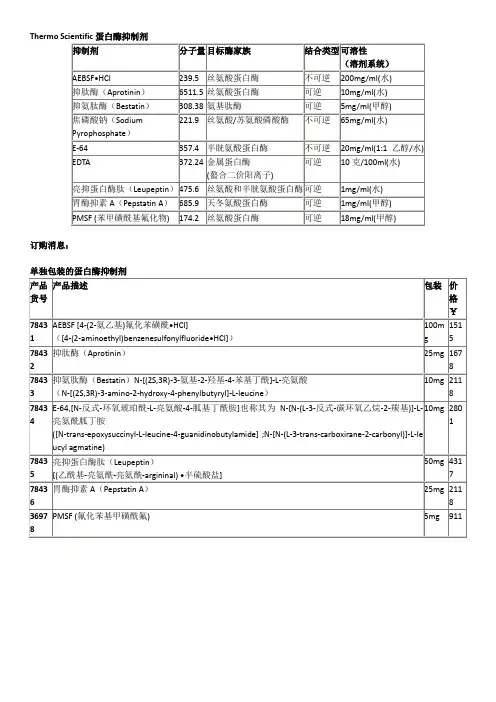
蛋白质提取过程中常用的蛋白酶和磷酸酶抑制剂详细使用说明一、蛋白酶抑制剂PMSF:特性:丝氨酸蛋白酶抑制剂,如胰凝乳蛋白酶、胰蛋白酶和凝血酶,也抑制半胱氨酸蛋白酶如木瓜蛋白酶。
溶解性:溶于异丙醇、乙醇、甲醇和丙二醇里>10mg/ml。
在水溶液中不稳定。
在100%异丙醇,25℃时稳定至少9个月。
分子量:174.2使用:贮存浓度200mM,工作浓度1mMLeupeptin 亮肽素特性:抑制丝氨酸和半胱氨酸蛋白酶如胰蛋白酶、木瓜蛋白酶、纤溶酶和组织蛋白酶B。
溶解性:高度溶于水(1mg/ml)。
4℃一周稳定,分成小份,冷冻在-20℃至少6个月。
分子量:C20H38N6O4 ×1/2 H2SO4:475.6 C20H38N6O4 x 1/2 H2SO4 × H2O:493.6使用:贮存浓度1mg/ml,工作浓度0.5 ug/ml (1mM)。
Aprotinin抑肽酶特性:丝氨酸蛋白酶抑制剂,抑制纤维蛋白溶酶、激肽释放酶、胰蛋白酶、糜蛋白酶的高活性。
不抑制凝血酶或因子X。
溶解性:易溶于水(10mg/ml)或缓冲液(例如0.1M tris,pH8.0)。
pH约7~8的溶液在4℃可保存1周,分装保存在-20℃可至少保存6个月。
避免反复冻融, pH>12.8的碱性环境可使其灭活。
分子量:6,512使用:贮存浓度1mg/ml,工作浓度0.06~2.0 ug/ml(0.01~0.3 uM)。
Pepstatin胃蛋白酶抑制剂特性:抑制天冬氨酸(酸)蛋白酶如胃蛋白酶、肾素、组织蛋白酶D、凝乳酶、许多微生物酸性蛋白酶溶解性:溶于甲醇约1mg/ml;可溶于乙醇,过夜溶解可达到1 mg/ml;在6当量乙酸中溶解度为300ug/ml。
4℃稳定一周,分装储存于-20℃时可保存1个月。
分子量:685.9使用:贮存浓度1mg/ml,使用浓度0.7 μg/ml(1 μM)。
EDTA-Na2特性:金属蛋白酶抑制剂溶解性:溶于水至0.5M,在pH8-9的条件下,4℃稳定至少6个月分子量:372.24使用:工作浓度0.2~0.5 mg/ml(0.5~1.3 mM),不需现用现配,在溶液pH值调至8~9时再加入。

蛋白酶抑制剂种类
蛋白酶抑制剂是一类能够抑制蛋白酶活性的物质,主要存在于某些植物、动物和一些微生物中。
以下是一些常见的蛋白酶抑制剂种类:
1.胰蛋白酶抑制剂:抑制胰蛋白酶活性的蛋白质,是植物中广泛存在的一类蛋白质。
它们可以抑制胰蛋白酶、糜蛋白酶、羧基肽酶等,从而影响这些酶所催化的蛋白质的水解。
2.丝氨酸蛋白酶抑制剂:这是蛋白质水解酶中的一大类,主要包括抑胃素、抑胰蛋白酶、抑糜蛋白酶等。
它们能可逆地与相应的丝氨酸蛋白酶形成共价键,因而能够阻断某些内肽酶催化蛋白质水解的能力。
3.天冬氨酸蛋白酶抑制剂:主要存在于豆科植物中,能够抑制枯草杆菌蛋白酶的活性。
4.半胱氨酸蛋白酶抑制剂:这种抑制剂可以与半胱氨酸蛋白酶形成共价键,因而能够抑制这些酶的活性。
5.金属蛋白酶抑制剂:这类抑制剂主要通过与金属蛋白酶的活性中心发生相互作用,从而抑制其活性。
这些抑制剂在生物体的生长、发育和防御等方面有着重要的作用。
同时,在食品工业和医药工业中,它们也有着广泛的应用。
例如,某些蛋白酶抑制剂可以作为防腐剂,用于延长食品的保质期;在医药方面,也可以利用这些抑制剂来研发新药或探索新的治疗手段。
此外,还有一种与蛋白酶抑制剂相似的物质叫做抗蛋白酶,其主要作用是抑制或灭活蛋白酶的活性,以避免食物中的蛋白质被过度分
解或破坏。
例如,胰凝乳蛋白酶抑制剂就是一种抗胰蛋白酶,能抑制胰蛋白酶和糜蛋白酶的活性,从而保护消化道中的蛋白质。
如需获取更多有关蛋白酶抑制剂的信息,建议查阅相关文献或咨询生物学家获取帮助。

氨肽酶及其抑制剂的构效关系作者:秦静怡瞿灵芝顾月清来源:《医学信息》2014年第04期摘要:氨肽酶(APN/CD13;gp150)是一种锌离子依赖型的外肽酶,广泛分布于各种组织和细胞表面,并且在各种肿瘤细胞表面高表达,参与了肿瘤细胞的增殖,粘附,转移,血管生成和肿瘤侵袭等过程。
因此,氨肽酶被作为肿瘤治疗中的重要靶点之一。
目前,许多课题组通过计算机辅助药物设计出了许多高效且选择性高的化合物。
本文通过介绍恶性肿瘤的转移阐述氨肽酶的作用机制,并对氨肽酶的天然抑制剂和化合物抑制剂及其构效关系进行综述。
关键词:氨肽酶;氨肽酶恶性肿瘤引起的死亡率仅次于脑血管疾病,位居世界第二。
恶性肿瘤死亡率高居不下是由于其转移和侵袭的生物特征。
氨肽酶,又称CD13抗体,是M1家族的一种多功能蛋白,本身具有催化活性中心,是细胞膜或组织表面的锌离子依赖型的金属蛋白酶。
氨肽酶本身具有很强的输水结构域,在很多组织及器官中广泛分布,主要表达是在肝,肠,肾脏的单核细胞,上皮细胞中,尤其是在肿瘤细胞表面表达较高[1],并且氨肽酶在肿瘤脉管系统中的内皮的表达明显高于正常血管[2],同时在不同肿瘤中APN的作用及其表达又有一定的差别[3]。
APN分布广泛,其生物学功能较为复杂,在不同的组织中呈现出不同的功能。
氨肽酶在肿瘤细胞表面大量表达,可水解肽、酰胺等结构中的酰胺键,从而释放出不同的N端中性氨基酸。
同时,APN还可以调节与恶性肿瘤相关的肽,从而调节恶性肿瘤的转移,分化,增殖,凋亡,以及血管生成等等[3]。
1 APN的催化机制目前, APN的详细作用机制尚不明确,但是有研究表明,APN的作用与mTOR/HIF-1α信号通路有关。
Luke H. Stockwin等人,通过对缺氧条件下的黑色素瘤细胞质膜上的蛋白表达进行研究,确定了在低氧条件下,HIF-1α和APN的表达均提高[4]。
Schmitt等人,在研究APN 抑制剂的时候发现,当APN表达降低的时候,HIF-1α的表达量同时降低,进一步证实了这一观点[5]。
![D-氨基酸衍生物类氨肽酶N抑制剂及其制备方法和应用[发明专利]](https://uimg.taocdn.com/a1d558e34128915f804d2b160b4e767f5bcf8040.webp)
专利名称:D-氨基酸衍生物类氨肽酶N抑制剂及其制备方法和应用
专利类型:发明专利
发明人:曹江营,周洪雷,蔡晓青,马艳,张晨
申请号:CN202111400147.6
申请日:20211122
公开号:CN114181116A
公开日:
20220315
专利内容由知识产权出版社提供
摘要:本发明提供一种D‑氨基酸衍生物类氨肽酶N抑制剂及其制备方法和应用。
本发明抑制剂具有如下通式I或II所示的结构。
本发明还提供了D‑氨基酸衍生物类氨肽酶N抑制剂在制备预防或治疗与氨肽酶活性异常相关的疾病的药物中的应用。
本发明部分D‑氨基酸衍生物类氨肽酶N抑制剂相比以脲基为连接基团的L构型化合物等现有抑制剂,对氨肽酶N的抑制具有更优异的活性。
申请人:山东中医药大学
地址:250355 山东省济南市长清区大学科技园大学路4655号
国籍:CN
代理机构:济南金迪知识产权代理有限公司
代理人:韩献龙
更多信息请下载全文后查看。

-300-中国药理学通报Chinese Pharmacological Bulletin2020Mar;36(3):300〜3网络出版时间:2020/3/1012:22网络出版地址:/kcme/d etail/34.1086.r.20200309.1346.004.html脯氨酰寡肽酶功能及抑制剂研究进展冯芬,张春平(南昌大学基=+学院医学遗传与细胞生物学教研室,江西南昌330006)doi:10.3969/p issn.1001-1978.2020.03.002文献标志码:A文章编号:1001-1978(2020)03-0300-04中国图书分类号:RP5;R341.6;R745.7;R73;R977.3摘要:脯氨酰寡肽酶(prolyl oligopeptidase,POP)又称为脯氨酰内肽,后,,负责短神经肽和肽激素的成熟和降解,与神经相关性疾病相关。
POPI性催结构和!螺旋桨结构。
POP抑制剂神经、抗遗忘和 认知性,同时对肿瘤、血压也定治疗作用。
本就POPI、作用机制及其抑制剂研究作。
关键词:脯氨酰寡肽酶;酶学功能;非酶学功能;帕金森病;肿瘤;抑制剂脯氨酰寡肽酶(prolyl oXgopeptiVase,POP)是一种81kDa 的单体丝*1+,是丝S9家族的成员。
POP:生物广泛,仅酵母和线菌检测到POP;性*2+'人POP基15个外子组成*2+'POP 在哺乳动物的大脑中高度表达,丘脑和皮质的GABA能和胆碱能中间神经*3+。
此外,POP在睾丸,卵巢,肝脏和心脏也达。
生殖育方,人初级精母细胞和精子细胞的细胞核中存在大量POP,卵母细胞和初级卵泡也有POP的表达*4+,我们前期报道POP表达于小鼠卵巢壁层颗粒细胞、卵丘和黄体细胞*5®。
POP 通残基"P W基生物学效应[7]o结构研究表明,POP由30kDa肽酶结构域组成,该结构域含有Ser-His-Asp催化三联体,顶部是40kDa七叶!螺旋桨结构域,能够限制底物入性部位腔,实验和计算研究,为底物入POPI性,这个结构会生收稿日期:2019-11-17,修回日期:2019-12-20基金项目:国家自然科学基金资助项目(No81601242,No81960272)作者简介:冯芬(1992-),女,硕士生,研究方向:生殖生物学,E-mail:395624522@张春平(1981-),男,博士,副教授,研究方向:生殖生物学,通讯作者,E-mail:zhangcp81@causing an ineammatoiy form of cell death(pyro p tosis),which enhances drug-induced neurotoxic damage and promotes the development of diseases.Nuprl,ERS and NLRP3inflammasomes play a key rolo in METH-induced neurotoxic injury.This study views the re/tionship between Nuprl,ERS and NLRP3inflam-规模的构象变化叩。
神经氨酸酶抑制剂神经氨酸酶抑制剂(Neprilysin inhibitors)是一类药物,通过抑制神经氨酸酶(neprilysin)酶的活性,发挥其治疗作用。
神经氨酸酶是一种酶,负责降解一系列的生物活性物质,包括肽类激素,例如,血管加压素、负性肌肾素、催产素、降钙素等。
通过神经氨酸酶的抑制,可以增加这些物质的浓度,从而调节相关的生理功能和疾病过程。
神经氨酸酶的作用机制神经氨酸酶(Neprilysin)是一种锌金属蛋白酶,广泛存在于多个组织和细胞中,包括神经系统、心血管系统、免疫系统等。
该酶的功能是降解多种生物活性物质,包括肽类激素和肽类降钙素等。
这些生物活性物质在调控体内的水平和平衡方面起着重要作用。
神经氨酸酶通过降解这些生物活性物质,可以维持这些物质在体内的恒定水平。
然而,当这些物质的产生或释放过多时,神经氨酸酶的酶活性可能无法完全降解,导致这些物质在体内积累,进而引起疾病的发生和进展。
神经氨酸酶抑制剂通过抑制神经氨酸酶的活性,可以延长这些生物活性物质在体内的半衰期,从而增加它们的浓度。
这些物质的增加对多种生理功能和病理过程起到调节作用。
1.血管加压素:血管加压素是一种重要的调节血管收缩和血压的激素。
神经氨酸酶抑制剂可以增加血管加压素的浓度,从而增加血管收缩和血压的效应。
这对于治疗高血压和心力衰竭等疾病具有重要意义。
2.负性肌肾素:负性肌肾素是一种血管扩张剂,可以降低血压。
神经氨酸酶抑制剂可以减少负性肌肾素的降解,增加其在体内的浓度,从而发挥其降压作用。
3.催产素:催产素是一种调节子宫收缩的激素,对于分娩和哺乳具有重要作用。
神经氨酸酶抑制剂可以增加催产素的浓度,从而增强其催产效应。
除了上述作用外,神经氨酸酶抑制剂还可以调节其他多种生理功能和疾病过程,例如免疫系统功能、炎症反应、心脑血管功能等。
神经氨酸酶抑制剂目前已经被广泛应用于临床上,特别是在心脑血管领域。
以下是神经氨酸酶抑制剂的几个主要临床应用:1.心力衰竭:神经氨酸酶抑制剂可以增加血管加压素和负性肌肾素的浓度,从而调节心力衰竭病人的血液循环,减轻症状并延长生存期。
酶的抑制剂名词解释酶的抑制剂是指能够抑制酶活性的化合物或物质。
酶是生物体内的催化剂,能够加速化学反应速率,但有时候过高的酶活性会导致疾病或异常现象的发生,因此酶的抑制剂的研究和应用对于疾病治疗和药物研发具有重要的意义。
下面就酶的抑制剂进行详细的解释。
酶的抑制剂可以根据其作用机制的不同分为两类:可逆性酶抑制剂和不可逆性酶抑制剂。
可逆性酶抑制剂是指与酶发生非共价相互作用,抑制酶活性,但这种抑制作用能够解离。
可逆性酶抑制剂可进一步分为竞争性抑制剂、非竞争性抑制剂和混合型抑制剂。
竞争性抑制剂与酶的底物竞争结合于酶的活性位点,从而阻止底物的结合和酶活性的展示。
竞争性抑制剂与酶结合的亲和力较高,可以有效地阻断底物与酶结合,降低酶的活性。
常见的竞争性抑制剂有丙硫氨酸和氨硫脒。
非竞争性抑制剂则是在酶底物结合位点以外的其他位置结合酶分子,这种结合作用会改变酶的构象,使得酶无法有效地催化底物的转化反应。
与竞争性抑制剂不同,非竞争性抑制剂无法被底物所顶替,因此与酶的结合是不可逆的。
常见的非竞争性抑制剂有氰化物和抗生素链霉素。
混合型抑制剂是竞争性抑制剂和非竞争性抑制剂的结合。
这种抑制剂既能够与酶的活性位点竞争结合,也可以结合在其他位点上,快速改变酶的构象。
这种抑制剂的作用机制比较复杂,对底物和酶的亲和力的影响也比较大。
混合型抑制剂的应用可以根据不同的酶的特点和疾病的需要进行选择。
常见的混合型抑制剂有青黛磺胺和更昔洛韦。
不可逆性酶抑制剂则是指与酶发生共价或较强结合,从而使酶的活性完全失去或难以恢复。
这种抑制剂的作用是不可逆的,一旦结合,酶的活性无法恢复。
不可逆性酶抑制剂常常用于抗癌药物的开发和设计中,可以有效地抑制癌细胞中过量活性的酶,从而达到治疗癌症的效果。
常见的不可逆性酶抑制剂有阿司匹林和芥子气。
总之,酶的抑制剂是能够抑制酶活性的化合物或物质。
可逆性酶抑制剂通过与酶的非共价相互作用,抑制酶的活性,并可解离。
不可逆性酶抑制剂与酶发生共价或较强结合,使酶的活性完全失去或难以恢复。
专利名称:γ谷氨酰转肽酶抑制剂GGsTop在制备治疗哮喘急性发作和难治性哮喘药物中的应用
专利类型:发明专利
发明人:杨明,张莉蓉,韩立友,李付广
申请号:CN202111548720.8
申请日:20211217
公开号:CN114404426A
公开日:
20220429
专利内容由知识产权出版社提供
摘要:本发明涉及γ谷氨酰转肽酶抑制剂GGsTop在制备治疗哮喘急性发作和难治性哮喘药物中的应用,可有效解决哮喘急性发作和难治性哮喘新的用药问题。
使用革兰氏阴性细菌的细胞壁组分脂多糖和过敏原,建立哮喘急性发作和难治性哮喘的动物模型,在LPS和过敏原联合诱导小鼠哮喘急性发作和难治性哮喘模型的基础上,加入GGsTop治疗,通过检测小鼠气道高反应性、肺部组织炎症、支气管肺泡灌洗液和炎症因子等指标判定治疗效果,实现γ谷氨酰转肽酶抑制剂GGsTop在制备治疗哮喘急性发作和难治性哮喘药物中的应用。
本发明γ谷氨酰转肽酶抑制剂GGsTop能够显著缓解哮喘急性发作程度,有效控制难治性哮喘,并且能够替代糖皮质激素,降低长期临床应用糖皮质激素的毒副作用。
申请人:杨明
地址:450001 河南省郑州市高新区科学大道100号郑州大学基础医学院
国籍:CN
代理机构:郑州天阳专利事务所(普通合伙)
代理人:聂孟民
更多信息请下载全文后查看。