氧化钠的与过氧化钠的比较
- 格式:doc
- 大小:20.00 KB
- 文档页数:1

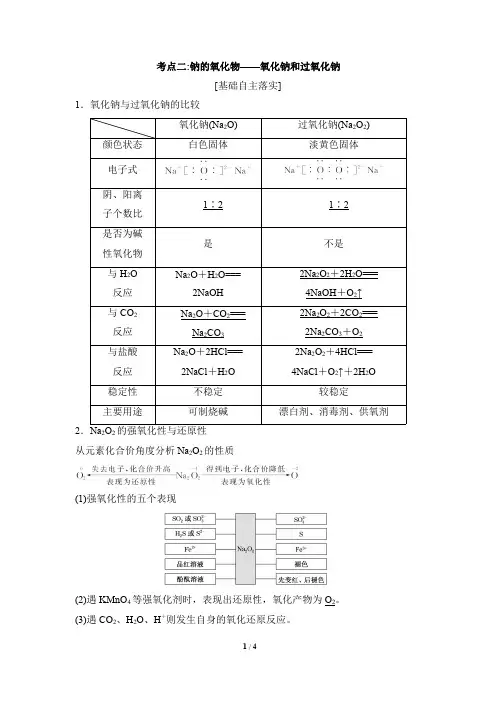
考点二:钠的氧化物——氧化钠和过氧化钠[基础自主落实]1.氧化钠与过氧化钠的比较氧化钠(Na 2O)过氧化钠(Na 2O 2)颜色状态白色固体淡黄色固体电子式阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与H 2O 反应Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑与CO 2反应Na 2O +CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与盐酸反应Na 2O +2HCl===2NaCl +H 2O 2Na 2O 2+4HCl===4NaCl +O 2↑+2H 2O稳定性不稳定较稳定主要用途可制烧碱漂白剂、消毒剂、供氧剂2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质(1)强氧化性的五个表现(2)遇KMnO 4等强氧化剂时,表现出还原性,氧化产物为O 2。
(3)遇CO 2、H 2O 、H +则发生自身的氧化还原反应。
小题热身1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化钠、过氧化钠均为碱性氧化物(×)(2)1mol Na2O2固体中含离子总数为4N A(×)(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O===2Na++2OH-+O2↑(×)(4)Na2O2的电子式为(×)(5)1mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A(√)(6)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂(√)(7)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH(×)(8)7.8g Na2O2与足量的CO2反应,转移电子的个数为0.2N A(×)2.如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。
钠及其氧化物的物质的量均为0.1mol,水的质量为100g。

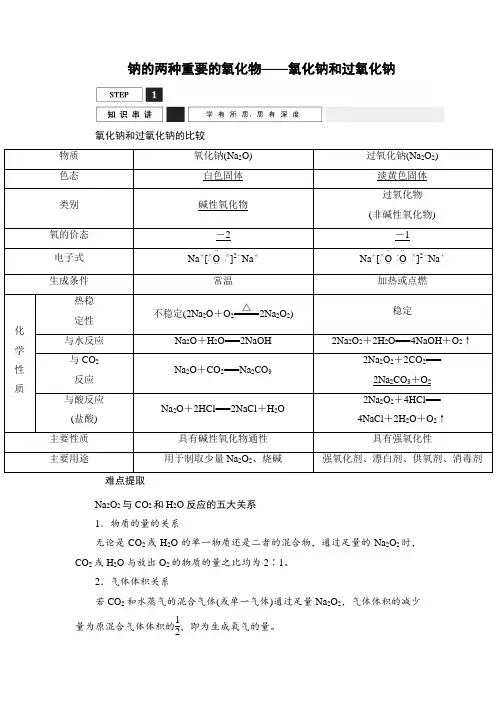
钠的两种重要的氧化物——氧化钠和过氧化钠氧化钠和过氧化钠的比较难点提取Na2O2与CO2和H2O反应的五大关系1.物质的量的关系无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
2.气体体积关系若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量为原混合气体体积的12,即为生成氧气的量。
3.固体质量关系相当于固体Na2O2只吸收了CO2中的“CO”,H2O中的“H2”;可以看做发生相应的反应:Na2O2+CO===Na2CO3,Na2O2+H2===2NaOH(实际上两反应都不能发生)。
4.电子转移关系当Na2O2与CO2、H2O反应时,每产生1 mol O2转移2 mol e-。
5.先后顺序关系一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
【互动思考】1.判断正误,正确的划“√”,错误的划“×”(1)过氧化钠能与水反应,所以过氧化钠可以做气体的干燥剂()(2)过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂()(3)78 g Na2O2中含阴离子的个数是2 N A()(4)Na2O2与H2O反应制备O2的离子方程式:Na2O2+H2O===2Na++2OH-+O2↑()(5)Na2O、Na2O2组成元素相同,与CO2反应产物也相同()(6)Na2O2的电子式为()(7)1 mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A()(8)1 mol Na2O2与足量CO2反应时,转移2N A个电子()答案(1)×(2)√(3)×(4)×(5)×(6)×(7)√(8)×2.如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
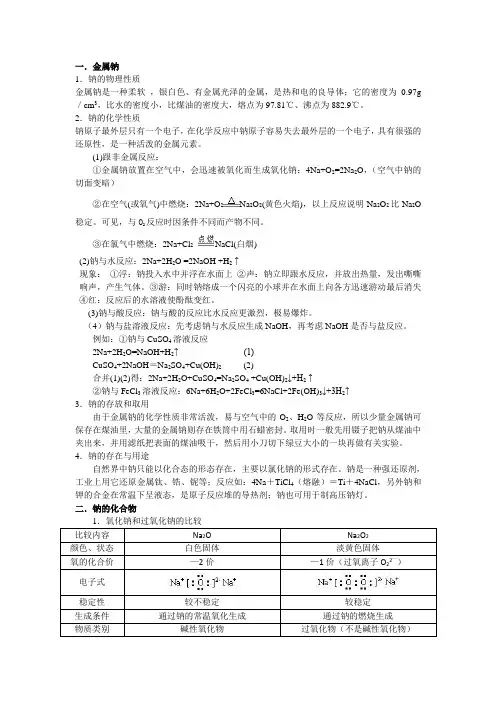
一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2(2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。



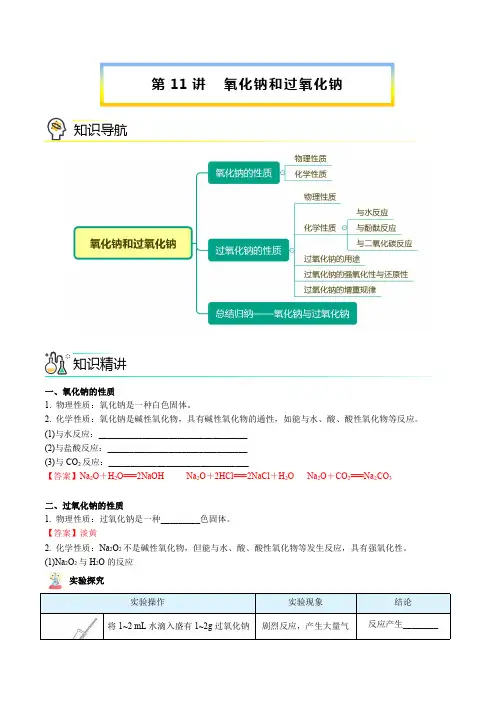


钠的性质与应用一、金属钠的物理性质二、从钠原子的原子结构认识钠的化学性质——还原性 1、主要化学性质(1)与非金属单质反应⎩⎨⎧O 2⎩⎨⎧常温:4Na +O 2===2Na 2O 点燃:2Na +O 2=====点燃Na 2O 2Cl 2:2Na +Cl 2=====点燃2NaCl(2)与水反应:2Na +2H 2O===2NaOH +H 2↑;(3)与酸(如盐酸)反应:2Na +2HCl===2NaCl +H 2↑; (4)与乙醇反应:2Na +2C 2H 5OH ―→2C 2H 5ONa +H 2↑;(5)与盐溶液(如硫酸铜溶液)反应:2Na +CuSO 4+2H 2O===Cu(OH)2↓+Na 2SO 4+H 2↑。
2、与滴加酚酞的水反应的现象及解释三、钠的制备原理、保存及用途 1、制备原理:2NaCl=====通电2Na +Cl 2↑。
2、保存方法实验室通常将少量钠保存在煤油中,目的是防止钠与空气中的O 2和水反应。
3、用途(1)制取钠的化合物;(2)冶炼特殊金属,如制钛:TiCl 4+4Na =====700~800 ℃Ti +4NaCl ; (3)钠钾合金常温下为液体,用于快中子反应堆作热交换剂;(4)高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。
4、金属钠与可溶性盐溶液反应的思维模板5、金属钠与溶液反应现象分析的思维模板(1)共性:因为钠与水的反应属于剧烈的置换反应,故钠与溶液反应有共同的现象产生。
①浮:钠浮在液面上;②熔:钠熔化成光亮的小球;③游:在液面上不停地游动直至反应完;④响:反应中不停地发出“嘶嘶”的响声。
(2)差异性:与酸及能形成弱碱的金属盐溶液反应时,由于溶液中H+浓度较大,反应比钠与水的反应剧烈,最后钠可能在液面上发生燃烧;与盐溶液反应时,还可能会生成沉淀四、钠的重要化合物1.氧化钠和过氧化钠的比较从元素化合价角度分析Na2O2的性质:(1)Na2O2的强氧化性4222 (3)遇CO2、H2O、H+,Na2O2发生自身的氧化还原反应。
2008年中国发生了一件大事,就是第29届奥运会!你看过在现场或者电视上看过开幕式吗?你还记得那绚烂、耀眼、美丽的焰火吗?有绽放的笑脸、有牡丹组成的奔腾巨龙、有29个象征着奥林匹克从希腊走进北京的大脚印、、、你们知道这些五颜六色的焰火是怎么制造出来的吗?它就来源于我们今天所学的内容。
下面我们就来踏上寻秘之旅吧!●新知预习1.钠是一种活泼的金属元素,在自然界中以________态的形式存在。
2.氧化钠是________氧化物,能与盐酸、H2O、CO2等反应。
氧化钠与水反应的化学方程式为__________________________。
氧化钠与二氧化碳反应的化学方程式为________________________。
3.过氧化钠与水反应的化学方程式为___________________________________,过氧化钠与二氧化碳反应的化学方程式为_______________________________,因此过氧化钠可作为呼吸面具或潜水艇中________的来源。
从上面两个反应可以看出过氧化钠不属于________氧化物。
4.碳酸钠俗名纯碱,也叫________。
从类别上看属于________,它的水溶液呈碱性。
5.碳酸氢钠俗名________。
从类别上看属于盐,它的水溶液呈________。
碳酸氢钠不稳定,受热易分解,化学方程式为_____________________________________________,此反应可用来鉴别碳酸钠和碳酸氢钠。
6.钠元素焰色反应是________色,钾元素焰色反应是________色(透过蓝色的钴玻璃)。
利用焰色反应检验某种金属元素的步骤是:__________、__________、________、烧、洗。
●自主探究1.Na2O与Na2O2哪个更稳定?提示:稳定性往往与活泼性相反,即越易与其他物质反应,其稳定性越差。
氧化钠受热可转变成过氧化钠,说明其稳定性较差。
【导语】钠是⼀种⾦属元素,在周期表中位于第3周期、第IA族。
下⾯是分享的关于钠的化学所有知识点。
欢迎阅读参考! 化学钠的知识点 1.钠的物理性质: (1)⽩:银⽩⾊、有⾦属光泽的固体; (2)轻:密度⼩,ρ(Na)=0.97g/cm3,⽐⽔的密度⼩; (3)低:熔点和沸点低,熔点97.81℃,沸点882.9℃; (4)⼩:硬度⼩,可以⽤⼩⼑切割; (5)导:钠是热和电的良导体。
2.钠的化学性质: (1)钠与⽔的反应:2Na+2H2O==2NaOH+H2↑ (2)钠与氧⽓的反应: 钠在空⽓中缓慢氧化:4Na+O2==2Na2O(⽩⾊固体) 钠在空⽓中加热或点燃:2Na+O2 Na2O2(淡黄⾊固体) 3.钠的保存及⽤途 (1)钠的保存:钠很容易跟空⽓中的氧⽓和⽔起反应,因此,在实验室中,通常将钠保存在煤油⾥,由于ρ(Na)>ρ(煤油),钠沉在煤油下⾯,将钠与氧⽓和⽔隔绝。
(2)钠的⽤途: ①钠钾合⾦(室温下呈液态),⽤作原⼦反应堆的导热剂。
②制备Na2O2。
③作为强还原剂制备某些稀有⾦属。
氧化钠与过氧化钠的性质⽐较 名称氧化钠过氧化钠 化学式Na2ONa2O2 颜⾊状态⽩⾊固体淡黄⾊固体 与H2O反应Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2↑ 与CO2反应Na2O+CO2==Na2CO32Na2O2+2CO2==2Na2CO3+O2 ⽣成条件在常温时,钠与O2反应燃烧或加热时,钠与O2反应 ⽤途——呼吸⾯罩、潜⽔艇的供氧剂,漂⽩剂 化学钠及其化合物的⽅程式 1. 钠在空⽓中缓慢氧化:4Na+O2==2Na2O 2. 钠在空⽓中燃烧:2Na+O2点燃====Na2O2 3. 钠与⽔反应:2Na+2H2O=2NaOH+H2↑ 现象:①钠浮在⽔⾯上;②熔化为银⽩⾊⼩球;③在⽔⾯上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的⽔变红⾊。
4. 过氧化钠与⽔反应:2Na2O2+2H2O=4NaOH+O2↑ 5. 过氧化钠与⼆氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 6. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑ 7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O 8. 在碳酸钠溶液中通⼊⼆氧化碳:Na2CO3+CO2+H2O=2NaHCO3 9. 氯⽓与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O 10. 铁丝在氯⽓中燃烧:2Fe+3Cl2点燃===2FeCl3 11. 制取漂⽩粉(氯⽓能通⼊⽯灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 12. 氯⽓与⽔的反应:Cl2+H2O=HClO+HCl 13. 次氯酸钠在空⽓中变质:NaClO+CO2+H2O=NaHCO3+HClO 14. 次氯酸钙在空⽓中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 化学易错知识点 1、同种元素组成的物质不⼀定是单质,同种元素组成的物质也不⼀定是纯净物。
钠及其重要化合物【考情分析】在近几年的高考中,主要以钠及化合物为知识载体考查学生的思维能力、实验能力、计算能力。
钠的化合物在日常生活和工农业生产中扮演着重要角色,随着高考试题与社会生活联系的日益密切,钠、过氧化钠的性质,NaHCO 3、Na 2CO 3与酸、碱、盐溶液的反应仍然是高考命题的热点。
预计今后仍将以钠及其化合物之间的转化为载体,结合生活、生产及物质的应用,以工业流程题、实验题、选择题和鉴别题等形式出现的可能性较大,也可能出现综合性计算题。
【核心素养分析】1.宏观辨识与微观探析:认识钠及其化合物的性质和应用。
能从钠的原子结构及其重要化合物的微观结构理解其性质,领悟结构决定性质。
2.科学探究与创新意识:了解钠及其化合物的性质探究方案,并积极参与实验探究过程,得出相关结论。
【网络构建】【知识梳理】智能点一 钠的性质及应用 1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大,即ρ(H 2O)>ρ(Na)>ρ(煤油)。
2.从钠原子的原子结构认识钠的化学性质——还原性Na―――――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +(1)与非金属单质(如O 2、Cl 2)的反应O 2:常温:4Na +O 2===2Na 2O,加热:2Na +O 2Na 2O 2 Cl 2:2Na +Cl 2=====点燃2NaCl (2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
(4)与盐反应 a .与熔融盐反应 如:4Na +TiCl 44NaCl +TiNa +KClNaCl +K ↑(制取金属钾,因为钾的沸点比钠的沸点低,使钾成为蒸汽而逸出)b .与盐溶液反应Na 与CuSO 4溶液反应的化学方程式2Na +CuSO 4+2H 2O===Na 2SO 4+H 2↑+Cu(OH)2↓。
第二章 海水中的重要元素——钠和氯第一节 钠及其化合物一、活泼的金属单质——钠 1、钠与非金属单质的反应(1)钠是一种 银白 色的固体,密度比煤油 大 ;硬度 小 ,在空气中很快 变暗 ,钠与氧气发生反应生成 Na 2O ,反应的化学方程式为 4Na +O 2===2Na 2O 。
(2)将钠加热,观察到钠先熔化成小球,然后剧烈反应,火焰呈 黄 色,生成了 淡黄 色固体,该固体物质是 Na 2O 2 ,反应的化学方程式为 2Na +O 2=====△Na 2O 2 。
(1)钠是非常活泼的金属,与O 2反应时,反应条件不同,现象 不同 ,产物 不同 。
2、钠与水的反应实验操作实验现象 原因解释钠浮在水面上(浮) 钠的密度比水小 钠熔化成闪亮的小球(熔)钠的熔点低 ,反应放热小球在水面上四处游动,最后完全消失(游) 反应产生的气体(H 2) 推动小球运动与水反应发出嘶嘶响声(响)钠与水反应剧烈 反应后溶液的颜色逐渐变红色(红)反应生成碱(NaOH)(1)钠与水剧烈反应生成NaOH 和H 2,反应中氧化剂是 H 2O ,还原剂是 Na ,反应的实质是钠与水电离出的H +反应。
(2)反应方程式①化学方程式:①2Na +2H 2O ===2NaOH +H 2↑ ; ②离子方程式:2Na +2H 2O ===2Na ++2OH -+H 2↑ 。
3、钠露置于空气中的变化(1)金属钠长期露置于空气中最终完全转变为Na 2CO 3粉末,此过程中的主要变化与现象:(2)发生主要变化的化学方程式为①4Na +O 2===2Na 2O ②Na 2O +H 2O===2NaOH④2NaOH +CO 2===Na 2CO 3+H 2O , Na 2CO 3+10H 2O===Na 2CO 3·10H 2O ⑤Na 2CO 3·10H 2O===Na 2CO 3+10H 2O二、钠的几种化合物 1、氧化钠和过氧化钠的比较物质氧化钠(Na 2O)过氧化钠(Na 2O 2)组成结构 由Na +与O 2-构成,Na +与O 2-数目比为 2∶1由Na +与O 2-2构成,Na +与O 2-2数目比为2∶1 氧元素化合价-2 -1 类别 碱性氧化物 过氧化物 色、态 白色固体淡黄色固体生成条件 Na 与O 2在常温下反应 Na 与O 2在加热条件下反应热稳定性 不稳定,易转化为Na 2O 2 较稳定与H 2O 反应 Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑ 与CO 2反应 Na 2O +CO 2===Na 2CO 3 2Na 2O 2+2CO 2===2Na 2CO 3+O 2 与H +反应 Na 2O +2H +===2Na ++H 2O2Na 2O 2+4H +===4Na ++2H 2O +O 2↑ 用途 用于制备NaOH 等可作漂白剂(漂白织物等)、强氧化剂、供氧剂(用于呼吸面具和潜水艇中氧气的来源)联系加热时可发生反应:2Na 2O +O 2=====△2Na 2O 22、Na2CO3与NaHCO3性质的比较碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)俗名纯碱或苏打小苏打色、态白色粉末(Na2CO3·10H2O为晶体)细小、白色粉末溶解性易溶于水在水中溶解度比Na2CO3小溶液的酸碱性显碱性显碱性热稳定性稳定,受热难分解;但结晶碳酸钠(Na2CO3·10H2O)易风化不稳定,受热易分解:2NaHCO3=====△Na2CO3+H2O+CO2↑与酸反应(与HCl)Na2CO3+2HCl===2NaCl+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑(反应速率比Na2CO3快)与碱反应[与Ca(OH)2、NaOH]Na2CO3+Ca(OH)2===CaCO3↓+2NaOH (Na2CO3与NaOH不反应)2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2ONaHCO3+NaOH===Na2CO3+H2O 与可溶性钙盐、钡盐反应(与CaCl2、BaCl2)Na2CO3+CaCl2===CaCO3↓+2NaClNa2CO3+BaCl2===BaCO3↓+2NaCl不反应相互转化Na2CO3CO2+H2O①固加热,②液NaOHNaHCO3用途用于玻璃、肥皂、洗涤剂、造纸、纺织等工业制发酵剂、灭火器、医疗上用于治疗胃酸过多3、侯氏制碱法(1)原料:氨、氯化钠。
氧化钠与过氧化钠的比较
很久很久以前有两兄弟,哥哥叫氧化钠,弟弟叫过氧化钠。
他们从生下来就爱攀比,只要是哥哥有的弟弟也要有。
哥哥所做的事弟弟也要争着去做。
有一天他们又开始了攀比:
氧化钠说:“我比你活泼,我可以和二氧化碳反应生成碳酸钠和水。
”
过氧化钠说:“我和二氧化碳反应不仅能生成碳酸钠和水,还能生成氧气。
”
氧化钠说:我能与水,盐酸反应生成氢氧化钠,氯化钠。
过氧化钠说:我也能与他们反应,并且还能比你多生成一种产物氧气。
还有就是我能做供氧剂、氧化剂、漂白剂,你行吗?
从他们的对话中你能看出谁的化学性质活泼些吗?。