氧化还原反应方程式配平优秀教案青年教师赛课
- 格式:docx
- 大小:30.84 KB
- 文档页数:7

【高中化学】高二化学氧化还原反应方程式的配平教案教学目标
目标
使掌握用化合价升降法配平氧化还原反应方程式。
目标
培养学生配平氧化还原反应方程式的技能。
情感目标
通过对各种氧化还原反应方程式的不同配平的介绍,对学生进行辩证的训练。
教学建议
教学重点:氧化还原反应方程式配平的原则和步骤。
教学难点:在氧化还原反应方程式的平衡中有一些可供借鉴的经验。
教材分析:
平衡氧化还原反应方程式是正确编写氧化还原反应方程式的重要步骤,也是理科学生
应掌握的基本技能。
平衡氧化还原反应方程式的方法有很多,本节介绍的“排便谷提升法”就是其中之一。
教材从反应中的物质变化遵守质量守恒定律引入,说明氧化还原反应方程式可以根据
质量守恒定律来配平,但对于较复杂的氧化还原反应,根据质量守恒定律来配平不太方便,进而引出用&ldquo
高中生物
;化合价升降法”解决这一问题的有效措施。
本节教材通过三个典型例子详细分析了三种不同类型的氧化还原反应;介绍三种不同
的平衡方法,培养学生灵活处理氧化还原反应方程式的平衡能力,培养学生的辩证思维。
教材还通过问题讨论,将学生易出错误的氧化还原反应的离子方程式,用配平时应遵
循的原则—化合价升降总数相等,进行分析判断,强化了配平的关键步骤—使反应前后离
子所带的电荷总数相等的原则,培养了学生的能力。
教学建议
教学中应注重新旧知识间的联系,利用学生所学的氧化还原反应概念和接触的一些氧化还原反应,本节内容。
教学中应采用精讲精练、讲练结合的方法,使学生逐步掌握氧化还原反应的配平方法。
不能使学生一步到位,随意拓宽知识内容。

氧化还原反应方程式的配平目标: 1. 理解氧化还原反应配平的有关方法及有关类型;2.能正确书写氧化还原反应的方程式。
重点:氧化还原反应配平难点:氧化还原反应方程式的书写教学过程一、氧化还原反应的配平1 、配平依据:①电子守恒:氧化剂化合价降低总数与还原剂化合价升高总数相等,即得失电子守恒;②质量守恒;③电荷守恒(离子方程式)2、配平方法:化合价升降法3、配平的步骤:划好价、列变化、求总数、配化学计量数4、配平基本技能:①全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
例1: NH3 + O2 ——NO + H2O (左边,N 与02分别变化5、4)KMnO4 + H2s + H2SO4 ——K2SO4 + Sj + MnSO4 + H2O(左边,Mn ,S 化合价变化分别为5、2)K2Cr2O + KI + H 2SO4——Cr2(SO4)3 + K 2SO4 + I2 + H2O 61(左边,Cr2,I 价态变化分别为6、1)Pt + HNO3 + HCl ——H2PtCl6 + NO + H 2O(左边,Pt,N 价态变化为4、3)②自变从右边配:自身氧化——还原反应(包括分解、歧化)一般从右边着手配平例2:Cl2 + KOH ——KCl + KClO 3 + H2O15(右边变成Cl ,Cl 变化为1、5)Cu(NO3)2——CuO + NO2 + O2(右边NO、O2生成,价态变化为1、4)(NH4)2PtCl6 ——Pt + NH 4Cl + HCl + N 2(右边Pt, N2价态变化为4、6)③归中从左边配:归中反应(反歧化,化合型氧化——还原反应)一般从左边着手配平,?例3: H2s + SO2 ——S + H20 (左边:S 2 , S 4 S变化分别为2、4)15KI + KIO 3 + H2SO4——I2 + K2SO4 + H2O (左边:I、I I2变化1、5)Fe2(SO4)3 H20 (左边Fe2、02变为1, 4)FeSO4 + H2SO4 + O2④部分变由两边配:一部分发生氧化一一还原反应的物质化学计量数应为变与不变之和,例4: HCl + KMnO 4——KCl + MnCl 2 + Cl2T + H2O(HCl化学计量数应为被氧化与未被氧化之和)Zn + HNO 3 ——Zn(NO3)2 + NH4NO3 + H2O(HNO3化学计量应为被还原与未被还原的HNO 3之和)二、氧化还原反应方程式的书写例5: (1)氢氧化亚铁、氢氧化铁与稀HNO3反应的方程式(2)某一反应体系中共有As2s3、HNO 3、H2SO4、NO、HAsO4、H2O六种物质。


氧化还原反应配平教案
氧化还原反应是化学反应中常见的一种类型。
在氧化还原反应中,原子或离子
的氧化态发生变化,同时也发生了电子的转移。
为了描述和平衡氧化还原反应,需要遵循一定的规则和方法。
首先,为了配平氧化还原反应方程式,我们可以按照以下步骤进行:
1. 确定反应方程式中的氧化物和还原物。
氧化剂是接受电子的物质,而还原剂是给出电子的物质。
通过观察反应方程式,我们可以确定氧化物和还原物的存在。
2. 根据氧化态的变化量,确定需要的电子数目。
通过氧化物和还原物的氧化态变化,我们可以确定反应中发生的电子转移数目。
这个数目将成为平衡方程式中电子数目的系数。
3. 使用最小公倍数将反应方程式中的原子数目进行平衡。
通过添加适当的系数,我们可以确保反应方程式中不同元素的原子数目相等,并且满足氧化还原反应中电子转移的需求。
在此过程中,应避免改变氧化态发生变化的原子。
4. 检查方程式,确保反应前后的质量和电荷平衡。
最后,我们需要仔细检查平衡的反应方程式,以确保反应前后质量守恒和电
荷守恒。
通过以上步骤,我们可以配平氧化还原反应方程式,准确描述反应的物质转化
和电子转移过程。
这种方法可以应用于不同的氧化还原反应,并帮助我们更好地理解化学反应的本质。
希望这个教案能够帮助你更好地理解和掌握氧化还原反应的配平方法。

《氧化还原反应方程式的配平及计算》教案一、氧化还原反应方程式的配平1.氧化还原反应方程式配平的基本原则(1)得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2.氧化还原反应方程式配平的一般步骤(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
C 0+HN +5O 3(浓)——N +4O 2↑+C +4O 2↑+H 2O(2)列变化:标出反应前后元素化合价的变化。
(3)求总数:依据电子得失守恒,使化合价升高和降低的总数相等。
(4)配化学计量数:用观察法配平其他物质的化学计量数。
C +4HNO 3(浓)——4NO 2↑+CO 2↑+2H 2O(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
C +4HNO 3(浓)=====△4NO 2↑+CO 2↑+2H 2O1.配平下列氧化还原反应方程式(1)正向配平类①__HCl(浓)+__MnO 2=====△__Cl 2↑+__MnCl 2+__H 2O②__KMnO 4+__FeSO 4+__H 2SO 4===__K 2SO 4+__MnSO 4+__Fe 2(SO 4)3+__H 2O 答案 ①4 1 1 1 2 ②2 10 8 1 2 5 8(2)逆向配平类①__S +__KOH=====△__K 2S +__K 2SO 3+__H 2O②__Cl 2+__NaOH=====△__NaCl +__NaClO 3+__H 2O答案①36213②3651 3(3)缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]①__MnO-4+__H2O2+____===__Mn2++__O2↑+__H2O②__Fe3++__SO2+__H2O===__Fe2++__SO2-4+____答案①256H+258②212214H+配平的基本方法(1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
氧化还原反应方程式的配平教案氧化还原反应方程式的配平教案教学目标知识目标使学生掌握用化合价升降法配平氧化还原反应方程式。
能力目标培养学生配平氧化还原反应方程式的技能。
情感目标通过对各种氧化还原反应方程式的不同配平方法的介绍,对学生进行辩证思维的训练。
教学建议教学重点:氧化还原反应方程式配平的原则和步骤。
教学难点:氧化还原反应方程式配平的一些可借鉴的经验。
教材分析:氧化还原反应方程式的配平是正确书写氧化还原反应方程式的一个重要步骤,也是侧重理科学生所应掌握的一项基本技能。
配平氧化还原反应方程式的方法有多种,本节介绍的“化便谷升降法”就是其中的一种。
教材从化学反应中的物质变化遵守质量守恒定律引入,说明氧化还原反应方程式可以根据质量守恒定律来配平,但对于较复杂的氧化还原反应,根据质量守恒定律来配平不太方便,进而引出用“化合价升降法”解决这一问题的有效措施。
本节教材通过三个典型的例题,对三种不同类型的氧化还原反应进行细致分析;介绍了三种不同的配平方法,培养了学生灵活看待氧化还原反应方程式的配平能力,训练了学生的辩证思维。
教材还通过问题讨论,将学生易出错误的氧化还原反应的离子方程式,用配平时应遵循的原则—化合价升降总数相等,进行分析判断,强化了配平的关键步骤—使反应前后离子所带的电荷总数相等的原则,培养了学生的能力。
教法建议教学中应注重新旧知识间的联系,利用学生所学的氧化还原反应概念和接触的一些氧化还原反应,学习本节内容。
教学中应采用精讲精练、讲练结合的方法,使学生逐步掌握氧化还原反应的配平方法。
不能使学生一步到位,随意拓宽知识内容。
1.通过复习,总结配平原则教师通过以学生学习过的某一氧化还原反应方程式为例,引导学生分析电子转移及化合价的变化,总结出氧化还原反应方程式的配平原则—化合价升降总数相等。
2.配平步骤[例1]、[例2]师生共同分析归纳配平基本步骤:(1)写出反应物和生成物的化学式,分别标出变价元素的化合价,得出升降数目。
高中化学-高二氧化还原反应方程式的配平教案教学目标:1.了解氧化还原反应的概念,掌握配平氧化还原反应方程式的方法。
2.了解氧化还原反应中电子的概念以及标志方法。
教学重点:1.氧化还原反应方程式的配平。
2.氧化还原反应中电子的概念及标志方法。
教学难点:1.化学方程式的配平方法。
2.氧化还原反应中电子的抽象概念。
教学准备:1.教材2.化学实验室3.化学试剂教学过程:第一步:引入1.导入氧化还原反应的概念,了解氧化还原反应的意义及意义。
2.氧化还原反应的基本特点和氧化还原反应的标志。
(1)原子氧化态的改变;(2)电子转移的吸放热;(3)物质的氧化或还原。
3.通过实验介绍氧化还原反应的标志及表现形式。
第二步:讲解1.氧化还原反应方程式的配平:(1)原子数目平衡(2)电荷数目平衡2.讲解电化学符号、半反应方程式及概念。
(1)化学反应中游离电子的存在。
(2)氧化反应和还原反应的特点及表现。
(3)电子的抽象概念及标志方法。
(4)如何通过标志方法进行半反应方程式的书写。
3.配合例题进行讲解。
第三步:练习1.课后习题:(1)简单的化学反应式的分类。
(2)化学反应式中需要平衡量的判断。
(3)举例说明:配平HNO3+KI->HIO3+KNO3反应式。
2.实验操作:实验现象:将铁片放入CuSO4溶液中,铁片逐渐腐蚀,铜离子逐渐还原出铜。
实验过程:(1)消毒铁片;(2)称取0.5gCuSO4.5H2O溶解于50mL水中;(3)以瓷漏斗过滤;(4)加入消毒铁片;(5)观察铁片腐蚀的程度;(6)着重观察铜还原的现象。
注意事项:(1)安全操作。
(2)溶液不要接触皮肤。
(3)保存相关数据和记录。
第四步:总结1.通过上面的学习,我们了解了氧化还原反应的概念及标志,掌握了配平氧化还原反应方程式的方法。
2.学会在实验室操作中观察氧化还原反应的现象,并对其获得直观的认识。
3.同时也发现了分子量、分子式在配平过程中发挥了其作用,帮助配平化学方程式。
第四节氧化还原反应方程式的配平一、氧化还原方程式的配平1.配平三原则⑴即电子转移数目相等⑵即反应前后原子种类和数目相等⑶即反应前后电荷总数相等。
2.配平步骤⑴即标出参与氧化还原反应的元素的化合价。
⑵即列出元素化合价的变化。
⑶即使化合价升降总数相等。
⑷即用观察法配平其它物质的系数。
⑸即根据配平三原则进行检验。
〖例1〗铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。
⑴配平制取铁酸钠的化学方程式:Fe(NO3)3+ NaOH+ Cl2 Na2FeO4+ NaNO3+ NaCl + H2O反应中元素被氧化,转移电子总数为。
⑵铁酸钠之所以能净水,除了能消毒杀菌外,另一个原因是。
二、新情景氧化还原方程式的书写技巧⑴依据题设信息,判断出反应物、生成物。
根据元素化合价升降规律,合理写出反应物或生成物的化学式,或从已给物质中找出反应物、生成物的化学式。
⑵配平反应方程式,并补全缺项物质的化学式。
⑶从反应物、生成物的性质检查方程式是否正确。
[教学目标]1.知识目标(1)掌握配平氧化还原反应方程式常用技巧。
(2)初步了解一些比较特殊的氧化还原方程式配平的方法。
2.情感和价值观目标1)通过一般氧化还原反应方程式、特殊的氧化还原反应方程式的配平,理解事物的一般性和特殊性,加深具体情况具体分析的思想观念。
(2)通过一些配平技巧、配平的规律的学习,培养学生创造和发现化学学科的科学美、规律美,从中提高学习化学的兴趣。
【教学目标】知识与技能:用电子转移的观点分析氧化还原反应;氧化剂、还原剂、氧化产物、还原产物的判断;表示氧化还原反应电子转移的方向和数目;氧化还原反应方程式的配平方法;2.过程与方法:本次课程将从化学反应中的物质变化遵守质量守恒定律引入,说明氧化还原反应方程式可以根据质量守恒定律来配平。
还通过问题讨论,将学生易出错误的氧化还原反应的离子方程式,用配平时应遵循的原则—化合价升降总数相等,进行分析判断,强化了配平的关键步骤—使反应前后离子所带的电荷总数相等的原则,培养了学生的能力。
氧化还原反应配平教案【篇一:《氧化还原反应方程式的配平》教学设计】《氧化还原反应方程式的配平》教学设计教学目标知识目标使学生掌握用化合价升降法配平氧化还原反应方程式。
能力目标培养学生配平氧化还原反应方程式的技能。
情感目标通过对各种氧化还原反应方程式的不同配平方法的介绍,对学生进行辩证思维的训练。
教学建议教学重点:氧化还原反应方程式配平的原则和步骤。
教学难点:氧化还原反应方程式配平的一些可借鉴的经验。
教材分析:氧化还原反应方程式的配平是正确书写氧化还原反应方程式的一个重要步骤,也是侧重理科学生所应掌握的一项基本技能。
配平氧化还原反应方程式的方法有多种,本节介绍的“化便谷升降法”就是其中的一种。
教材从化学反应中的物质变化遵守质量守恒定律引入,说明氧化还原反应方程式可以根据质量守恒定律来配平,但对于较复杂的氧化还原反应,根据质量守恒定律来配平不太方便,进而引出用“化合价升降法”解决这一问题的有效措施。
本节教材通过三个典型的例题,对三种不同类型的氧化还原反应进行细致分析;介绍了三种不同的配平方法,培养了学生灵活看待氧化还原反应方程式的配平能力,训练了学生的辩证思维。
教材还通过问题讨论,将学生易出错误的氧化还原反应的离子方程式,用配平时应遵循的原则—化合价升降总数相等,进行分析判断,强化了配平的关键步骤—使反应前后离子所带的电荷总数相等的原则,培养了学生的能力。
教法建议教学中应注重新旧知识间的联系,利用学生所学的氧化还原反应概念和接触的一些氧化还原反应,学习本节内容。
教学中应采用精讲精练、讲练结合的方法,使学生逐步掌握氧化还原反应的配平方法。
不能使学生一步到位,随意拓宽知识内容。
1.通过复习,总结配平原则教师通过以学生学习过的某一氧化还原反应方程式为例,引导学生分析电子转移及化合价的变化,总结出氧化还原反应方程式的配平原则—化合价升降总数相等。
2.配平步骤[例1]、[例2]师生共同分析归纳配平基本步骤:(1)写出反应物和生成物的化学式,分别标出变价元素的化合价,得出升降数目。
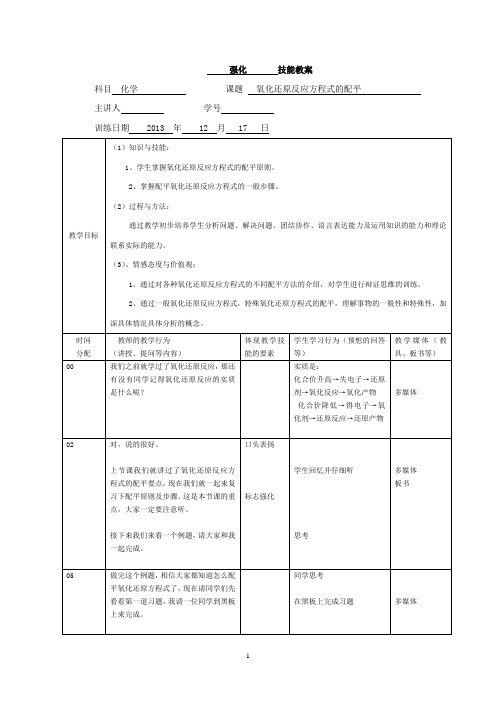
氧化还原反应方程式配平优秀教案青年教师赛课
作者: 日期:
氧化还原反应方程式的配平教案
2、列变化:标出反应前后元素化合价的变化
教学过程 教学内谷(过程)
学生总结 配平氧化 还原反应 的一般步 骤和方法 (5min ) 2、 配平氧化还原反应方程式的依据是什么? 3、 配平氧化还原反应方程的一般步骤有哪些? 【学生】认真阅读教材,P18,总结。
【板书】二、配平原则:
1、 化合价升降守恒:氧化剂和还原剂得失电子总数 相等,化合价升高总数==化合价降低总数。
2、 质量守恒:反应前后原子的种类和个数不变。
3、 电荷守恒:离子反应前后,所带电荷总数相等。
【过渡】下面我们依据配平原则,结合碳与硝酸的反 应来讨论用化合价升降法配平的步骤。
【板书】三、配平步骤
1、标价态:写出反应物和生成物的化学式,标出发 生氧化
反应和还原反应的元素的正负化合价。
0
+5
+4
+4
C + HNOj = NO :T + CO,? - H ;O
活动 应方程式 的配平方 法。
师生一起 配平例题 1、2后总 结、展示 结论
意图 阅读、总结 的能力
总结、展示
结论
3、 -HNO 3 一
+4
+斗
CO :T -H ;0
求总数:依据电子守恒,使化合价升咼和降低的 总数
相等。
化合悔升高-XI
例题精讲 5mi n 0 +5 片斗
+4
C + HN01 — NOiT + CO4 -
丨
t
X 4
4、配系数:用观察法配平其他物质的化学计量数, 配平
后,把单线改成等号。
C + 4HNO 3 = 4 NO :T + C0;? + 2H ;0
5、 查守恒:检查方程式是否满足原子守恒、化合价 升降守
恒、电荷守恒
6、 【例题】MnO 2+HCI (浓)一 MnCl 2 + H 2O+
Cl 2?
【教师】通过这个例子我们熟悉了氧化还原反应配平 的步骤,下面同学们配平下面这个反应。
【练习】Cu+ HNO 3(稀)— Cu ( NO 3)2 + NOf+ H 2O
例题由老 师带领学 生共同学 习完成
Hr~r —
IV 〉、/• —~r
思考学习 的过程
C + HNO 3(浓)
CO 2? + NO 2? + H 2O
5
教学过程 教学内容(过程)
活动 意图
H 2S+ SO 2 S+ H 2O
学生自主 练习,合 作交流展 示成果 8min Cl 2 + H2O —— HCl + HClO
S + NaOH —— Na
2S +
NaSO 3 +
H 2O
KClO 3 —— KCl+ O 2T
知识点提 升 12min
学生自主 练习后, 小组讨
论,对答 案,抽取 一些小组 到黑板上 展示自己 的答案
练习配平
氧化还原 反应方程
式
通过练习 题巩固配 平氧化还 原反应方 程的一般 步骤和方 法,逐渐总 结复杂化 学方程式 的配平技 巧。
课堂练习 巩固知识
占 八、、。