纸色谱(课堂PPT)
- 格式:ppt
- 大小:254.00 KB
- 文档页数:14


实验三__纸色谱实验三纸色谱一、实验原理、方法、注意事项1、原理纸层色谱为在纸上将混合物进行分离的色谱方法,分为分析型和制备型纸层色谱。
多数情况下,纸层色谱的原理属于分配色谱原理,色谱滤纸为支持剂,滤纸纤维可以吸附25%,30%的水分,其中6,7%的水分和滤纸结构中的羟基以氢键结合,为固定相。
其他溶剂可自由通过,为流动相。
流动相流经支持物时,与固定相之间连续抽提,使物质在两相间不断分配而得到分离。
物质被分离后在纸色谱图谱上的位置用Rf值(比移值)来表示:R值 = 原点到色谱点中心的距离/ 原点到溶剂前沿的距离 f在一定条件下某种物质的R值是常数,其大小受物质的结构、性质、溶剂系统物质组f成与比例、pH值、选用滤纸质地和温度等多种因素影响。
此外,样品中的盐分、其他杂质以及点样过多均会影响的有效分离。
但由于影响比移值的因素较多,因而一般采用在相同实验条件下与对照物质对比以确定其异同。
作为药品的鉴别时,供试品在色谱中所显主斑点的颜色(或荧光)与位置,应与对照品在色谱中所显的主斑点相同。
作为药品的纯度检查时,可取一定量的供试品,经展开后,按各药品项下的规定,检视其所显杂质斑点的个数或呈色(或荧光)的强度。
作为药品的含量测定时,将主色谱斑点剪下洗脱后,再用适宜的方法测定。
无色物质的纸色谱图谱可用光谱法(紫外光照射)或显色法鉴定,氨基酸纸色谱图谱常用茚三酮显色法鉴定。
纸层色谱适用于极性较大的亲水性化合物或极性差别较小的化合物的分离。
2、实验方法(1) 下行法将供试品溶解于适当的溶剂中制成一定浓度的溶液。
用微量吸管或微量注射器吸取溶液,点于点样基线上,溶液宜分次点加,每次点加后,俟其自然干燥、低温烘干或经温热气流吹干,样点直径为2,4mm,点间距离约为1.5,2.0cm,样点通常应为圆形。
将点样后的色谱滤纸上端放在溶剂槽内并用玻棒压住,使色谱纸通过槽侧玻璃支持棒自然下垂,点样基线在支持棒下数厘米处。
展开前,展开室内用各品种项下规定的溶剂的蒸气使through the "scorecard" on borrowers ' scores. 24th account manager in the personal lending survey returns (4) fill out the survey, along with other loan information to review. And common findings include the borrower repayment of basic information, income 之饱和,一般可在展开室底部放一装有规定溶剂的平皿或将浸有规定溶剂的滤纸条附着在展开室内壁上,放置一定时间,俟溶剂挥发使室内充满饱和蒸气。





教学重点:比移值及色谱操作条件的选择。
第五章 纸色谱简介 5.1基本原理纸色层-纸上萃取色谱,它和萃取一样,它也是根据不同物质在两相间的分配比不同而进行分离的(相当于逆流萃取)。
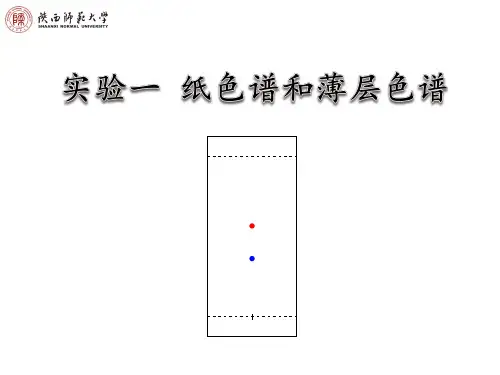
1.层析缸 2.滤纸 3.原点 4.展开剂 5.前沿 6.7.斑点 5.2比移值R f 组份分离后,它们在滤纸上的位置用比移值Rf表示。
[定义]:yx R f =原点至溶剂前沿距离原点至斑点中心距离= Rf的大小取决于溶质在二相间的分配系数及滤纸的性质。
不同的组分具有不同的分配系数, 因而也就有不同的Rf,这就是定性的依据。
5.3 影响R f 的因素(1).欲分离物的本性:物质在两相的分配系数,决定了它的Rf大小; (2).层析溶剂:同一组分在不同溶剂中Rf不同。
通常应选这样的层析剂,使溶质的Rf在0.05 ~ 0.85之间,不同组分的Rf差值>0.05。
(3).pH:影响它们的存在状态; (4).滤纸:质地均一、厚薄适当、具有一定机械强度、不含杂质; (5).温度:在层析缸中用红外灯照射。
温度会影响溶质的分配系数及流动相的扩散速度。
层析操作应在恒温下进行,温度不超过± 0.5oC。
(6).展开方式:展开方式不同,Rf也不同。
下行法的Rf 最大,上行法的Rf较小,环行法的 Rf也不大。
5.4操作技术5.4.1滤纸(担体) 1.滤纸的选择 a.要求滤纸质地均匀、平整无折痕边缘整齐; b.要求滤纸的纤维松紧适宜. c.滤纸的杂质含量少。
2.层析滤纸的性能与规格 3.滤纸的处理 以0.1~0.4 mol/L HCl (或 2 mol/L HAc)浸泡数小时,除去无机杂质后,取出用蒸馏水洗净,再将滤纸放在丙酮-乙醇(1:1)中浸泡一周时间,除去有机杂质,再取出风干备用。
5.4.2.固定相 纸层析-以吸着在纤维素上的水作固定相。
反相纸层析-用甲酰胺、二甲基甲酰胺、丙二醇等作固定相。
若分离芳香油等非极性物,以石蜡油、硅油作固定相。