天津大学化学系有机化学复习资料
- 格式:pptx
- 大小:1.06 MB
- 文档页数:85

![532002[有机化学] 天津大学考试题库及答案](https://uimg.taocdn.com/ee110dcb3c1ec5da50e270bd.webp)
有机化学复习题一、命名下列化合物或根据命名写出构造式1、(甲基环丙烷)2、(2-甲基丁烷)3、((Z)-1,2-二溴乙烯)4、(反-2-戊烯)5、(三乙胺)6、((R)-2-羟基丙酸)7、(对甲基苯甲醛)8、(环己烷)9、(N,N-二甲基乙酰胺)10、(甲苯)11、(叔丁醇)12、(对羟基苯甲醛)13、(苯甲酰氯)14、((E)-1-溴丙烯)15、间二甲苯:、邻苯二甲酸酐:17、呋喃: 18、苯甲醚:19、对甲基苯酚: 20、氯苯:21、N-甲基苯胺: 22、间氯苯甲酸:23、对氯甲苯:25、乙酰苯胺:26、乙醚:二、选择题1、下列分子中,属于非极性分子的是:( A )(A) CCl 4 (B )CH 2Cl 2 (C )CH 3OH (D )CH 3Cl2、下列自由基中,最不稳定的是:( B )(A)(B)(C)(D)3、下列投影式中,属于Newman 投影式的是:( B ) (A)(B)(C)(D)4、下列碳正离子中,参与超共轭C-H 键最多的是( D )(A)(B)(C)(D)5、下列化合物中,存在π-π共轭的是:( B ) (A)(B)(C)(D)6、甲苯与氯气在光照条件下的主要产物是:( A ) (A)(B)(C)(D)7、列化合物不具有手性的是:( A )(A)(B)(C)(D)8、下列离子亲核能力最强的是:( C ) (A)(B) (C)(D)9、下列化合物或离子中,不具有芳香性的是:( B )(A)(B)(C)(D)10、下列化合物,酸性最强的是:( D ) (A)(B)(C)(D)11、下列醇类化合物在与ZnCl 2的浓HCl 进行反应时,速率最大的是( D ) (A) (B)(C)(D)12、下列化合物在与亚硫酸氢钠发生亲核加成反应,反应活性最高的是( D ) (A)(B)(C)(D)13、下列酯类化合物在进行水答案反应时,反应速率最高的是:( B ) (A)(B)(C)(D)14、下列化合物中,酸性最强的是:( A ) (A) (B) (C)(D)15、下列化合物中,碱性最强的是:( C ) (A)(B)(C)(D) 16、下列酸性化合物或离子中,不属于Bronsted 酸的是:( A )(A) (B) HNO 3 (C) HCl(D)AlCl 317、下列结构式中,不能表示构造的是:( B ) (A)(B)(C)(D)18、已知烷烃分子式C 5H 10,发生自由基氯代反应时,一元取代物只有一种,那么该烷烃的构造式应为:( A ) (A)(B)(C) (D)19、下列化合物在与1,3-丁二烯进行Diels-Alder反应时活性最高的是( D )( A ) (B)(C) (D)20、下列化合物中不是Lewis酸的化合物是:(A)(A) CHCl3 (B) BF3(C) AlCl3 (D) FeCl321、下列化合物中,是与发生Diel-Aldel反应产物的是(C)(B)22、醛与酮的羰基在与HCN发生亲核加成反应时,速率最快的是(A)(A) HCHO(B)(C)(D)23具有手性中心的个数为(B)(A) 1 (B) 2(C) 3 (D) 424、下述化合物进行硝化反应会时,反应产物最可能是( C )(A)(B)(C)(D)三、完成下列各反应式1、答:2、答:3、答:4、答:5、答:6、答:7、答:8、答:9、答:10、答:11、答:12、13、答:14、答:15、答:16、答:17、答:18、答:19、答:20、答:21、答:22、答:23、答:24、答:四、合成题1、由合成答:1答:2答:2、以答:3答:3、由合成答:4答:4和合成答:11/ 11。


第一章 习题(一) 用简单的文字解释下列术语:(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价键时体系所放出的能量。
(3) 极性键:成键原子的电负性相差为0.5~1.6时所形成的共价键。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7)均裂:共价键断裂时,两个成键电子均匀地分配给两个成键原子或原子团,形成两个自由基。
(8) 异裂:共价键断裂时,两个成键电子完成被某一个成键原子或原子团占有,形成正、负离子。
(9) sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1)C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) CH HH H H。


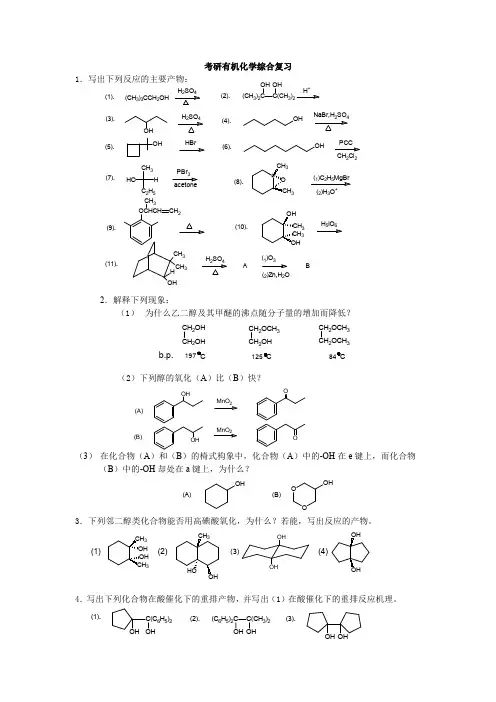

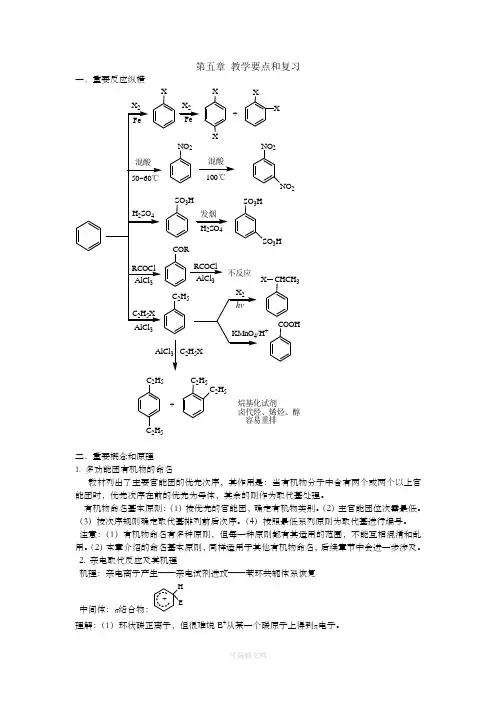
第五章教学要点和复习一.重要反应纵横+C2H5C2H5 C2H5C2H53烷基化试剂卤代烃、烯烃、醇容易重排二.重要概念和原理1. 多功能团有机物的命名教材列出了主要官能团的优先次序,其作用是:当有机物分子中含有两个或两个以上官能团时,优先次序在前的优先为母体,其余的则作为取代基处理。
有机物命名基本原则:(1)按优先的官能团,确定有机物类别。
(2)主官能团位次需最低。
(3)按次序规则确定取代基排列前后次序。
(4)按照最低系列原则为取代基进行编号。
注意:(1)有机物命名有多种原则,但每一种原则都有其适用的范围,不能互相混淆和乱用。
(2)本章介绍的命名基本原则,同样适用于其他有机物命名,后续章节中会进一步涉及。
2. 亲电取代反应及其机理机理:亲电离子产生——亲电试剂进攻——苯环共轭体系恢复中间体:σ络合物:HE +理解:(1)环状碳正离子,但很难说E+从某一个碳原子上得到π电子。
(2)可看作亲电加成产物产物,但不会停留于此:σ络合物失去质子可以恢复为稳定的苯环结构。
3. 苯取代定位规律及其解释本章重点和难点,教材以共振论结合电子效应解释。
教学中主要以电子效应进行解释。
理解:(1)苯环上的取代基,改变了苯环上电子云密度分布。
(2)供电子取代基,苯环上电子云密度分布提高,且邻对位上提高更多;吸电子取代基,苯环上电子云密度分布降低,但间位上降低较少。
(3)诱导和共轭效应均有供和吸电子两类,效应不一样的主要是卤素(吸电子诱导和供电子共轭)4. 芳香性及其判断原则:体系平面(碳杂化为SP 2),π电子符合:4n+2注意:π电子计算:碳碳双键每一个碳1个,碳正离子0个,碳负离子2个三.重要考点示范1. 下列亲电取代反应速率由快到慢的顺序为 。
(A) NO 2 (B) CH 3 (C) OCH 3 (D)答案: (C) (B) (D) (A)注意:亲电取代反应的速率主要与苯环上电子云密度有关,第一类定位基,且定位效应越强,则亲电取代反应速率越快。

天津大学有机化学考研真题-考研资料-笔记讲义在天津大学有机化学复习中,考研资料、考研真题及笔记讲义是必不可少的。
很多同学,特别是跨专业考生,在复习中没办法掌握重点,所以走了很多弯路。
而考研资料和讲义就可以让考生们在复习中迅速找到重点范围,掌握复习技巧。
另外、真题可以让考生掌握近几年的出题方向,测试自己的复习结果。
针对同学的复习情况,天津考研网独家推出了天津大学有机化学考研复习资料,以下为资料相关介绍。
天津大学有机化学考研资料由天津考研网签约的天津大学高分考研学生团队主创,该团队在历届考研中取得了专业课初试的优异成绩并在复试中更胜一筹,该资料包含该优秀团队考生的考研经验、考研试题解题思路分析、复试流程经验介绍以及针对官方指定参考书的重难要点并根据天津大学本科授课重点整理等,从漫漫初试长路到紧张复试亮剑为各位研友提供全程考研指导攻关。
本资料格式为打印版+手写版材料,核心资料数百页共计3万余字,其他资料清晰易复习,已于编写者签订资料保真转让协议,各位研友可放心使用参考!特别提示:本站尽力保证资料的有用性,但由于个人复习态度进度不同,故请酌情参考本资料!第一部分天津大学有机化学考研核心原创资料:A.核心资料一:天津大学有机化学资料为您提供了以下信息,希望能对你的学习有所帮助:一、天津大学有机化学专业一些导师介绍:包括学术研究方向以及老师对学生的要求。
二、天津大学有机化学专业的信息说明:考试内容,录取情况以及复试的简单程序(有关复试的详细介绍在第四部分)三、天津大学有机化学的复习:对基础知识考点为根据(以高鸿宾版《有机化学》为参考),从有机化学整体出发对知识点进行分类总结,系统的为大家讲解考试重点(大黑点以及红色字体),让您的复习更有效。
同时在一些章节中穿插一些具有代表性的真题,以便能加强记忆。
四、天津大学有机化学考研真题分析:根据近几年真题走向,分析天津大学出题风格,并简要说明每种题型中每年必考点。
五、复试指南:包括口语、面试、笔试(基础知识笔试)等,详细的说明每一个程序所考内容以及以及特别注意的地方。
有机化学天津大学复习资料有机化学是一个重要的化学分支,它研究有机物质的组成、结构、性质和变化规律。
对于学习化学的学生和从事化学相关工作的人员来说,有机化学知识是必备的。
而天津大学的有机化学复习资料则是一份不可错过的宝贵资源。
天津大学经过多年的学科建设和师资培养,已经成为了国内重要的教学和科研基地。
有机化学是该校化学系的一门主干课程之一,经过多年的教学积累和实践探索,该校制定了完善的有机化学课程体系,并且提供了丰富的学习资源和复习资料。
从知识点的角度来讲,有机化学的内容非常丰富,涉及有机物的基本概念、反应类型、结构、性质以及合成方法等方面。
针对这一点,天津大学的有机化学复习资料提供了全范围、全方位的知识点介绍和总结。
在这里,学生可以找到最新版的教材和资料,包括讲义、试卷、课件、习题和答案等。
同时,该校的教授们也为学生提供了丰富的教学资源和实践机会,比如实验室实习、课外学习、研究生讲座等。
这些活动不仅可以加深学生对有机化学知识的理解,还可以提升学生的实践能力和科研水平。
在这里,学生可以与一流的专家和学者进行沟通和交流,获取到真正的学习经验和知识成果。
天津大学有机化学复习资料不仅提供了高质量的教育资源和实践机会,而且还具有便捷的获取和使用途径。
学生可以通过校园网站、教务系统和学校图书馆等渠道获取到自己所需的资料和信息,也可以通过社交媒体、学术交流平台和在线论坛等方式与其他学生和专家进行交流和讨论。
总之,天津大学有机化学复习资料是一份非常珍贵和有价值的资源,可以帮助学生更好地了解和掌握有机化学知识,提升自己的专业能力和竞争力,为未来的学习和工作打下坚实的基础。
如果你正准备学习有机化学或者正在学习有机化学,那么不妨考虑使用天津大学的复习资料,相信你会受益匪浅。
大学有机化学复习提纲第一章绪论1. 有机化合物与有机化学的定义;2.共价键碳的杂化轨道; 键长, 键角, 键能, 键的极性;3. 分子的极性分子中所有化学键极性的向量和;4. 分子间作用力范德华力; 偶极-偶极力; 氢键;5. 有机物的分类按碳骨架分类; 按功能基分类;6. 有机反应类型均裂:游离基反应; 异裂:离子型反应;7有机酸碱概念酸碱质子理论; 酸碱电子理论;8. 分子轨道与共振共振式; 共振杂化体。
第二章烷烃和环烷烃第一节烷烃1. 烷烃的结构碳原子sp3杂化,四面体构型;2. 烷烃的命名系统命名法:选母体,编号,配基;3. 烷烃的异构构象异构:透视式,Newman投影式;4. 烷烃的性质游离基取代: 链引发,链增长,链终止。
卤代活性: R3CH >R2CH2 > RCH3 ;Cl2 > Br2 > I2。
第二节环烷烃1脂环烃的命名单脂环烃: 环某烷; 环某基某烃*桥环烃: 二环[ x. y. z ]某烷 (x>y>z)*螺环烃: 螺[x.y]某烷 (x < y) ;2. 环烷烃的结构和稳定性三元环< 四元环 < 五元环,六元环及以上的脂环烃;3. 环烷烃的性质取代; 加成(加H2、X2、HX等);4. 环己烷的构象异构船式、椅式。
优势构象: e 键取代基最多的椅式构象;大基团处于e 键的椅式构象。
第三章烯烃和炔烃1结构烯烃: sp2杂化. 共平面性;不可旋转性(顺反异构);不等性炔烃: sp 杂化,直线型 (炔键无顺反异构现象);2. 命名顺反构型命名法,Z/E构型命名法;次序规则;3. 电子效应诱导效应:电负性差引起;单向传递、短程作用。
共轭效应:电子离域引起;键长平均化,体系能量降低,交替极化,远程作用;4. 化学性质亲电加成(X2,HX等—Markovnikov规则, 加HBr的过氧化物效应);催化加氢;共轭加成; 氧化(KMnO4,O3等); 炔氢的酸性;炔淦反应。
第一部分命名一、通用规则1.选取含官能团在内的最长碳链作为主链。
若存在两条或两条以上等长的最长碳链,选择取代基数目最多的一条作主链。
2.用天干(甲乙丙丁戊己庚辛壬癸)代表主链碳原子数,写在母体名称之前,如甲烷,乙烯,丙炔,丁醇,戊酸等3.从距离官能团最近的一端开始,对主链进行编号(卤烃除外,X视为取代基)。
若有两种或两种以上编号方法,以及对于不含有官能团的烷烃,以取代基所在位次之和最小为原则,进行编号。
4.将各取代基的位次和名称写在母体名称之前。
以阿拉伯数字标明取代基位次,并以“-”与基名相连,如2-甲基;相同的取代基合并写出,位次按由小到大次序列出,并以“,”隔开,同时在基名前以汉字标明该取代基总数,如2,2,4-三甲基;不同取代基按“次序规则”(见附录)进行排列,较优基团后列出;不同取代基之间以“-”连接,最后一个基名与母体名称间无“-”,如2-甲基-3-乙基辛烷5.对于存在官能团位次异构的化合物,需要在取代基与主体名称之间以“-取代基位次-”的形式标明取代基位置,其中取代基位次以阿拉伯数字写出,双键、三键位次以成键C原子中较小位次为准,如2-甲基-3-戊醇,2-甲基-2-丁烯6.含有多个同种官能团时,按由小到大的次序依次列出官能团位次,并以“,”隔开,同时在母体名称前以汉字表明官能团总数,如1,3-丁二烯,2,4-庚二酮,对苯二酚,乙二酸,丙三醇*7.多官能团化合物命名时,按下式所列的优先级次序,以优先级较高的官能团作母体,优先级较低的官能团作取代基(—X和—NO2只能作取代基)—COOH>—COOR>—CN>—CHO>—C=O>—OH(醇)>—OH(酚)>—NH2>醚)>—R碳链编号时以母体官能团位次最低为原则,如3-戊烯-1-炔,4-戊酮醛二、特殊化合物命名及位次规则1.螺环化合物根据组成环的碳原子总数命名为“某烷”,加上词头“螺”。
大学有机化学复习有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOH3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e取代的椅式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e键上的椅式构象。
立体结构的标记方法1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z构型,在相反侧,为E构型。
CH3C CH C2H5CH3C CHC2H5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3CHCH3CH3C CHHCH3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把及手性碳相连的四个基团按次序规则排序。