中国药典2015版微生物检测所用菌种和培养基
- 格式:docx
- 大小:18.92 KB
- 文档页数:3



2015版中国药典微生物检查方法及培养基变更参照1.无菌检查法1.1变更内容1.1.1无菌检查方面,使用胰酪胨大豆肉汤(胰酪胨大豆液体培养基/大豆酪蛋白肉汤培养基)取代改良马丁培养基与硫乙醇酸盐流体培养基配合进行细菌和真菌的全面微生物检测。
1.1.2菌液制备环节,使用胰酪胨大豆肉汤、胰酪胨大豆琼脂取代营养肉汤、营养琼脂进行金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌和大肠埃希氏菌的菌液制备。
1.1.3菌液制备环节,使用沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基取代改良马丁培养基、改良马丁琼脂进行白色念珠菌和黑曲霉菌液的制备,同时对沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂的配方进行了变更。
1.1.4适用性试验中,胰酪胨大豆肉汤使用枯草芽孢杆菌、白色念珠菌和黑曲霉进行灵敏度检查;硫乙醇酸盐流体培养基使用金黄色葡萄球菌、大肠埃希氏菌、生孢梭菌、铜绿假单胞菌进行灵敏度检查。
1.2培养基信息2010版2015版无菌检查/菌液制备——硫乙醇酸盐流体培养基无菌检查/菌液制备——改良马丁培养基菌液制备——改良马丁琼脂培养基菌液制备——营养肉汤菌液制备——营养琼脂无菌检查——0.5%葡萄糖肉汤培养基供试品制备——0.1%蛋白胨水培养基无菌检查/菌液制备——硫乙醇酸盐流体培养基无菌检查/菌液制备——胰酪胨大豆肉汤菌液制备——胰酪胨大豆琼脂菌液制备——沙氏葡萄糖琼脂菌液制备——沙氏葡萄糖肉汤无菌检查——0.5%葡萄糖肉汤培养基供试品制备——0.1%蛋白胨水培养基供试品制备——pH7.0氯化钠—蛋白胨缓冲液1.3参考文件(国家药典委员会—中国药典2015版附录征求意见稿—1101无菌检查法)http://w w /cms/new scenter/new s/000603.html2.非无菌产品微生物限度检查2.1变更内容2.1.1供试品制备环节,除了pH7.0氯化钠—蛋白胨缓冲液、pH6.8磷酸盐缓冲液、pH7.6磷酸盐缓冲液外,添加了pH7.2磷酸盐缓冲液和胰酪胨大豆肉汤。

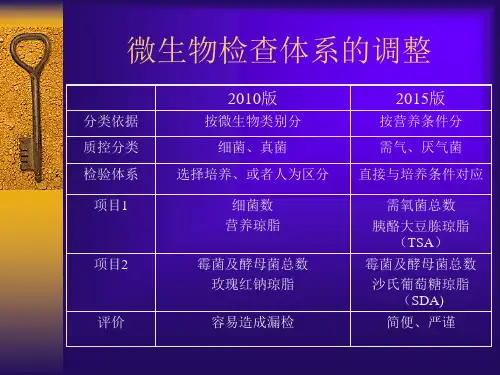
2015年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨2015年版《中国药典》将于2015年7月起开始实施:该版药典对微生物限度检查法检查时的洁净环境、培养基及检查方法进行了修订。
其中洁净环境要求由10000级背景下的100级单向流(2010年版)修订为受控背景下的不低于B 级环境(2015年版);计数培养基由营养琼脂/玫瑰红钠琼脂培养基(2010年版)修订为胰酪大豆琼脂培养基/沙氏葡萄糖琼脂培养基(2015年版)。
该文旨在分析2015年版中国药典与2010年版中国药典在非无菌产品微生物限度检查时洁净环境与计数培养基的异同点,为更规范执行2015年版中国药典提供参考。
标签:中国药典;2015年版;2010年版;洁净环境;培养基[Abstract] The Chinese Pharmacopoeia (2015 edition)will be implemented in July,2015 which have revised in some part,including clean environment and medium in microbial limit test. The clean environment was rectified from 10000 background plus 100 degree to control background plus A or B environment. The counting medium was changed from nutrient medium and rose bengal agar to trypticase soy agar (TSA)medium and sabouraud dextrose agar medium. In this part,we analyzed the differences of the clean environment and counting medium between 2010 and 2015 edition Chinese Pharmacopoeia for normative enforcement.[Key words] Chinese Pharmacopoeia;2010 edition;2015 edition;Clean environment;Medium微生物限度检查是用于检查非无菌制剂及其原料、辅料等是否符合规定的方法[1-2]。

抑菌效力检查法-2015中国药典录入时间:2014-9-16 9:44:02 来源:国家药典委员会抑菌剂是指抑制微生物生长的化学物质,有时也称防腐剂。
抑菌效力检查法系用于测定灭菌及非灭菌制剂的抑菌活性,以评价最终产品的抑菌效力,同时也可用于指导生产企业在研发阶段制剂中抑菌剂浓度的确定。
如果药物本身不具有充分的抗菌效力,那么应根据制剂特性(如水溶性制剂)添加适宜的抑菌剂,以防止制剂在正常贮藏或使用过程中可能发生的微生物污染和繁殖使药物变质而对使用者造成危害,尤其是多剂量包装的制剂。
在药品生产过程中,抑菌剂不能用于替代药品生产的GMP 管理,不能作为非无菌制剂降低微生物污染的唯一途径,也不能作为控制多剂量包装制剂灭菌前的生物负载的手段。
所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最低有效量。
同时,为保证用药安全,成品制剂中的抑菌剂有效浓度应低于对人体有害的浓度。
抑菌剂的抗菌效力在贮存过程中有可能因药物的成分或包装容器等因素影响而变化,因此,应验证成品制剂中的抑菌剂效力在效期内不因贮藏条件而降低.本试验方法和抑菌剂抑菌效力判断标准用于包装未启开的成品制剂培养基培养基的制备胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基?? 照无菌检查法(通则1101)制备。
培养基的适用性检查抑菌效力测定用培养基应进行培养基的适用性检查,包括成品培养基、由脱水培养基或按处方配制的培养基均应检查。
菌种试验所用的菌株传代次数不得超过5 代(从菌种保藏中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
培养基适用性检查的菌种及新鲜菌体培养见表1。
菌液制备取表1 大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物用pH7.0 无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。
取表2 黑曲霉的新鲜培养物加入3~5ml 含0.05%(ml/ml)聚山梨酯80 的pH7.0 无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。

青岛**有限公司文件目的建立微生物限度检查操作规程,规范操作,保证结果的准确性。
范围成品、辅料、内包装袋及纯化水的检验。
责任品管部微生物限度检验人员内容概述:本检验操作规程依据中国药典2015年版四部《通则1105 非无菌产品微生物限度检查:微生物计数法》和《通则1106 非无菌产品微生物限度检查:控制菌检查法》进行检查。
微生物计数法一、计数方法1.微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
2、计数方法本法包括平皿法、薄膜过滤法。
3、计数培养基适用性检查和供试品计数方法适用性检查供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确定采用的方法适合于该产品的微生物计数。
4、菌种及菌液的制备4.1试验用菌株的传代次数不得超过5代(从菌种保藏中心获得的干燥菌种为第0袋),并采用适宜的菌种保藏技术进行保藏。
计数培养基适用性检查和计数方法适用性试验见表1。
4.2菌液制备按表1规定培养各试验菌株。
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3-5ml含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。
采用适宜的方法吸出孢子悬液至无菌试管中,用含0.05%(ml/ml)聚山梨酯80的PH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢子悬液。
菌液制备后若在室温下放置,应在2小时内使用;若保存在2-8℃,可在24小时内使用。
黑曲霉孢子悬液可保存在2-8℃,在验证过的贮存期内使用。
表1 试验菌液的制备和使用4.3阴性对照为确认试验条件是否符合要求,应进行对照试验,阴性对照试验应无菌生长。
4.4培养基适用性检查按照表1规定,接种不大于100cfu的菌液至胰酪大豆胨液体培养基或胰酪大豆胨琼脂培养基平板或沙氏葡萄糖琼脂培养基平板,置规定的条件下培养。


霉菌与酵母菌总数、控制菌得检查。
二、引用标准:《中国药典》2015年版(通则1105-1106)三、目录1。
微生物限度标准2.设备、仪器及用具3。
消毒液、稀释剂、试液及培养基4。
检查总则(通则1105:非无菌产品微生物限度检查:微生物计数法,通则1106非无菌产品微生物限度检查:控制菌检查法)5。
微生物计数法检查6.控制菌检查法7.实验技术8、附件1.微生物限度标准非无菌药用原料及辅料得微生物限度标准(2).目测霉变者以不合格论。
(3)。
“无”为标准依据或无相应规定。
准依据或无相应规定.2.设施、仪器及用具2、1、设施:2、1、1.微生物限度检查室及相关设施:微生物计数试验环境应符合微生物限度检查得要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染得措施不得影响供试品中微生物得检出。
单向流空气区域、工作台面及环境应定期进行监测。
2、1、2.其她设备:高压蒸汽灭菌器;细菌培养箱(30~35℃);霉菌培养箱(25~28℃);电炉(或其她适宜得加热装置);恒温水浴;电热干燥箱(250~300℃);电冰箱。
生化试剂储存箱。
2、2仪器及器皿2、2、1。
菌落计数器;显微镜(1500X);电子天平或药物天平(感量0、1g);pH 系列比色计。
2、2、2.玻璃器皿:锥形瓶(250~300ml,内装玻璃珠若干)、研钵(玻璃或陶瓷制,∮10~12cm)、培养皿(∮9 cm)、量筒(100ml)、试管(18×180mm)及塞、吸管(1ml分度0、01,10ml分度0、1)、载玻片、盖玻片、玻璃消毒缸(带盖)。
2、2、3新购得玻璃器皿得清洁:先用流水冲洗,浸泡于1%~2%盐酸(工业用)液中约2~6小时,除去游离碱质,再用流水冲洗.用于化学分析得玻璃仪器,需用重铬酸钾清洁液浸泡数分钟后,再用流水冲洗,最后以纯化水涮洗2~3次,晾干备用。
2、3用过得玻璃器皿:2、3、1未被病原微生物污染得器皿:可随时洗涤.用清水冲洗(或浸泡),除容量仪器外,可用毛刷与肥皂粉,内外刷洗,再用清水涮洗干净,晾干备用.容量仪器宜用清洁液浸泡或涮洗,再用流水冲洗,最后以纯化水涮洗2~3次.试管及培养皿:先正放或直立于高压蒸汽灭菌器内,经121℃灭菌30 分钟.趁热倾出培养物,再以清水或用毛刷及肥皂粉刷洗,最后以流水涮净。
2015年版中国药典微生物限度检查方法验证方案人工牛黄甲硝唑胶囊微生物限度检查方法验证方案下表用于记录修订/变更主要内容及历史。
1. 概述2. 验证目的和范围3. 组织及职责4. 验证进度计划表5. 验证所需要的仪器设备及相关文件的确认6. 验证所需要的菌种、培养基、检验样品的确认 7.验证项目和验证方法 7.1试验菌株7.2需氧菌总数检查、霉菌和酵母菌总数检查方法验证的菌液制备 7.3需氧菌总数检查、霉菌和酵母菌总数检查方法验证--常规倾注平皿法 7.4需氧菌总数检查方法验证—离心沉淀-薄膜过滤法 7.5控制菌检查方法验证—离心沉淀-薄膜过滤法 8.偏差与漏项控制 9.验证报告会审1. 概述我公司生产品种人工牛黄甲硝唑胶囊,产品微生物限度检查项目为需氧菌总数、霉菌和酵母菌总数、以及大肠埃希菌检查和沙门菌检查。
参照《中国药典》2015版四部附录1105:微生物计数法,以及1106:控制菌检查法的规定,本公司对该产品的微生物限度检查方法予以验证。
通过验证以确认所采用的微生物限度检查方法适用。
人工牛黄甲硝唑胶囊处方中含有甲硝唑、人工牛黄以及常用辅料成分,文献资料介绍甲硝唑对细菌有抑菌特性,对霉菌和酵母菌无抑菌活性。
甲硝唑在水中微溶,可以通过离心沉淀-薄膜过滤法去除其对微生物生长的影响。
本验证方案通过试验菌株的回收率测试,首先确认常规倾注平皿法是否适用于本品的微生物限度检查;如常规倾注平皿法不适用,则进一步验证可去除供试品抑菌物质的离心沉淀-薄膜过滤法是否适用于本品的微生物限度检查。
本验证方案根据样品特性制定微生物限度检查方法和检验条件,按制定的方法进行试验,根据验证结果判断是否符合验证标准。
2. 验证目的和范围验证该产品的微生物限度检查方法的适用性,对其有效性进行评价,保证检验结果的可靠性。
本验证方案采用3批按GMP要求组织生产的人工牛黄甲硝唑胶囊,进行微生物限度检查方法的验证。
3.组织及职责3.1验证方案和验证报告的起草、审核、批准验证方案由质量部QC组负责起草,由质量部审核,最终由质量负责人批准。
通则1106 非无菌产品微生物限度检查:控制菌检查法控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
当本法用于检查非无菌制剂及其原、辅料等是否符合相应的微生物限度标准时,应按下列规定进行检验,包括样品取样量和结果判断等。
供试品检出控制菌或其他致病菌时,按一次检出结果为准,不再复试。
供试液制备及实验环境要求同“非无菌产品微生物限度检查:微生物计数法”。
如果供试品具有抗菌活性,应尽可能去除或中和。
供试品检查时, 若使用了中和剂或灭活剂,应确认有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
培养基适用性检查和控制菌检查方法适用性试验供试品控制菌检查中所使用的培养基应进行适用性检查。
供试品的控制菌检查方法应进行方法适用性试验,以确认所采用的方法适合于该产品的控制菌检查。
若检验程序或产品发生变化可能影响检验结果时,控制菌检查方法应重新进行适用性试验。
菌种及菌液制备菌种试验用菌株的传代次数不得超过5 代(从菌种保藏中心获得的干燥菌种为第0 代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕乙型副伤寒沙门菌(Salmonellaparatyphi B)〔CMCC(B)50 094〕白色念珠菌(Candida albicans)〔CMCC(F)98 001〕生孢梭菌(Clostridium sporogenes)〔CMCC(B)64 941〕菌液制备将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门菌分别接种于胰酪大豆胨液体培养基中或在胰酪大豆胨琼脂培养基上,30~35℃培养18~24 小时;将白色念珠菌接种于沙氏葡萄糖琼脂培养基上或沙氏葡萄糖液体培养基中,20~25℃培养2~3 天;将生孢梭菌接种于梭菌增菌培养基中置厌氧条件下30~35℃培养24~48 小时或接种于硫乙醇酸盐流体培养基中30~35℃培养18~24 小时。
中国药典2015版⽆菌检查⽅法适⽤性试验(直接接种法)*********公司*********产品⽆菌检查⽅法适⽤性试验1、样品信息2、培养基及试剂3、菌种基本信息:4、菌液制备:2.1接种⾦黄⾊葡萄球菌、⼤肠埃希菌、枯草芽孢杆菌的新鲜培养物⾄胰酪⼤⾖胨培养基中或胰酪⼤⾖胨脂培养基上,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.2接种⽣孢梭菌的新鲜培养物⾄硫⼄醇酸盐流体培养基中,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.3接种⽩⾊念珠菌的新鲜培养物⾄沙⽒葡萄糖液体培养基或沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养24~48⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml 含菌数⼩于100cfu的菌悬液。
2.4接种⿊曲霉菌的新鲜培养物接种⾄沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养5~7天,加⼊3~5ml含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液,将孢⼦洗脱。
然后,采⽤适宜的⽅法吸出孢⼦悬液⾄⽆菌试管内,⽤含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌孢⼦悬液。
6、⽆菌检查直接接种法⽅法适⽤性试验6.1供试品制备:描述供试品制备过程(主要为每个样品的取样部位及⽤量)。
6.2试验组:取装量为 ml硫⼄醇酸盐流体培养基,接种规定的供试品量(同6.1),并接种⼩于100cfu的⾦黄⾊葡萄球菌;⼤肠埃希菌、⽣孢梭菌、枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉按照上述步骤操作,其中⼤肠埃希菌、⽣孢梭菌加⼊硫⼄醇酸盐流体培养基,枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉加⼊胰酪⼤⾖胨液体培养基。
6.3对照组:取装量为 ml硫⼄醇酸盐流体培养基3管,分别接种⼩于100cfu的⾦黄⾊葡萄球菌、⼤肠埃希菌、⽣孢梭菌;取相同装量的胰酪⼤⾖胨培养基3管,分别接种⼩于100cfu枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉。