定量实验的设计与评价
- 格式:ppt
- 大小:328.50 KB
- 文档页数:8

定量分析化学教案一、教学目标1. 知识与技能:(1)掌握定量分析化学的基本概念、原理和方法。
(2)学会使用常见的定量分析仪器和设备。
(3)了解定量分析化学在实际应用中的重要性。
2. 过程与方法:(1)通过实验和实践,掌握溶液的配制、滴定、光谱分析等基本操作。
(2)培养学生的实验操作能力和数据处理能力。
(3)学会运用定量分析方法解决实际问题。
3. 情感态度与价值观:(1)培养学生对定量分析化学的兴趣和好奇心。
(2)认识定量分析化学在科学研究和生产实践中的重要作用。
(3)培养学生严谨的科学态度和团队协作精神。
二、教学内容1. 定量分析化学的基本概念(1)定量分析化学的定义(2)定量分析方法分类(3)定量分析化学的发展趋势2. 定量分析仪器与设备(1)滴定仪器的构造及使用方法(2)分光光度计的原理及操作(3)其他常用定量分析仪器简介3. 溶液的配制与稀释(1)溶液的配制方法(2)溶液的稀释计算(3)溶液的浓度测定与误差分析三、教学重点与难点1. 教学重点:(1)定量分析化学的基本概念与方法。
(2)常见定量分析仪器的使用与维护。
(3)溶液的配制、稀释和浓度测定。
2. 教学难点:(1)定量分析方法的原理与选择。
(2)实验数据的处理与分析。
(3)溶液配制和稀释过程中的误差控制。
四、教学策略与方法1. 采用讲授与实验相结合的教学方法,让学生在理论指导下进行实践操作。
2. 利用多媒体课件辅助教学,增强学生对定量分析化学的理解。
3. 开展小组讨论和实验操作竞赛,激发学生的学习兴趣和团队协作精神。
4. 注重培养学生实验操作能力和数据处理能力,提高学生的综合素质。
五、教学评价1. 平时成绩:包括课堂表现、作业完成情况和小测验成绩。
2. 实验报告:评价学生在实验操作、数据处理和问题分析等方面的能力。
3. 期末考试:考察学生对定量分析化学基本概念、原理和方法的掌握程度。
六、教学活动与课时安排1. 课时:本课程共32课时,包括16次课堂讲授和16次实验操作。
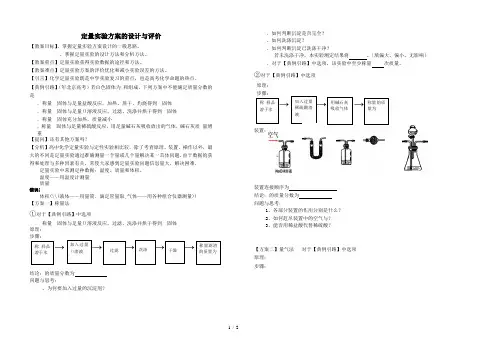
定量实验方案的设计与评价【教案目标】、掌握定量实验方案设计的一般思路。
、掌握定量实验的设计方法和分析方法。
【教案重点】定量实验获得实验数据的途径和方法。
【教案难点】定量实验方案的评价优化和减小实验误差的方法。
【引言】化学定量实验既是中学实验复习的重点,也是高考化学命题的热点。
【典例引路】(年北京高考)若白色固体为和组成,下列方案中不能确定质量分数的是.称量固体与足量盐酸反应,加热、蒸干、灼烧得到固体.称量固体与足量()溶液反应,过滤、洗涤并烘干得到固体.称量固体充分加热,质量减小.称量固体与足量稀硫酸反应,用足量碱石灰吸收放出的气体,碱石灰质量增重【提问】还有其他方案吗?【分析】高中化学定量实验与定性实验相比较,除了考查原理、装置、操作以外,最大的不同是定量实验通过准确测量一个量或几个量解决某一具体问题,由于数据的获得和处理与多种因素有关,常使大家感到定量实验问题信息量大,解决困难。
定量实验中常测定种数据:温度、质量和体积。
温度——用温度计测量质量错误!体积(\\(液体——用量筒、滴定管量取,气体——用各种组合仪器测量))【方案一】称量法①对于【典例引路】中选项称量固体与足量()溶液反应,过滤、洗涤并烘干得到固体原理:步骤:→→→→→→结论:的质量分数为问题与思考:、为何要加入过量的沉淀剂?、如何判断沉淀是否完全?、如何洗涤沉淀?、如何判断沉淀已洗涤干净?若未洗涤干净,本实验测定结果将。
(填偏大、偏小、无影响)、对于【典例引路】中选项,该实验中至少称量次质量。
②对于【典例引路】中选项原理:步骤:→→→装置:装置连接顺序为结论:的质量分数为问题与思考:1、各部分装置的作用分别是什么?2、如何赶尽装置中的空气与?3、能否用稀盐酸代替稀硫酸?【方案二】量气法对于【典例引路】中选项原理:步骤:称样品溶于水加入过量()溶液过滤洗涤干燥称量滤渣的质量为称样品溶于水加入过量稀硫酸溶液用碱石灰吸收气体称量的质量为装置:结论:的质量分数为 问题与思考:、为了测量结果准确,中溶液应采用读数时应注意: 、若读数时,装置中液面如图所示,所测结 果 (填偏大、偏小、无影响)、如何改进装置,减小中滴加硫酸体积而引起的 误差?、常用的量气装置有哪些?【方案三】滴定法 对于【典例引路】中选项 原理: 步骤:→ → → →装置:结论:的质量分数为问题与思考:、判断到达滴定终点的实验现象是 。



【巩固练习】1.已知某纯碱样品中含有NaCl杂质,为测定样品中纯碱的质量分数,甲同学用右图装置及试剂进行实验(夹持仪器略)。
(1)仪器A、B 的名称分别是、。
(2)甲同学按实验正常操作的主要步骤如下:②将a g试样放入仪器B中,加适量蒸馏水溶解,得到样品溶液;③称量盛有碱石灰的干燥管的质量为b g;④从仪器A中滴入浓盐酸,直到不再产生气体时为止;⑤再次称量盛有碱石灰的干燥管的质量为c g;(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是(用含a、b、c的式子表示)(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因是:(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择仪器并完成下表:(用大写字母代表仪器,仪器可重复使用,夹持仪器略)选用的仪器添加的药品(必要的操作)2.实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。
回答以下问题:⑴化学小组主要选用了下列药品和仪器进行实验。
(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)a→→→→→ f →g → →。
⑵实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是。
⑶E装置的作用是。
⑷实验中,若C瓶中溶液褪色,则测定结果可能会偏(填“高”或“低”)。
为了确保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前E中所装a mol·L-1的KMnO4溶液体积(V)不少于mL。
⑸若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为。

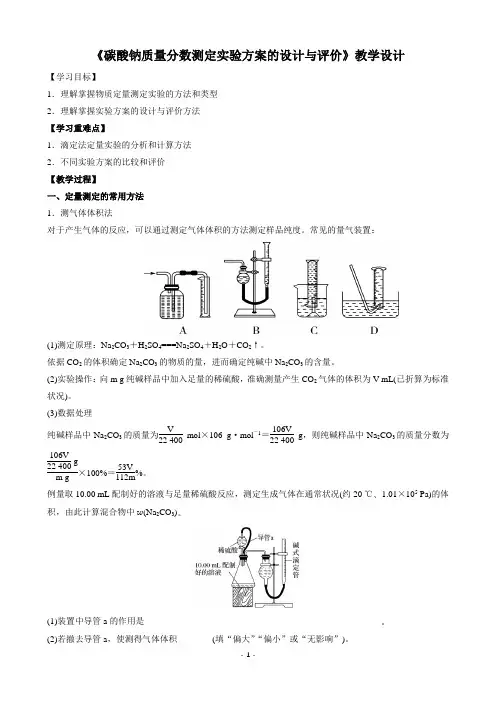
《碳酸钠质量分数测定实验方案的设计与评价》教学设计【学习目标】1.理解掌握物质定量测定实验的方法和类型2.理解掌握实验方案的设计与评价方法【学习重难点】1.滴定法定量实验的分析和计算方法2.不同实验方案的比较和评价【教学过程】一、定量测定的常用方法1.测气体体积法对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
常见的量气装置:(1)测定原理:Na 2CO 3+H 2SO 4===Na 2SO 4+H 2O +CO 2↑。
依据CO 2的体积确定Na 2CO 3的物质的量,进而确定纯碱中Na 2CO 3的含量。
(2)实验操作:向m g 纯碱样品中加入足量的稀硫酸,准确测量产生CO 2气体的体积为V mL(已折算为标准状况)。
(3)数据处理纯碱样品中Na 2CO 3的质量为V 22 400 mol ×106 g ·mol -1=106V 22 400g ,则纯碱样品中Na 2CO 3的质量分数为106V 22 400 g m g ×100%=53V 112m%。
例量取10.00 mL 配制好的溶液与足量稀硫酸反应,测定生成气体在通常状况(约20 ℃、1.01×105 Pa)的体积,由此计算混合物中w (Na 2CO 3)。
(1)装置中导管a 的作用是______________________________________________________。
(2)若撤去导管a ,使测得气体体积________(填“偏大”“偏小”或“无影响”)。
2.测气体质量法将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
常见的气体吸收装置:3.沉淀法先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。
(1)测定原理:Na2CO3+BaCl2===BaCO3↓+2NaCl。
依据BaCO3沉淀的质量,确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。




定量实验设计与评价编稿:房鑫审稿:于冬梅【高考展望】一、考纲要求1.能根据实验试题要求,做到:〔1〕设计、评价或改良实验方案;〔2〕理解控制实验条件的方法;〔3〕分析或处理实验数据,得出合理结论;〔4〕绘制和识别典型的实验仪器装置图。
2.以上各局部知识与技能的综合应用。
二、高考动向新课程背景下的高考化学实验试题非常重视将定性实验和定量实验进展有机结合,试题中所设计的问题多为实验的根本操作知识及实验原理的分析、实验数据的处理和对实验流程的推理,旨在对学生实验根本素养和分析处理数据才能的考察。
本节主要涉及定量实验设计与评价。
【方法点拨】定量实验方案的设计的一般要求①根据题目要求设计定量实验的测定原理,如混合物组成测定的一般设计思路是使其中一种组分发生化学反响生成气体或沉淀,通过测定气体或固体的量进而求得各组分的含量。
②定量实验的关键是保证数据的准确性,因此确定了某一详细实验方案后,应注意在实验中保证所测数据是准确的:如除杂、数据的重复测定等特征设计,还要排除此方案中所有干扰因素,干扰因素全部排除了,此方案详细的施行程序就明晰且明确了。
因此教学中要尽量创造条件,让学生动手多做实验,让学生自选课题、设计实验、改良或创新实验,并对实验进展评价和分析,培养学生的创新意识的创新精神,训练学生用实验解决化学问题,使学生掌握评价实验方案的常见角度和方法。
总之,新课程理念下的高三化学复习备考应注重近年来高考实验试题考察的动向进展研究,从试题中去领略试题考察的意图和试题命制方向,从而在教学中有目的性地培养学生的实验创新意识和实验探究才能,真正做到有的放矢,进步实验备考复习效率。
【典型例题】类型一、混合物中某物质含量的测定例1.某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用以下图中的装置进展实验。
主要实验步骤如下:①按图组装仪器,并检查装置的气密性②将ag试样放人入锥形瓶中,加适量蒸馏水溶解,得到试样溶液③称量盛有碱石灰的U 型管的质量,得到bg④从分液漏斗滴人6mo1·L -1的硫酸,直到不再产生气体时为止⑤从导管A 处缓缓鼓入一定量的空气⑥再次称量盛有碱石灰的U 型管的质量,得到cg⑦重复步骤⑤和⑥的操作,直到U 型管的质量根本不变,为dg请填空和答复以下问题:(1)在用托盘天平称量样品时,假如天平的指针向左偏转,说明______________________(2)装置中枯燥管B 的作用是___________________________________(3)假如将分液漏斗中的硫酸换成浓度一样的盐酸,测试的结果__________ (填偏高、偏低或不变)(4)步骤⑤的目的是____________________________(5)步骤⑦的目的是________________________________(6)该试样中纯碱的质量分数的计算式为______________________________(7)还可以用其他实验方法测定试样中纯碱的质量分数。
定量分析化学教案一、教学目标1. 知识与技能:(1)理解定量分析的基本概念和原理;(2)掌握常用的定量分析方法,如滴定法、原子吸收光谱法、X射线荧光光谱法等;(3)学会进行定量分析实验操作,并能正确处理实验数据。
2. 过程与方法:(1)通过实验和案例分析,培养学生的实验操作能力和实验观察能力;(2)通过小组讨论和问题解答,培养学生的合作能力和解决问题的能力。
3. 情感态度与价值观:(1)培养学生对科学探究的兴趣和热情;(2)培养学生诚实守信、严谨治学的科学态度。
二、教学内容1. 定量分析的基本概念和原理(1)定量分析的定义;(2)定量分析的方法和分类;(3)定量分析的基本原理。
2. 常用的定量分析方法(1)滴定法;(2)原子吸收光谱法;(3)X射线荧光光谱法。
三、教学重点与难点1. 教学重点:(1)定量分析的基本概念和原理;(2)常用的定量分析方法。
2. 教学难点:(1)定量分析的原理和实验操作;(2)不同定量分析方法的适用范围和优缺点。
四、教学方法1. 讲授法:讲解定量分析的基本概念、原理和方法;2. 实验法:进行定量分析实验操作,培养学生的实验能力;3. 小组讨论法:讨论定量分析实验中遇到的问题和解决方法。
五、教学准备1. 教学材料:教材、实验仪器和试剂;2. 教学设施:实验室、多媒体设备。
教案内容请根据实际教学需求进行调整和补充。
六、教学步骤1. 导入:通过引入实际案例,激发学生对定量分析化学的兴趣,引导学生思考定量分析在实际应用中的重要性。
2. 教学内容讲解:(1)讲解定量分析的基本概念和原理,如定量分析的定义、分类和基本原理;(2)介绍常用的定量分析方法,如滴定法、原子吸收光谱法和X射线荧光光谱法,并分析它们的适用范围和优缺点。
3. 实验操作:组织学生进行定量分析实验,指导学生进行实验操作,如仪器的使用、试剂的配制和滴定等,并强调实验注意事项。
4. 数据处理与分析:教授学生如何正确处理实验数据,包括数据的记录、计算和误差分析,培养学生的实验观察能力和数据分析能力。
核心素养测评(三十八) 定性、定量实验的设计与评价1.(2021·福建三明市高三期末)某学习小组用如图装置探究NH4Cl与CuO的反应。
查阅资料:ⅰ.[Cu(NH3)4]Cl2溶液中存在平衡:[Cu(NH3)4]2+Cu2++4NH3ⅱ.相关物质的性质物质固体颜色水溶液颜色CuCl2棕色蓝绿色[Cu(NH3)4]Cl2深蓝色深蓝色CuCl 白色不溶于水(1)实验Ⅰ:如图1,一段时间后,固体部分溶解,固体表面无颜色变化,溶液变为蓝色。
固体溶解的原因是__________________。
(2)实验Ⅱ:如图2,将铜丝加热变黑后迅速插入疏松的氯化铵固体中,有白烟生成,2分钟后取出铜丝,黑色消失变回红色。
①已知氯化铵与氧化铜反应生成两种单质,其中一种为无色气体,写出该反应的化学方程式________________________________。
②若将氯化铵换为硫酸铵,观察不到上述现象,原因是_______________________。
(3)实验Ⅲ:如图3,加热试管,管内产生白烟,黑色混合物熔化、流动,持续加热15分钟,原黑色固体混合物变为暗红色。
取暗红色固体进行下列实验:序号加入试剂现象ⅰ水产生白色沉淀,一段时间后沉淀的颜色转变为蓝色、绿色、蓝绿色等ⅱ浓硝酸激烈反应,产生大量红棕色气体,溶液变为深蓝绿色根据现象推测白色沉淀可能是________(填化学式),该物质与浓硝酸反应的离子方程式为____________________________________。
(4)实验Ⅰ、Ⅱ、Ⅲ现象不同的可能原因是_________________________________________________________________________________________________________。
(写2点) 解析:(1)实验Ⅰ中,NH4Cl溶于水后,部分发生水解生成盐酸等,盐酸与CuO反应生成CuCl2和水,溶液变为蓝色;固体溶解的原因是氯化铵溶液呈酸性。