燃烧理论复习
- 格式:doc
- 大小:20.21 KB
- 文档页数:3
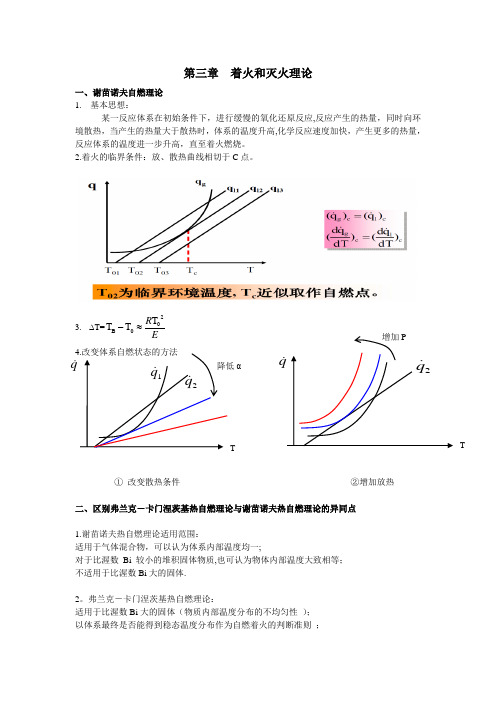
第三章 着火和灭火理论一、谢苗诺夫自燃理论 1. 基本思想:某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生的热量,同时向环境散热,当产生的热量大于散热时,体系的温度升高,化学反应速度加快,产生更多的热量,反应体系的温度进一步升高,直至着火燃烧。
2.着火的临界条件:放、散热曲线相切于C 点。
3.∆T=ER 20B T T T ≈-① 改变散热条件 ②增加放热二、区别弗兰克-卡门涅茨基热自燃理论与谢苗诺夫热自燃理论的异同点1.谢苗诺夫热自燃理论适用范围:适用于气体混合物,可以认为体系内部温度均一;对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等; 不适用于比渥数Bi 大的固体.2。
弗兰克-卡门涅茨基热自燃理论:适用于比渥数Bi 大的固体(物质内部温度分布的不均匀性 ); 以体系最终是否能得到稳态温度分布作为自燃着火的判断准则 ;Tq αT自燃临界准则参数 δcr 取决于体系的几何形状。
三、链锁自然理论 1。
反应速率与时间的关系 2.运用链锁自燃理论解释着火半岛现象 在第一、二极限之间的爆炸区内有一点P(1)保持系统温度不变而降低压力,P 点则向下垂直移动自由基器壁消毁速度加快,当压力下降到某一数值后,f < g, φ < 0 -—-------———-—--—--——-第一极限(2)保持系统温度不变而升高压力,P 点则向上垂直移动自由基气相消毁速度加快,当压力身高到某一数值后,f 〈 g , φ 〈 0 —-——-——-——————-—-—-———第二极限(3)压力再增高,又会发生新的链锁反应导致自由基增长速度增大,于是又能发生爆炸。
---3.基于f (链传递过程中链分支引起的自由基增长速率)和g (链终止过程中自由基的消毁w0w123M HO M O H +→++⋅22⋅⋅+→+OH O H H HO 222速率 )分析链锁自燃着火条件a.在低温时, f 较小(受温度影响较大),相比而言,g 显得较大,故:这表明,在 的情况下,自由基数目不能积累,反应速率不会自动加速,反应速率随着时间的增加只能趋势某一微小的定值,因此,f<g系统不会着火。


第一章燃烧化学反应动力学基础1、什么叫燃烧?2、浓度和化学反应速度正确的表达方法?化学反应速度如何计量?3、什么是单相反应、多相反应、简单反应、复杂反应、总包反应?4、质量作用定律的适用范围?如何从微观的分子运动论的观点来理解质量作用定律?试用质量作用定律讨论物质浓度对反应速度的影响。
5、什么是反应级数?反应级数与反应物浓度(半衰期)之间的关系如何?6、常用的固体、液体和气体燃料的反应级数值的范围是多少?7、试用反应级数的概念,讨论燃尽时间与压力之间的关系。
8、惰性组分如何影响化学反应速率?9、Arrhenius定律的内容是什么?适用范围?如何从微观的分子运动论的观点来理解Arrhenius定律?10、什么是活化能?什么是活化分子?它们在燃烧过程中的作用?11、图解吸热反应和放热反应的活化能与反应放热(吸热)之间的关系。
12、什么叫链式反应?它是怎样分类的?链反应一般可以分为几个阶段?13、描述氢原子燃烧的链式反应过程。
14、试用活化中心繁殖速率和销毁速率的数学模型,结合编程技术,绘制氢原子浓度随时间变化的图线,解释氢燃烧的几种反应的情况。
并讨论:分支链反应为什么能极大地增加化学反应的速度?15、烃类燃烧的基本过程是什么,什么情况下会发生析碳反应?如何进行解释?什么样的烃类燃烧时更容易发生析碳反应?如何防止烃类燃烧析碳?16、图解催化剂对化学反应的作用。
17、什么叫化学平衡?平衡常数的计算方法?吕·查德里反抗规则的内容是什么?18、什么是燃料的低位发热量和高位发热量?19、试用本章的知识解释,从燃烧学的角度来看,涡轮增压装置对汽车发动机的作用是什么?20、过量空气系数(a)与当量比(b)的概念?21、燃烧过程中,有几种NOx的生成机理?第二章燃烧空气动力学基础——混合与传质1.为什么说混合与传质对燃烧过程很重要?2.什么是传质?传质的两种基本形式是什么?3.什么是“三传”?分子传输定律是怎样表述的?它们的表达式如何?(牛顿粘性定律、傅立叶导热定律、费克扩散定律)4.湍流中,决定“三传”的因素是什么?湍流中,动量交换过程和热量、质量交换的强烈程度如何?怎么用无量纲准则数的数值来说明这一点?5.试推导一个静止圆球在无限大空间之中,没有相对运动的情况下,和周围气体换热的Nu数,以及和周围气体进行传质的Nu zl数。


燃烧与爆炸理论复习题名词:1. 爆炸的超压——冲量破坏准则 P155超压——冲量准则综合考虑了超压和冲量两个方面,如果超压和冲量的共同作用满足某一临界条件,目标就破坏。
超压——冲量准则可用公式表示。
()()C I I p p crcr=--∆式中 p ∆——超压,Mpa ;cr p ——临界超压,Mpa ;I ——冲量,s Pa ⋅;cr I ——临界比冲量;C ——常数。
2. 闪点 P13在一定温度下,可燃性液体(包括少量可熔化的固体,如萘、樟脑、硫黄、石蜡、沥青等)蒸气与空气混合后,达到一定浓度时,遇点火源产生的一闪即灭的燃烧现象,叫做闪燃。
液体(和少量固体)产生闪燃现象的最低温度,称为闪点。
3. 殉爆当炸药(主发药包)发生爆炸时,由于爆轰波的作用引起相隔一定距离的另一炸药(被发药包)爆炸的现象。
换言之,即装药的爆炸能引起与其相距一定距离的被惰性介质隔离的装药的爆炸,这一现象叫做殉爆。
4. 自热自燃 P13某些物质在没有外来热源影响下,由于物质内部所发生的化学、物理或生化过程而产生热量,这些热量在适当条件下会逐渐积聚,使物质温度上升,达到自燃点而燃烧,这种现象称为自热自燃。
5. 氧指数 P66 所谓氧指数(OI ),是指在规定的试验条件下,试样在氧、氮混合气流中,维持平稳燃烧(即进行有烟燃烧)所需的最低氧气体积分数,以氧所占的体积分数的数值表示(即在该物质点燃后,能保持燃烧50mm 长或燃烧时间3min 时所需要的氧、氮混合气体中最低氧的体积分数)6. 消焰距离 P69消焰距离就是指火焰蔓延不下去的最大通道尺寸。
7. 最低点火能 P67最低点火能(MIE )是指在规定的试验条件下,能使爆炸性混合物燃爆所需最小电火花的能量。
如果点火源的能量低于这个临界值,一般不会着火。
8. 热辐射的通量——强度破坏准则 P149 热通量-热强度准则:当热通量准则或热强度准则的适用条件均不具备时、应该使用热通量-热强度准则。

《燃烧学》考研复习大纲1教材《燃烧学》,哈尔滨工业大学主编(内部教材)2课程学习目的和基本要求2.1学习目的燃烧学是动力工程和工程热物理学科的二级学科之一。
主要研究各类强烈放热反应,即燃烧反应过程中的流动、传热、传质和化学反应,及其相互作用的综合现象。
学习目的是为了了解燃烧现象的本质、主要影响因素,过程的发展变化规律,能够利用理论知识掌握气体燃料、液体燃料、固体燃料燃烧过程的原理和研究方法。
2.2基本要求(1)能够从理论上准确地认识燃烧现象,了解燃烧过程发生、发展的规律。
(2)掌握对燃烧过程进行理论分析的基本方法,以及对物理过程进行数学处理的基本方法。
(3)学会研究燃烧过程的一些基本实验方法,能够初步利用一些经典实验手段研究燃烧过程。
(4)了解燃烧理论和燃烧研究方法的新发展。
3复习内容3.1燃料(1)主要化石燃料的元素分析及其性质(2)煤的工业分析及其性质(3)煤的分类:动力用煤分类,工业锅炉用煤分类(4)气体和液体燃料的种类、成份和性质3.2燃烧化学基础(1)化学热力学基础:生成焓,反应焓,自由能,燃烧热,理论燃烧温度(2)化学动力学基础:基元反应,质量作用定律,阿累尼乌斯定律,反应级数,一级反应和二级反应特点,化学平衡,总包化学反应分类和特点(3)链式反应:分支链反应,直链反应3.3燃烧物理学基础(1)传质学基础:费克扩散定律,直角坐标系传质学方程(2)流体力学基础:直流自由射流,旋转射流,直流交叉射流基本概念和特性(3)气固两相流动基础3.4气体燃料的燃烧(1)预混可燃气的着火和自燃理论:绝热条件下和非绝热条件下非稳态着火自燃理论(2)预混可燃气体的点燃理论:无穷大平板点燃理论——零值梯度理论(3)层流火焰传播:火焰传播速度概念和理论(4)湍流火焰传播:湍流火焰传播模型分类和主要特点(5)扩散火焰:扩散火焰的概念和基本理论(6)射流火焰:自由射流、旋转射流和直流交叉射流火焰的特点(7)火焰的稳定性:工业火焰稳定的基本原理和方法3.5液体燃料的燃烧(1)液体燃料燃烧的特点(2)斯蒂芬流(3)液滴蒸发理论(4)液滴燃烧理论(5)液雾燃烧理论基础(6)液体燃料燃烧组织3.6固体燃料的燃烧理论(1)煤的热解过程分类及其特点(2)碳的燃烧化学反应:碳燃烧的异相化学反应理论,扩散燃烧区、动力燃烧区和过渡燃烧区理论(3)碳球燃烧速度和燃尽时间:纯碳球化学反应速度和燃尽时间理论(4)煤粒燃烧过程:含灰碳球燃烧速度和燃尽时间理论(5)煤粉气流的燃烧过程:煤粉燃烧特点,煤粉燃烧组织理论基础3.7燃烧污染物的生成和控制(1)燃烧污染物组成和特点(2)NOx生成机理和控制(3)SOx生成机理和控制。
平均有效压力Pme。
假想的平均不变的压力作用在活塞顶上使活塞移动一个行程所做的功等于每循环所做的有效功。
指示热效率ηit。
发动机实际循环指示功与所消耗燃料热量的比值。
充量系数Φc。
内燃机每循环实际进入气缸的新鲜充量与以进气管内状态充满气缸的工作容积的理论充量之比。
滞燃期。
指柴油机从开始喷油到开始着火的阶段。
喷油规律。
在喷油过程中,单位曲轴转角或单位时间内从喷油器喷入气缸中的燃油量。
放热规律。
燃料燃烧的瞬时放热率随曲轴转角的变化关系。
供油规律。
单位曲轴转角或单位时间内喷油泵供入高压油路的燃油流量。
充气效率。
实际进入气缸的新鲜工质与进气下整个气缸充满新鲜工质质量之比。
点火提前角特性曲线。
在气我机。
保持节气门开度,转速以及混合气浓度一定,记录功率排气温度随点火提前角变化曲线。
喷油泵速度特性。
喷油泵在流量调节齿杆位置不变,每循环喷油量随油泵转速变化的特性。
喷油泵调速特性。
柴油机调速器调速手柄位置一定。
喷油泵的循环供油量或拉杆位移随转速的变化关系。
负荷特性。
发动机转速不变,性能指标随负荷变化关系。
速度特性。
在油量调节机构位置保持不变。
内燃机性能指标随转速变化关系。
万有特性曲线。
在一张图上较全面地表示内燃机各种性能参数的变化,应用多参数特性曲线。
转矩储备系数。
最大转距与标定转距之差与标定转距的相对值。
MAP图。
通过大量标定实验,获得喷油参数与综合目标控制之间的关系曲线图形。
功率标定。
生产者根据内燃机用途规定该机在标准大气条件下输出有效功率及对应转速,即额定功率与额定转速。
理想的喷油规律。
初期缓慢,中期急速,后期快断。
初期喷油速率不能太高,目的是减少在滞燃期内形成的可燃混合气数量,降低初期燃烧速率,以降低最高燃烧温度和压力升高率,从而抑制NOx的生成量以及降低燃烧噪声。
喷油中期应采用高喷油压力和高喷油速率以提高扩散燃烧速度,防止生成大量的PM和降低热效率。
喷射后期要迅速结束喷射,以避免在低的喷油压力和喷油速率下使燃油雾化变差,导致燃烧不完全而使HC和PM的排放量增加。
绪论、第一章1、从正负两方面论述研究燃烧的意义。
(P5)①研究如何提高燃烧效率,保证燃烧过程的稳定性和安全性,节约能源,并充分利用新能源;②如何防止抑制火灾及矿井瓦斯或具有粉尘工厂存在的爆炸危险性,减少有用燃烧过程中的工业污染问题。
2、不同的学科研究燃烧学各有什么侧重点?(P5)实验研究:对于生产中提出的燃烧技术问题主要还只能通过实验来解决。
并发展出诊断燃烧学。
理论分析:主要为各种燃烧过程的基本现象建立和提供一般性的物理概念,从物理本质上对各种影响因素做出定性分析,从而对实验研究和数据处理指出合理、正确的方向。
3、从化学观点看,燃烧反应具有的特征是什么?(物质能量总体是下降的)(P6)氧化剂和燃料的分子间进行着激烈的快速化学反应,原来的分子结构被破坏,原子的外层电子重新组合,经过一系列中间产物的变化,最后生成最终燃烧产物。
这一过程,物质总的热量是降低的,降低的能量大都以热和光的形式释放而形成火焰。
4、燃烧过程的外部特征是什么?①剧烈的氧化还原反应②放出大量的热③发光5、化学爆炸与火灾的关系?(PPT)1)紧密联系,相伴发生2)某些物质的火灾和爆炸具有相同的本质,都是可燃物与氧化剂的化学反应。
3)主要区别:燃烧是稳定的和连续进行的,能量的释放比较缓慢,而爆炸是瞬时完成的,可在瞬间突然释放大量能量。
4)同一物质在一种条件下可以燃烧,在另一种条件下可以爆炸。
(煤块燃烧与煤粉爆炸)5)在存放有易燃易爆物品较多的场合和某些生产过程中,可发生火灾爆炸的连锁反应,先爆炸后燃烧、先燃烧后爆炸。
6、按化学反应和物理过程之间的关系,燃烧包括哪三种类型?(P5)1)动力燃烧(动力火焰):主要受燃烧过程中的化学动力因素所控制,如着火、爆炸;2)扩散燃烧(扩散火焰):主要受流动、扩散和物理混合等因素控制,如液体燃料滴、碳粒、蜡烛;3)预混燃烧(预混火焰):此时化学动力因素和物理混合因素差不多起同样重要的作用,如汽油发动机、家用煤气炉。
燃烧理论复习
一、复习提纲
1.计算燃烧学对燃烧理论研究的意义
2.燃气的高低热值
3.如何得到混合气体的热值
4.理论空气需要量
5.过剩空气系数
6.热量计温度
7.燃烧热量温度
8.理论燃烧温度
9.实际燃烧温度
10.影响燃烧温度的因素
11.理论烟气量
12.烟气中各种成分的函数关系
13.烟气的焓
14.化学反应速率
15.放热反应与吸热反应
16.质量作用定律
17.一级反应
18.二级反应
19.半衰期
20.对行反应
21.平行反应
22.连续反应
23.活化能
24.热效应
25.活化中心
26.支链反应
27.支链反应历程
28.自然着火
29.强制着火、点火
30.灼热固体颗粒点燃可燃混合物的临界条件
31.热力着火
32.热力着火的渠道
33.支链着火
34.支链着火的压力下限和上限
35.着火半岛
36.着火感应期
37.最小点火能
38.熄火距离
39.层流(湍流)火焰传播速度
40.影响火焰传播速度的因素
41.层流火焰传播速度测定方法
42.火焰传播浓度上限和下限
43.自由射流
44.层流自由射流结构
45.湍流自由射流规律
46.绝对(相对)穿透深度
47.射程
48.旋转射流规律
49.旋流数
50.扩散式燃烧
51.扩散火焰高度
52.碳氢化合物扩散燃烧时的多相过程
53.大气式燃烧
54.部分预混燃烧中影响火焰稳定的因素
55.周边速度梯度理论
56.火焰拉伸理论
57.完全预混燃烧
58.完全预混燃烧的条件
59.面积热强度
60.容积热强度
61.热力型NOx
62.快速型NOx
63.燃料型NOx
64.NOx生成的影响因素
65.降低NOx的排放措施
66.烟气脱硝方法
67.表面燃烧模型
68.容积燃烧模型
二、叙述题
●质量作用定律是化学反应的基本定律,但为何大多燃烧反应不能直接使用质
量作用定律。
●可燃混合物燃烧前是否有氧化反应?如何才能着火燃烧?
●在强制点火中,灼热固体颗粒将周围可燃混合物点燃的临界条件是什么。
●熄火距离概念还有哪些应用价值?
●为何层流火焰传播速度不能用精确的理论公式来计算。
●用周边速度梯度理论解释部分预混火焰的脱火现象时,哪种解释与实际不
符?
●为何在完全预混燃烧中要设置火道,部分预混燃烧可否在火道内进行?
●为何在扩散火焰的焰面上过剩空气系数正好等于1,而不是大于或小于1?
●那种气流形式有利于燃气和空气的混合,那种气流形式不利于燃气和空气的
混合?
●如何利用射流计算公式计算扩散火焰长度?
●按照热力NO x生成的机理,NO不会在火焰面上生成,而是在火焰的下游区域
生成,为什么。
●快速NO x生成的前提条件是什么?哪三个因素对快速NO x影响最大?
●用于计算湍流火焰传播速度的焰面是如何确定的。
●叙述表面燃烧模型、容积燃烧模型。