抗血小板治疗专家共识
- 格式:ppt
- 大小:1.09 MB
- 文档页数:32
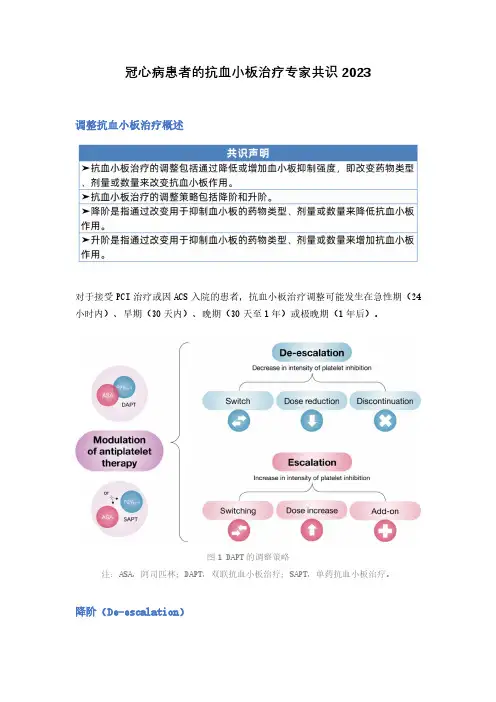
冠心病患者的抗血小板治疗专家共识2023调整抗血小板治疗概述对于接受PCI治疗或因ACS入院的患者,抗血小板治疗调整可能发生在急性期(24小时内)、早期(30天内)、晚期(30天至1年)或极晚期(1年后)。
图1 DAPT的调整策略注:ASA,阿司匹林;DAPT,双联抗血小板治疗;SAPT,单药抗血小板治疗。
降阶(De-escalation)➤当认为抗血小板治疗的出血并发症风险大于血栓并发症风险时,可采用降阶治疗以减少患者出血并发症。
➤降低出血风险可以通过更换为预期抗血小板作用相对较弱的药物、减少剂量或停用抗血小板药物(图2)。
√对于DAPT,转换药物和减少剂量通常仅限于P2Y₁₂抑制剂,尽管理论上阿司匹林也可改变。
√P2Y₁₂抑制剂单药治疗时也可进行转换药物和减少剂量。
√停药通常在DAPT的情况下进行,需要根据医生指示停药,不包括因手术、出血或患者依从性差中断治疗的停药情况。
图2 抗血小板治疗降阶策略注:ASA,阿司匹林;PRA,普拉格雷;CLO,氯吡格雷;TIC,替格瑞洛。
1.转换药物(1)相关定义➤通过转换药物降阶通常是指将强效P2Y₁₂抑制剂(如普拉格雷或替格瑞洛)更换为预期血小板抑制作用相对较弱的P2Y₁₂抑制剂(如氯吡格雷)。
这种情况最有可能发生在最初接受指南推荐DAPT方案(普拉格雷或替格瑞洛)治疗的ACS患者中。
➤可通过检查或根据临床判断来评估或预测换药降阶效果。
√指导换药降阶的检查包括血小板功能检测和基因分型。
√ACS患者DAPT换药研究包括单纯根据临床判断(“非指导”)进行换药或血小板功能检测和基因分型指导的换药。
➤转换药物的最佳时间尚无标准。
√但在非指导换药研究中,P2Y₁₂抑制剂的变化多发生在1个月时(即认为出血风险超过血栓并发症风险)。
√相反,在血小板功能检测和基因分型指导下的换药研究中,这种变化通常发生在更早的时间点,包括PCI后立即换药。
值得注意的是,在PCI围术期换药降阶与血栓相关并发症的增加有关。

《冠状动脉旁路移植术围术期抗血小板治疗专家共识》要点抗血小板治疗是冠状动脉旁路移植术(CABG)围术期最重要的药物治疗之一,抗血小板药物对于CABG改善患者旁路血管通畅率及降低围术期心梗发生率的积极作用已有广泛共识。
近年来大量前瞻性临床试验使人们对抗血板治疗的观念不断变化,新的抗血小板药物层出不穷,各种血小板功能检测的方法逐步应用于临床。
在这一背景下我国心脏外科医师对于围术期抗血小板治疗的理念亟待更新。
1.常用抗血小板药物(1)非甾体类抗炎药这一类药物的代表为阿司匹林,非甾体类抗炎药通过抑制血栓素A2形成达到抗栓作用。
临床上已经有很多强有力的证据证实阿司匹林可以减少旁路血管堵塞、心肌梗死和卒中等的发生;但同时也伴随着出血的风险旧J。
一般认为,小剂量的阿司匹林(75~100mg/天)与大剂量(300~325Mg/天)一样有效,并且出血风险更小。
个体对阿司匹林的反应性并不相同,人群对于药物的高反应和低反应的分布是平均的,这一点并不影响该药物的使用,起码目前还没有能替代阿司匹林的药物。
(2)P2Y12受体拮抗剂P2Y12受体拮抗剂通过抑制ADP介导的糖蛋白(GP)Ⅱb/Ⅲa复合物的活化,从而抑制血小板聚集。
(A)噻吩并吡啶。
这是第一个P2Y12受体拮抗剂。
第二代药物氯吡格雷目前在临床应用最为广泛。
只能口服,常用剂量为75mg每日1次。
(B)替格瑞洛。
一种口服的、可逆的,并且直接抑制P2Y12受体的药物,在Ⅲ期临床试验中显示出强于氯吡格雷的抗血小板效果。
替格瑞洛的常用剂量为90 mg每日2次,停药后3天血小板功能可恢复正长。
值得注意的是替格瑞洛与质子泵抑制剂有竞争作用,应避免共同使用。
(C)短效P2Y12受体拮抗剂。
Cangrelor(坎格雷洛),是一个与替格瑞洛类似的ADP的模拟物,直接、短效、可逆的竞争性拮抗P2Y12受体,通过静脉注射。
坎格雷洛在注射后几分钟内起效,停止注射后1~2 h内血小板功能全部恢复。



ESC专家共识:抗血小板药物的规范化应用(全文)《ESC抗血小板药物应用的专家共识》(以下简称“共识”)系由欧洲心脏协会(ESC)关于动脉粥样硬化性心血管疾病患者应用抗血小板制剂专题工作组制定,发表于ACCP-7之前,其目的有三:①探讨抗血小板药物的作用机制以了解为何有的抗血小板药有效而有的无效;②依据临床证据界定抗血小板治疗获益大于出血合并症的患者群;③提出各种抗血小板药物的应用建议及争议点。
“共识”因此包括相应的三部分:抗血小板药物的作用机制与临床疗效;能从抗血小板治疗中获益的患者;各种抗血小板药物应用建议。
以下将各部分作详细阐述。
一、抗血小板药物的作用机制与临床疗效此部分内容包括:血小板病理生理,持续性血小板抑制剂(阿司匹林,噻氯吡啶与氯比格雷),可逆性血小板抑制剂(可逆性环氧化酶-1抑制剂,口服GPⅡb/Ⅲa阻滞剂,血栓素受体拮抗剂,其他P2Y12拮抗剂)。
“共识”提醒临床医生在论及抗血小板治疗时应了解血小板的病理生理特点:①血小板由骨髓巨核细胞产生,人类血小板寿命约10天,每天约1011个血小板产生进入血循环,需要时产量可增加10倍。
②血小板是无核细胞,其本身不能合成蛋白质(包括酶和受体),其携带的各种因子(包括细胞因子和化学因子)在激活时可被释放入血。
③血小板激活时,来自膜的花生四烯酸在磷酸酯酶、环氧化酶-1(COX-1)和血栓素A2(TXA2)合成酶的快速协同作用下生成前列腺素H2(PGH2),进而生成TXA2。
COX-1是血小板花生四烯酸代谢的一个关键酶。
新生的血小板也含有少量COX-2和PGE合成酶,当新生加速时其含量明显增加,COX-2亦可以使花生四烯酸生成PGH2,经前列环素Ⅰ(PGI)合成酶和前列腺素E(PGE)合成酶的作用进一步生成PGI2与PGE2。
④人类的血小板和血管粘膜内皮细胞都能经PGH2途径进一步产生TXA2、PGI2和PGE2,前者引起血小板聚集和血管收缩,而PGI2抑制血小板聚集并引起血管扩张,PGE2在胃肠粘膜中有细胞保护作用。




缺血性脑卒中患者围手术期抗血小板药物应用中国专家共识《全国第三次死因回顾抽样调查报告》显示,2004—2005年,脑卒中已成为我国国民第一位死亡原因,其死亡人数已经超过肿瘤和心血管疾病。
《中国脑卒中防治报告2015》指出,我国40岁以上人群约有15%为脑卒中发病高危人群,脑卒中综合标化患病率约为2%。
缺血性脑卒中是最常见的卒中类型,占全部脑卒中的60%~80%。
目前国内外指南均推荐抗血小板药物治疗用于卒中发病高风险人群的一级预防治疗和缺血性卒中患者的二级预防治疗[1,2,3,4]。
据此推算,我国至少有8 320万人需要或正在应用抗血小板药物治疗。
这部分人群围手术期抗血小板药物的使用就成为一个亟待规范的临床问题。
2013年《抗血小板治疗中国专家共识》中包含了部分对非心脏外科手术围手术期抗血小板治疗的推荐,但未对临床证据做详细阐述[5]。
临床上围手术期抗栓药物的合理应用仍未引起足够的重视。
2015年日本的一项国内调查研究发现,不同中心围手术期的抗栓治疗策略有很大差异[6]。
据调查,因担心围手术期应用抗栓药物带来的出血风险,我国多数医院外科择期手术治疗前常规停用抗血小板药物1周以上。
这样做确实可以让围手术期的出血风险降至最低,但同时也使患者暴露在无药物保护的状态下,增加了围手术期卒中的发生风险。
英国一项大型队列研究纳入了39512例服用阿司匹林进行心脑血管病二级预防患者,结果表明停用阿司匹林使卒中再发风险增加40%[7]。
瑞士一项病例对照研究表明,规律使用阿司匹林作为缺血性脑卒中二级预防的患者,围手术期暂时停用阿司匹林使急性卒中风险升高3倍(OR 3.4, 95%CI 1.08~10.63)[8]。
一项纳入50 279例患者的荟萃分析也表明,停用阿司匹林治疗使主要卒中事件发生风险升高3倍(OR 3.14, 95%CI 1.75~5.61),而冠脉支架术后的患者停用抗血小板治疗使卒中风险增加了89倍(OR 89.78, 95%CI 29.90~269.60)[9]。