第4章 胶体溶液(新)
- 格式:ppt
- 大小:882.00 KB
- 文档页数:2

高中化学基础胶体教案模板
课题:胶体
教学目标:
1. 了解胶体的定义、特点和分类;
2. 掌握胶体溶液的制备方法和特点;
3. 理解胶体的稳定性及其应用。
教学重点和难点:
重点:胶体的定义、特点和分类。
难点:胶体溶液的制备方法和特点。
教学准备:
1. 教师准备:投影仪、PPT课件、实验物品。
2. 学生准备:课前阅读相关教材。
教学步骤:
Step 1:导入(5分钟)
介绍胶体的概念,引入胶体的定义和特点。
Step 2:讲解胶体的分类(15分钟)
1. 胶体的分类:溶胶、凝胶、乳胶等;
2. 胶体的特点和性质。
Step 3:实验演示(20分钟)
进行一个简单的胶体溶液制备实验,并观察其特点和稳定性。
Step 4:教师总结(10分钟)
总结胶体的定义、特点和分类,以及胶体溶液的制备方法和特点。
Step 5:小结与作业布置(5分钟)
对本节课内容进行小结,并布置相关的作业。
教学反馈:
通过小测验或讨论,检查学生对胶体的掌握情况。
教学延伸:
引导学生进一步了解胶体在生活中的应用和意义。
教学评价:
通过实验操作、讨论和小测验等方式,评价学生的学习情况。


认识化学变化是九年级化学中的重要章节之一、本章主要内容包括化学反应与化学方程式、质量守恒和能量守恒、化学反应速率、化学平衡等。
以下是对该章节知识点的整合。
1.化学反应与化学方程式化学反应是指物质在化学变化过程中原子、离子或分子之间的重组和重新排列,从而形成新的物质。
化学反应可由化学方程式表示,化学方程式由反应物和生成物组成。
例如:2H2+O2→2H2O表示氢气和氧气反应生成水。
2.质量守恒和能量守恒化学反应过程中,原子数量守恒,即反应物中的原子数量等于生成物中的原子数量。
这个基本原理被称为质量守恒定律。
能量守恒定律指出,在化学反应中,能量既不能被创造也不能被摧毁,只能从一种形式转化为另一种形式。
3.化学反应速率化学反应速率是指单位时间内,反应物消失或生成物出现的量变化。
化学反应速率受到温度、浓度、表面积、催化剂等因素的影响。
通常,高温、高浓度、大表面积和适当的催化剂会加快反应速率。
4.化学平衡在反应物和生成物之间存在的反应物浓度或生成物浓度保持恒定的状态被称为化学平衡。
化学平衡可以用化学方程式和平衡常数来描述。
化学平衡的特点包括转化速度的变化、反应物浓度与生成物浓度之间的比例关系以及平衡常数的大小。
5.反应热反应热是指化学反应过程中放出或吸收的热量变化。
化学反应的放热或吸热性质是比较反应物和生成物之间键的能量差异来确定的。
放热反应是指化学反应过程中放出热量的反应,吸热反应是指化学反应过程中吸收热量的反应。
6.酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的反应。
酸性溶液中的氢离子与碱性溶液中的氢氧根离子结合生成水。
酸碱中和反应的化学方程式可用H++OH-→H2O表示。
7.胶体溶液胶体溶液是介于溶液和悬浮液之间的一种混合物。
胶体溶液由胶体和溶剂两部分组成,溶剂中的颗粒被分散均匀,但颗粒大小比溶解物要大。
胶体溶液的可见度随颗粒大小的变化而变化。
8.毒理与环境保护化学变化相关的毒性物质会对人体和环境造成危害。

第四节溶胶剂和高分子溶液剂一、溶胶剂溶胶剂系指固体药物微细粒子分散在水中形成的非均匀状态液体分散体系。
又称疏水胶体溶液,溶胶剂中分散的微细粒子在1~10Onm之间,胶粒是多分子聚集体,有极大的分散度,属热力学不稳定系统。
将药物分散成溶胶状态,它们的药效会出显著的变化。
目前溶胶剂很少使用,但他们的性质对药剂学却十分重要。
(一)溶胶的构造和性质1.溶胶的双电层构造溶胶剂中固体微粒由于本身的解离或吸附溶液中某种离子而带有电荷,带电的微粒表面必然吸引带相反电荷的离子,称为反离子。
吸附的带电离子和反离子构成了吸附层。
少部分反离子扩散到溶液中,形成扩散层。
吸附层和扩散层分别是带相反电荷的带电层称为双电层,也称扩散双电层。
双电层之间的电位差称为ζ电位。
ζ电位愈高由于胶粒电荷之间排斥作用和在胶粒周围形成的水化膜,可防止胶粒碰撞时发生聚结。
ζ电位愈高斥力愈大,溶胶也就愈稳定。
ζ电位降低至25mV以下时,溶胶产生聚结不稳定性。
2.溶胶的性质(1)光学性质:当强光线通过溶胶剂时从侧面可见到圆锥形光束称为丁铎尔效应。
这是由于胶粒大小小于自然光波长引起光散射所产生的。
(2)电学性质:溶胶剂由于双电层结构而荷电,可以荷正电,也可以荷负电。
在电场的作用下胶粒或分散介质产生移动,在移动过程中产生电位差,这种现象称为界面动电现象。
溶胶的电泳现象就是界面动电现象所引起的。
(3)动力学性质:溶胶剂中的胶粒在分散介质中有不规则的运动,这种运动称为布朗运动。
这种运动是由于胶粒受溶剂水分子不规则地撞击产生的。
(4)稳定性:溶胶剂属热力学不稳定系统,主要表现为有聚结不稳定性和动力不稳定性。
溶胶剂对带相反电荷的溶胶以及电解质极其敏感,将带相反电荷的溶胶或电解质加入到溶胶剂中,由于电荷被中和使ξ电位降低,同时又减少了水化层,使溶胶剂产生凝聚进而产生沉降。
向溶胶剂中加入天然的或合成的亲水性高分子溶液,使溶胶剂具有亲水胶体的性质而增加稳定性,这种胶体称为保护胶体。

第二章习题一、名词解释1.物质的量浓度2.质量浓度3.渗透现象4.渗透压5.渗透浓度6.晶体渗透压7.胶体渗透压二、选择题(单选)1.100ml溶液中含8mgCa2+,则溶液中Ca2+的浓度为:()A.0.2mol·L-1 B.0.2mmol·L-1 C.2mol·L-1 D.2mmol·L-1 2.配制300ml 0.1mol·L-1的NaOH溶液,需要称取固体NaOH多少克?()A.1.2g B.1.2mg C.4.0g D.1200g3.9g·L-1的生理盐水的物质的量浓度为:()A.0.0154 mol·L-1 B.308 mol·L-1 C.0.154 mol·L-1 D.15.4 mol·L-1 4.下列四种温度相同、质量浓度相同的溶液,渗透压最大的是:()A.葡萄糖溶液 B.氯化钠溶液 C.氯化钙溶液 D.蔗糖溶液5.下列NaCl溶液能使红细胞产生溶血现象的是:()A.9.0g·L-1 B.15.0g·L-1 C.0.154mol·L-1 D.3g·L-16.中和50ml0.20mol·L-1的HCl溶液,需某NaOH溶液25ml,该NaOH溶液的浓度为:()A.0.1mol·L-1 B.0.2mol·L-1 C.0.4mol·L-1 D.0.8mol·L-17.下列能使红细胞发生皱缩的溶液是:()A.12.5g·L-1NaHCO3B.1.0g·L-1NaCl C.9.0 g·L-1NaCl D.100g·L-1葡萄糖8.将12.5gNaCl溶于水,配制成250ml溶液,该溶液的质量浓度为:()A.25 g·L-1 B.50g·L-1 C.0.05g·L-1 D.0.025g·L-1三、填空题1.100ml0.1mol .L-1Na2CO3溶液中含有Na2CO3____g,该溶液的质量浓度为_____g·L-1。


高中化学胶体教学设计一、教学任务及对象1、教学任务本节课的教学任务是针对高中化学中的胶体这一章节进行深入讲解和探讨。
通过本节课的学习,学生应掌握胶体的定义、分类、性质以及其在日常生活和工业中的应用。
此外,还需了解胶体溶液与普通溶液的区别,掌握胶体稳定性的影响因素,并能够运用相关知识解决实际问题。
2、教学对象本节课的教学对象为高中二年级学生,他们在之前的化学学习中已经掌握了溶液的基本概念、组成及性质,具备一定的化学基础。
此外,学生具备一定的实验操作能力和观察能力,但在胶体这一章节上,可能存在知识盲点,需要教师引导和启发。
因此,本节课将结合学生的实际情况,采用多种教学策略,帮助他们更好地理解和掌握胶体相关知识。
二、教学目标1、知识与技能(1)理解胶体的定义,掌握胶体的分类及性质,了解胶体在日常生活和工业中的应用。
(2)掌握胶体溶液与普通溶液的区别,了解胶体稳定性的影响因素,并能运用相关知识解释实际问题。
(3)学会使用相关实验仪器进行胶体的制备和观察,提高实验操作能力和观察能力。
(4)运用胶体知识,分析解决实际生活中的问题,提高知识运用能力。
2、过程与方法(1)通过课堂讲解、实验演示和分组讨论等形式,使学生掌握胶体相关知识。
(2)采用问题驱动法,引导学生主动探究胶体的性质和稳定性,培养他们的独立思考能力。
(3)组织学生进行实验操作,培养他们的动手能力和观察能力,提高实验素养。
(4)鼓励学生运用所学知识解决实际问题,培养他们的创新意识和团队协作能力。
3、情感,态度与价值观(1)培养学生对化学学科的兴趣,激发他们探索未知世界的热情。
(2)引导学生认识到化学知识在实际生活中的重要性,增强他们的社会责任感。
(3)培养学生严谨、务实的科学态度,提高他们对待实验和学术研究的认真程度。
(4)通过团队合作,培养学生的集体荣誉感,使他们学会尊重他人、善于沟通和协作。
(5)教育学生关注环境保护,了解化学知识在环境保护中的作用,培养他们的环保意识。

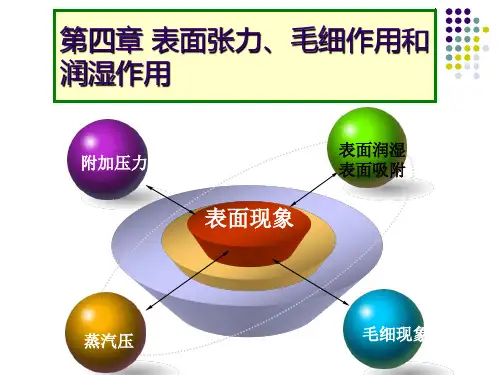
第四章胶体溶液学习要点分散系、分散相、分散介质、表面现象、表面能、表面活性物质、吸附、孚L 化剂、乳化作用、溶胶、胶团结构、Tyndall现象、Brown运动、电泳、电渗。
聚沉值、大分子溶液、胶凝、盐析学习指南(一)分散系统分散系统,简称分散系,是由一种或几种物质以较小的颗粒分散于另一种物质中所形成的系统。
分散系中被分散的物质称为分散相,容纳分散相的物质称为分散介质。
根据物态,分散系有固态、液态与气态之分。
液体分散系按其分散相直径的大小不同可分为真溶液、胶体分散系和粗分散系三类。
分散系又可分为均相分散系和非均相分散系两大类。
均相分散系只有一个相(体系内部物理性质和化学性质均一的部分形成一相”,包括真溶液、大分子溶液。
非均相分散系的分散相和分散介质为不同的相,包括溶胶和粗分散系。
(二)表面现象我们把在任何两相界面上产生的物理化学现象总称为表面现象。
胶体的许多性质,如电学性质、稳定性、保护作用等都与表面现象有关。
如果把液体内部分子移到表面层就要克服向内的合力而做功。
这种功称为表面功,它以势能形式储存于表面分子。
单位表面上的表面自由能即增加单位表面所消耗的功,称为比表面能,比表面能在数值上等于表面张力。
根据热力学原理,表面能有自发降低的趋势。
要降低表面能,可通过两种途径:一是缩小物体的表面积;二是降低表面张力或是两者都减小。
表面活性物质分子的一端具有疏水性,另一端具有亲脂性。
如果向水中加入表面活性物质,则表面活性物质会部分地代替水分子聚集在溶液表面上,以降低表面张力,导致表面活性物质在表面层的浓度大于在溶液内部的浓度,产生正吸附。
相反,如果向水中加入某些无机盐类(如NaCl等)、糖类(单糖、双糖)以及溶于水的金属氢氧化物、淀粉等表面张力比水大的表面非活性物质,则这类物质在溶液表面层的浓度将会小于它们在溶液内部的浓度,产生负吸附。
(三)孚L状液水与油这两种液体不相溶,若使其中的一种液体的一种以细小的液滴分散于另一种不相溶的液体中,必须在振荡的同时加入一种能降低比界面能的表面活性物质,这种表面活性物质的分子在油与水两相界面上定向地排列,形成一层保护分散相液滴的薄膜,防止了液滴合并变大而分层,使体系得到一定程度的稳定性. 这种能使乳浊液稳定的的表面活性物质称为乳化剂,乳化剂所起的作用称为乳化作用。

第4讲物质的分类考点一物质的组成、性质及分类.理解混合物和纯净物、单质和化合物、.理解酸、碱、盐、氧化物的概念及其相.了解胶体是一种常见的分散系,了解溶1.2.胶体:概念、组成、性质及应用1.元素、微粒及物质间关系图2.同素异形体3. 元素在物质中的存在形态游离态:元素以单质形式存在的状态。
化合态:元素以化合物形式存在的状态。
4. 混合物和纯净物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
有下列物质:①氧气②二氧化碳③臭氧(O3) ④盐酸⑤铁⑥碳酸钠⑦空气⑧氢氧化钠⑨冰、水混合物其中由分子直接构成的纯净物有:①②③⑨;由原子直接构成的纯净物有:⑤;由离子直接构成的纯净物有:⑥⑧;互为同素异形体的是:①和③;属于单质的有:①③⑤;属于化合物的有:②⑥⑧⑨;属于混合物的有:④⑦。
提醒:由同种元素组成的物质不一定是纯净物,如O2和O3。
3.物质的分类(1)树状分类法——按不同层次对物质逐级分类无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎧氢化物:HCl 、H 2S 、H 2O 、NH 3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO 、NO 等成盐氧化物⎩⎨⎧碱性氧化物:Na 2O 、CaO 等酸性氧化物:CO 2、P 2O 5等两性氧化物:Al 2O 3等过氧化物:Na 2O 2、H 2O 2等酸⎩⎪⎪⎪⎨⎪⎪⎪⎧按电离出的H +数⎩⎨⎧一元酸:HCl 、HNO 3等二元酸:H 2SO 4、H 2S 等三元酸:H 3PO 4等按酸根是否含氧⎩⎨⎧无氧酸:HCl 、H 2S 等含氧酸:HClO 4、H 2SO 4等按酸性强弱⎩⎨⎧强酸:HCl 、H 2SO 4、HNO 3等弱酸:CH 3COOH 、HF 等按有无挥发性⎩⎨⎧挥发性酸:HNO 3、HCl 等难挥发性酸:H 2SO 4、H 3PO 4等碱⎩⎨⎧按水溶性⎩⎨⎧可溶性碱:NaOH 、KOH 、Ba (OH )2等难溶性碱:Mg (OH )2、Cu (OH )2等按碱性强弱⎩⎨⎧强碱:NaOH 、Ba (OH )2、KOH 等弱碱:NH 3·H 2O 等盐⎩⎨⎧正盐:BaSO 4、KNO 3、NaCl 等酸式盐:NaHCO 3、KHSO 4等碱式盐:Cu 2(OH )2CO 3等复盐:KAl (SO 4)2·12H 2O 等提醒:(1)同一种物质,按不同的角度进行分类,可得到不同的分类结果,如Na 2CO 3属于钠盐、碳酸盐、含氧酸盐、正盐等。

【化学技能4】Fe(OH)3胶体溶液的制备
01
1、洗涤
2、取用试剂
3、加热【沸腾状态下滴加20滴1mol/LFeCl3溶液,煮沸2分钟制成红棕色Fe(OH)3胶体溶液】
4、清洁、整理
02
1
烧杯、量筒、玻璃棒分别用洗涤剂(取少量,加自来水溶解稀释)清洗→ 自来水清洗(泡沫冲洗干净)→蒸馏水清洗(三
遍)
2
量筒量取20ml蒸馏水(液面与视线水平),倒入小烧杯
中。
3
1)点燃酒精灯并移至三脚架下方,火柴梗放废物缸;
2)石棉网放在三脚架上方;
3)小烧杯(装有20ml蒸馏水)放上,酒精灯(外焰)加热至沸腾;
4)沸腾状态下边搅拌边滴加20滴FeCl3溶液,煮沸2分钟制成红棕色Fe(OH)3胶体溶液,停止加热;
5)取下烧杯,熄灭酒精灯(灯冒盖灭两次)。
4
Fe(OH)3胶体溶液需回收,自来水清洗烧杯、量筒、玻璃棒三遍,仪器摆放整齐,台面清洁整理。
第四章液体制剂一、问答题1、试述液体制剂的特点与其应用的适应性。
2、简述表面活性剂的基本特性和应用范围,并请分别举例说明。
3、试述表面活性剂的临界胶束浓度的定义、测定原理及其在表面活性剂应用中的意义。
4、哪些表面活性剂具有昙点?为什么?5、药剂学上常用的增加难溶性药物溶解度的方法有哪些?分别举例说明。
6、名词解释:表面活性剂、HLB值、昙点、临界胶团浓度。
7、表面活性剂分子结构有何特点?分哪几类?肥皂、月桂醇硫酸钠、阿洛索0T、新洁尔灭、卵磷脂、Tween80 、PluronicF-68 分别属于哪一类?应用有何特点?8、不同用途对表面活性剂的HLB值要求如何?混合表面活性剂的HLB如何计算?9、不同类别表面活性剂的毒性如何?与其应用有何关系?10、表面活性剂在药剂中有哪些应用?举例说明。
11、表面活性剂生物学性质是什么?、单选题1、难溶于水的药物配成水溶液时,增大其溶解度的方法是(A)A、加热B、粉碎成细粉促进其溶解C、搅拌D、药物与溶媒所带电荷相同E、药物与溶媒的性质相似2、最适于作疏水性药物润湿剂HLB值是(E)A、HLB值在5〜20之间B、HLB值在7〜9之间C、HLB值在8〜16之间D、HLB值在7〜13之间E、HLB值在3〜8之间3、不属于液体药剂者为(D)A、合剂B、搽剂C、灌肠剂D、醑剂E、注射剂4、对液体制剂质量要求错误者为(B)A、溶液型药剂应澄明B、分散媒最好使用有机分散媒C、有效成分浓度应准确稳定D、乳浊液型药剂应保证其分散相小而均匀E、制剂应有一定的防腐能力5、下列表面活性剂有起昙现象的主要是那一类(E)A、肥皂B、硫酸化物C、磺酸化物D、季铵化物E、吐温6、下列关于表面活性剂性质的叙述中正确者是(C)A、有亲水基团、无疏水基团B、有疏水基团、无亲水基团C、疏水基团、亲水基团均有D、有中等级性基团E、无极性基团7、不同HLB值的表面活性剂用途不同,下列错误者为(A)A、增溶剂最适范围为15〜18以上B、去污剂最适宜范围为13〜16C、润湿剂与铺展剂最适范围为7〜9D、大部分消泡剂最适范围为5〜8E、O/W乳化剂最适范围为8〜168、药物以下列哪种状态分散在介质中,可形成均相的液体制剂?( B )A、胶粒C、小液滴9、属于阴离子型的表面活性剂是()A、吐温-80C、乳化剂0P10、将吐温-80 (HLB=15 )和司盘-80 值最接近的是()A、9.6C、12.611、表面活性剂结构特点是()A、含烃基的活性基团C、分子由亲水基和亲油基组成E、含不解离醇羟基12、具有临界胶团浓度是()A、溶液的特性C、表面活性剂的一个特性E、亲水胶体的特性13、以下表面活性剂毒性最强的是()A、吐温80B、肥皂C、司盘14 •下面说法不正确的是()A含乙醇20%以上具有防腐作用BB、分子D、微粒B、月桂醇硫酸钠D、普罗尼克F-68(HLB=4.3 )以二比一的比例混合,混合后的B、17.2D、11.4B、是高分子物质D、结构中含有氨基和羟基HLBB、胶体溶液的特性D、高分子溶液的特性20 D、平平加O E、氯苄烷铵山梨酸适用于含吐温类液体的防腐C pH高时苯甲酸钠防腐作用较好D 阿拉伯胶可作为矫味剂使用15 •有关表面活性剂生物学性质的错误表述是()A表面活性剂对药物吸收有影响B表面活性剂与蛋白质可发生相互作用C表面活性剂中,非离子表面活性剂毒性最大D表明活性剂长期应用或高浓度使用可能岀现皮肤或粘膜损伤16 •调配溶液时,进行搅拌的目的是增加药物的()1、W/0型乳化剂的HLB值()2、湿润剂的HLB值()3、增溶剂的HLB值()4、O/W型乳化剂HLB值()5、去污剂的HLB值()四、多项选择题1、属于非离子型的表面活性剂有()A、司盘-80B、月桂醇硫酸钠C、乳化剂OPD、普流罗尼克F-682、可用于注射乳剂生产的表面活性剂有()A、新洁尔灭B、司盘-80C、豆磷脂D、普流罗尼克F-683、表面活性剂在药剂上可作为()A、湿润剂B、乳化剂C、防腐剂D、洗涤剂E、助溶剂4、有关表面活性剂叙述正确的是()A、阴阳离子表面活性剂不能配合使用B、制剂中应用适量表面活性剂可利于药物吸收C、表面活性剂可作消泡剂也可作起泡剂D、起浊现象是非离子型表面活性剂的一种特性5、卜面的术语或缩写中,与表面活性剂无关的是(CE)A、HLB B、Krafft Poi ntC、顶裂D、起昙A润湿性B抗氧化性C溶解度D溶解速度17.将吐温-80 ( HLB=15 )和司盘-80 (HLB=4.3 )以二比一的比例混合,混合后的HLB值最接近的是()A、9.6 C、12.6B、17.2 D、11.4三、配伍选择题[1-5]A、15-18B、13-15C、8-16D、7-11E、3-8E、HPMC6、吐温类表面活性剂具有(ACD )A、增溶作用B、助溶作用C、润湿作用D、乳化作用E、润滑作用口服液体制剂问答题1什么是液体制剂?有何特点?可分为哪几类?2、常用的液体分散溶媒有哪些?各有何应用特点?3、什么是溶解度,增加药物溶解度的方法有哪些?各举例说明。