植物表型组学研究技术(一)FluorCam 叶绿素荧光成像技术
- 格式:pdf
- 大小:2.40 MB
- 文档页数:8
植物表型组学研究技术(一) ——FluorCam叶绿素荧光成像技术FluorCam叶绿素荧光成像技术Rousseau等(High throughput quantitative phenotyping of plant resistance using chlorophyll fluorescence image analysis.Plant Methods, 2013, 9:17),利用FluorCam开放式叶绿素荧光成像系统作为高通量表型分析平台,采用图像阈值分割等分析方法,对植物病原体感染进行了定量分析检测,根据Fv/Fm将感染分为不同阶段/等级,特别是可以将用其它方法难以分辨出来的感染前期加以分辨,并对5个品种的菜豆对普通细菌性疫病的抗性进行了定量分析评价。
PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术(Pulse Amplitude Modulated technique——脉冲调制技术)与CCD技术结合在一起,于1996年在世界上成功研制生产出FluorCam叶绿素荧光成像系统(Heck等,1999;Nedbal等,2000;Govindjee and Nedbal, 2000)。
FluorCam叶绿素荧光成像技术成为上世纪90年代叶绿素荧光技术的重要突破,使科学家对光合作用与叶绿素荧光的研究一下子进入二维世界和显微世界,广泛应用于植物生理生态、植物胁迫与抗性监测、作物育种、植物表型分析等。
不同于其它成像分析技术,FluorCam叶绿素荧光成像只对叶绿素荧光波段敏感,可以有效避免环境光的干扰,特异性、高灵敏度反映植物生理生态状况。
主要功能特点如下:1)高灵敏度CCD,时间分辨率可达50帧/秒,有效抓取叶绿素荧光瞬变;可选配高分辨率CCD,分辨率1392x1040像素,用于气孔功能成像分析、稳态荧光如GFP荧光测量等2)具备完备的自动测量程序(protocol),可自由对自动测量程序进行编辑:a)Fv/Fm:测量参数包括Fo,Fm,Fv,QY等b)Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数c)荧光淬灭分析:Fo,,Fm,Fp,Fs,Fv,QY,ΦIINPQ,Qp,Rfd,qL等50多个参数d)光响应曲线LC:Fo,Fm,QY,QY_Ln等荧光参数e)PAR吸收f)GFP等静态荧光测量g)OJIP与JIP-test(FKM与封闭式荧光成像系统):Fo,Fj,Fi,P 或Fm,Mo(OJIP曲线初始斜率)、OJIP固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等26个参数3)自动重复实验功能,可无人值守自动循环完成选定的实验程序,重复次数及间隔时间客户自定义,成像测量数据自动按时间日期存入计算机4)FluorCam成像分析软件:具在线功能(Live)、实验程序选配功能(Protocols)、成像预处理功能(Pre-processing)及成像分析结果展示报告功能(Result)四大功能模块a)在线功能(live):可对仪器和样品进行在线测试调试、快照、显示实验进度、在线显示荧光瞬变动态视频等b)实验程序选配功能(protocols):可选配不同的实验程序,并可对实验程序进行编辑、设置、储存(以备以后使用同样的实验程序)等c)成像预处理功能:可浏览整个测量视频及任何点、任何区域的荧光动态变化曲线,可进行“选区操作”或“分级操作”(图像阈值分割功能);选区操作可对成像进行自动或手动选区(ROI),还可使用“模具”包括多孔板模具、培养皿模具、桌面模具进行模具选区;分级操作具备荧光强度刻度标尺和四个“游标”,通过移动4个游标可以将成像按不同强度划分成不同的荧光范围组进行分析处理,可设置不同的阈值进行图像阈值分割d)结果展示报告功能:可展示所有选区(ROI)的叶绿素荧光参数值及其图像、每个参数的频率直方图及每个ROI的荧光动态图等,可对原数据(kinetic)、叶绿素荧光参数等导出到excel表,还可对每个参数成像图存储成位图5)数据分析具备“信号计算再平均”模式(算数平均值)和“信号平均再计算模式”两种功能模式,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式以过滤掉噪音带来的误差FluorCam叶绿素荧光参数:参数符号概念描述Size 面积(像素值),经校准可测量实际面积Fo 暗适应后的最小荧光Fo_Dn 暗松弛最小荧光,红外光诱导PSIFo_Ln 光适应后的最小荧光,红外光诱导PSIFo_Lss 光适应后稳态最小荧光,红外光诱导PSIFm 暗适应后最大荧光Fm_Dn 暗松弛最大荧光Fm_Ln 光适应最大荧光Fm_Lss 光适应稳态最大荧光Fp Kautsky诱导效应最大荧光Ft_Dn 暗松弛即时荧光Ft_Ln 光适应即时荧光Ft_Lss 光适应稳态荧光Fv Fm-FoNPQ_Dn 暗松弛非光化荧光淬灭,=(Fm-Fm_Dn)/Fm_DnNPQ_Ln 光适应非光化荧光淬灭,=(Fm-Fm_Ln)/Fm_LnNPQ_Lss 稳态非光化荧光淬灭,=(Fm-Fm_Lss)/Fm_LssqP_Dn 暗松弛光化学荧光淬灭,=(Fm_Dn−Ft_Dn)/Fm_Dn−Fo_DnqP_Ln 光适应光化学淬灭,=(Fm_Ln−Ft_Ln)/(Fm_Ln−Fo_Ln)qP_Lss 稳态光适应光化学淬灭,=(Fm_Lss−Ft_Lss)/(Fm_Lss−Fo_Lss)qL_Ln 基于“Lake”模型的光适应光化学淬灭qL_Lss 基于“Lake”模型的稳态光适应光化学淬灭QY_Dn 暗松弛光量子效率,=(Fm_Dn−Ft_Dn)/Fm_DnQY_Ln或ΔF/Fm 光适应光量子效率,=(Fm_Ln−Ft_Ln)/Fm_LnQY_Lss 稳态光量子效率,=(Fm_Lss−Ft_Lss)/Fm_LssFv/Fm或QY_max 最大光量子效率Fv/Fm_Ln 光适应光量子效率,=(Fm_Ln−Fo_Lss)/Fm_LnFv/Fm_Lss 稳态光量子效率,=(Fm_Lss−Fo_Lss)/Fm_LssRfd_Ln 光适应荧光衰减率,用于评估植物活力,=(Fp−Ft_Ln)/Ft_LnRfd_Lss 稳态荧光衰减率,用于评估植物活力,=(Fp−Ft_Lss)/Ft_Lss除上述叶绿素荧光参数外,还可以成像测量PAR吸收、植物光谱反射指数NDVI等,叶片大小(或植物大小)可以反映植物的生长等。

叶绿素荧光成像技术的原理与应用一、引言叶绿素是植物中最重要的光合色素,是植物进行光合作用的基础。
溶剂化的叶绿素主要吸收蓝色和红色光,在500~600和650~700nm波长范围内,具有两个吸收峰。
叶绿素荧光成像技术是基于叶绿素发出的荧光信号来进行影像测量的一种实时、无创的模拟测量方法。
本文将介绍叶绿素荧光成像技术的原理、实验流程及其应用。
二、原理叶绿素荧光成像技术是基于叶绿素荧光的成像,叶绿素荧光受光强度和环境因素的影响而变化,可以反映植物的生长状态、光合作用效率和叶片生理变化等信息。
叶绿素荧光成像系统具有高时间分辨率、高空间分辨率的特点,可以获取全景、彩色、实时和定量信息。
叶绿素荧光成像技术主要是利用荧光成像仪和其他仪器支持,通过蓝/绿或红/绿激发光、荧光图像采集和分析等步骤,可以获得叶绿素的分布信息。
三、实验叶绿素荧光成像技术的实验主要分为两个步骤:激发和成像。
首先是激发,将叶片放入光合器中,用荧光成像仪对植物叶片进行光激发,根据荧光成像仪的激光幅度,可以调整植物叶片的荧光强度。
之后,进行成像,将植物叶片放到荧光成像仪中进行拍摄,获取叶绿素的发光信号。
最后,通过荧光照片的处理,可以计算叶片荧光强度和叶绿素荧光参数,如最大光化学利用率、植物光合作用效率等。
四、应用叶绿素荧光成像技术的应用非常广泛,主要涉及到生物学、生态学、农业、气象学,特别适用于植物生长状态监测、植物抗性研究、光合作用效率评估等。
一些具体的应用领域可以如下简要介绍:1.光合作用研究叶绿素荧光成像技术可用于研究植物的光合作用效率、光能利用和光保护机制。
典型的光合作用实验是通过比较光照和黑暗条件下植物的荧光变化来确定植物的光合反应和光保护机制。
2.气候变化影响研究在气候变化方面,叶绿素荧光成像技术可用于研究气候变化导致的植物响应和适应。
通过对多个季节的荧光成像分析可以确定气候变化对地上层和植物生长的影响。
3.生态环境研究叶绿素荧光成像技术可用于研究萎缩地区的植被恢复和生态系统的响应。


PlantScreen植物表型成像分析系统(野外样带版)——高通量植物表型组学研究平台植物表型组学(phenomics)是一门在基因组水平上系统研究植物在各种不同环境条件下所有表型形状特征的学科。
2009年4月,第一届国际植物表型组大会在澳大利亚堪培拉成功举办,植物表型组学研究技术也进入一个新的阶段。
PlantScreen植物表型成像分析系统由位于著名孟德尔遗传定律的发源地捷克布尔诺(Brno)、研发世界上第一台FluorCam 叶绿素荧光成像技术的PSI公司与欧洲著名科学家合作研制生产的新型植物表型组学研究平台,可以全自动、高通量、高容量测量分析拟南芥、水稻等植物的三维表型形状及生理状态及其与环境光照、温度、水、营养盐等的关系。
PlantScreen植物表型成像分析系统整合了LED植物智能培养、自动化控制系统、叶绿素荧光成像测量分析、植物热成像分析、植物近红外成像分析、植物高光谱分析、自动条码识别管理、RGB真彩3D成像、自动称重与浇灌系统等多项先进技术,以最优化的方式实现大量植物样品——从拟南芥、水稻、玉米到各种其它植物的全方位生理生态与形态结构成像分析,用于高通量植物表型成像分析测量、植物胁迫响应成像分析测量、植物生长分析测量、生态毒理学研究、性状识别及植物生理生态分析研究等。
作为全球第一家研制生产植物叶绿素荧光成像系统的厂家,PSI公司在植物表型成像分析领域处于全球的技术前列,大面积叶绿素荧光成像分析功能使PlantScreen成为植物表型分析与功能成像分析的最为先进的仪器设备,使植物生长、胁迫响应等测量参数达几百个。
PlantScreen系统(野外样带版)包括如下植物表现形状成像分析功能1. 叶绿素荧光成像分析:可对植物叶绿素荧光动态进行成像分析,以全方位监测植物生理状态,胁迫生理如干旱胁迫、肥料胁迫、病虫害胁迫、环境污染毒性胁迫等等,还可对GFP(绿色荧光蛋白)进行成像分析,单幅成像面积40x40cm,成像测量参数包括Fo, Fm, Fv, Fo’, Fm’, Fv’, Ft, Fv/Fm, Fv’/Fm’, Phi_PSII, NPQ, qN, qP, Rfd等几十个叶绿素荧光参数2. RGB成像分析:可对植物的形状进行三维成像分析,并可自动对植物花朵数量、水稻分蘖等进行统计分析,主要测量参数包括:1) 叶面积2) 植物紧实度/紧密度3) 叶片周长4) 偏心率5) 叶圆度6) 叶宽指数7) 叶片细长度SOL8) 植物圆直径9) 凸包面积10) 植物质心11) 节间距12) 生长高度13) 植物三维最大高度和宽度14) 相对生长速率15) 叶倾角16) 节叶片数量17) 其它参数如用于植物适合度估算的颜色定量分级、绿度指数3. 高光谱成像分析(选配),可成像并分析如下参数1) 归一化指数2) 简单比值指数3) 改进的叶绿素吸收反射指数4) 最优化土壤调整植被指数5) 绿度指数6) 改进的叶绿素吸收反射指数7) 转换类胡罗卜素指数8) 三角植被指数9) ZMI指数10) 简单比值色素指数11) 归一化脱镁作用指数12) 光化学植被反射指数13) 归一化叶绿素指数14) Carter指数15) Lichtenthaler指数16) SIPI指数17) Gitelson-Merzlyak指数4. 热成像分析(选配):用于成像分析植物在光辐射情况下的二维发热分布,良好的散热可以使植物耐受较长时间的高光辐射或低水条件(干旱)5. 近红外成像分析(选配):用于观测分析植物的水分状态及其在不同组织间的分布变异,处于良好浇灌状态的植物表现出对近红外光谱的高吸收性,而处于干旱状态的植物则表现出对近红外光谱的高反射性,通过分析软件可以监测分析从干旱胁迫到再浇灌过程中的整个过程动态及植物对干旱胁迫的响应和水分利用效率,并形成假彩图像,可以与植物的形态指数及叶绿素荧光指数进行相关分析研究。

叶绿素荧光分析技术在植物生物学研究中的应用叶绿素荧光分析技术(Chlorophyll Fluorescence Analysis, CFA)是一种广泛应用于植物生物学研究的非侵入性、快速、准确的技术手段。
通过测量光合作用中叶绿素荧光的特性,可以获得植物生理和生化过程的相关信息,包括光合效率、光抑制程度、损失机制等。
叶绿素荧光分析技术已经在植物生物学研究的各个领域得到了广泛的应用。
首先,叶绿素荧光分析技术可以用于研究植物的光合作用效率。
光合作用是植物生长和发育的关键过程,而叶绿素荧光是光合作用活性的直接反映。
通过测量叶绿素荧光参数,如最大光化学效率(Fv/Fm)、有效光量子产生率(Yield)、电子传递速率(ETR)等,可以评估植物的光合作用效率,并揭示光合作用过程中的限制因素和调节机制。
其次,叶绿素荧光分析技术可用于研究植物的抗逆性。
植物在生长过程中会面临各种逆境胁迫,如高温、干旱、盐碱等。
这些逆境胁迫会影响植物的生理和生化过程,进而降低植物生长和产量。
叶绿素荧光分析技术可以通过测量不同荧光参数的变化,如非光化学淬灭(NPQ)、非光化学猝灭(qN)等,评估植物对逆境胁迫的响应和适应能力,有助于筛选和培育抗逆性较高的植物品种。
第三,叶绿素荧光分析技术还可以用于研究植物的生长发育和叶片退化过程。
植物的生长和发育是一个复杂的过程,受光照、温度、水分等环境因素的影响。
叶绿素荧光分析技术可以通过测量荧光参数的变化,如初级光化学光谱(O-J-I-P曲线)、最大劲度光化学效率(Vj)、ABS/RC等,评估植物的生长发育状态和叶片衰老程度,为优化植物的生长环境和调控光合作用提供依据。
最后,叶绿素荧光分析技术还可以应用于环境污染监测和生态系统研究。
环境污染物对植物生长和光合作用活性的影响是导致生态系统退化的重要因素之一、叶绿素荧光分析技术可以通过测量不同荧光参数的变化,如荧光上升动力学曲线(Fs)和最大荧光高度(Fm’)、电子传递速率(ETR)等,评估植物对环境污染的响应程度和生态系统的健康状况。


叶绿素荧光成像技术在植物生物学中的应用植物是地球生态系统中最重要的生物类群之一,其生长和代谢对人类的食品、医药和环境保护具有极其重要的意义。
而叶绿素作为植物中的重要色素,则是植物正常生长和光合作用的关键。
因此,如何准确地掌握植物中叶绿素的分布和代谢过程,对于我们深入了解植物生物学的本质有着重要的作用。
而叶绿素荧光成像技术,则为我们提供了一种非常实用的手段。
首先,为了更好地理解叶绿素荧光成像技术的应用,不得不先简要了解一下叶绿素荧光成像技术的基本原理和技术流程。
叶绿素荧光成像技术基于植物叶片中的叶绿素荧光信号,通过专业相机等设备将荧光信号转换为图像。
而在荧光成像技术中,荧光成像指探测叶绿素在光照下出现的荧光信号,在探测的过程中可以得到信号强度和时间。
这些荧光信号可以通过荧光成像仪等设备进行检测和记录,并转化为图像,从而形成可视化的数据信息。
其次,叶绿素荧光成像技术在植物生物学中的应用也是十分广泛的。
例如,通过叶绿素荧光成像技术可以非常精确地测量植物中的叶绿素含量和PSII (Photosystem II;光合作用中的光反应系统第二个过程)功能状态,进而研究叶绿素的分布和代谢过程。
同时,通过检测叶绿素荧光信号的变化可以分析植物生长和发育的过程,例如其可以监测光合作用中的电子转移过程,同时也可以用来研究植物在环境变化下的应激反应情况。
此外,叶绿素荧光成像技术还可用于植物农艺性状的研究,例如套袋处理对苗圃欧洲红松幼苗光合作用和光渗透性的影响。
其还可以用于研究植物叶片形态学和光合作用对植物生长与发育的调节作用等。
利用荧光成像技术,可以更精准地实现对植物生命活动的分析和监测。
综上所述,叶绿素荧光成像技术在植物生物学领域中有着十分广泛和深入的应用。
它不仅可以帮助我们更好地了解植物生长和代谢的本质,还可以为植物农艺性状的变异性研究提供有力的支持。
未来,相信随着技术的进一步发展,叶绿素荧光成像技术在植物生物学中的应用也将更加广泛和深入。

Fluorcam荧光成像技术及其在光合作用研究中的应用Eco‐lab生态实验室北京易科泰生态技术有限公司info@eco‐目录1、叶绿素荧光成像技术发展过程2、荧光参数及其生理意义3、PSI介绍(荧光成像的发明者)4、PSI产品介绍5、应用案例叶绿素荧光技术发展历程•Kautsky effect: Kautsky and Hirsch(1931)首次用肉眼发现叶绿素荧光现象并发表论文“CO2同化新实验”,后被称作“Kautsky effect”•PAM(Pulse Amplitude Modulated Fluorometer): Schreiber(1986)等发明了PAM脉冲调制技术测量叶绿素荧光。
•FluorCam:KineKc imaging of chlorophyll fluorescence: Ladislav Nedbal(2000)等于上世纪90年代末期发明了与PAM技术相结合的叶绿素荧光成像技术成像测量局部放大荧光参数及其意义•Fo、Fm与QY,此外还有PAR_Abs及ETR•Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd•荧光淬灭分析:Fo,Fm,Fp,Fs,Fv,QY,NPQ,Qp,Rfd 等50多个参数•OJIP曲线:快速荧光诱导曲线。
Fo,Fj,Fi,P或Fm,Mo(OJIP曲线初始斜率)、FixArea固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等•LC光响应曲线:Fo,Fm,QY,QY_Ln叶绿素荧光仪著名厂商•PSI:捷克布尔诺Brno(孟德尔在此发现著名的孟德尔遗传定律),Ladislav Nedbal为首席科学家和主要股东(另一股东为David Kramer,美国密执根州立大学教授),1997年为美国华盛顿大学H.Pakrasi教授研制成了第一台FluorCam荧光成像系统。
主要产品有:–FluorCam叶绿素荧光成像系列产品–FL3500/FL5000双调制荧光仪系列产品–FluorPen及AquaPen等手持式荧光仪产品–光养生物反应器等藻类培养与在线监测产品–光源与植物培养室•Optics:美国,主要产品为OS5p‐PAM叶绿素荧光仪等•Walz:德国,主要产品为PAM2500叶绿素荧光仪等PSI厂家介绍PSI厂家剪影laboratoryFluorCam叶绿素荧光成像:1. Handy FC——FluorCam便携式叶绿素荧光成像系统2. Handy GFPCam——FluorCam便携式荧光蛋白成像系统3. Handy Leaf chamber——便携式光合联用叶绿素荧光成像系统4.Closed FC——封闭式叶绿素荧光成像系统5. Closed GFPCam——封闭式多光谱荧光蛋白成像系统6. Open FC——开放式叶绿素荧光成像系统‐Rover FluorCam——移动式大型植物荧光成像系统‐Transect FluorCam——样带扫描式植物荧光成像系统‐XY‐Plane FluorCam——多光谱XY‐平台式大型植物荧光成像系统‐Arch FluorCam——拱形三维植物荧光扫描成像系统7. Micro‐FluorCam——显微叶绿素荧光成像系统,又分标准版、增强版(可选配GFP FilterCube Set)及滤波轮版8. Conveyor and RoboKc PlantScan System——PlantScan全自动植物光谱成像分析系统9. Fluorescence KineKc Microscope——FKM荧光动态显微光谱成像系统Fluorcam荧光成像技术特点◆对叶片无损伤、测量迅速◆测量对象多样,包括叶片、果实、藻类、地衣、苔藓、拟南芥等◆具备自动重复测量功能,从而实现无人职守自动成像实验◆结果以图片或视频形式输出,直观、易于观察◆应用领域广泛,如光合作用、植物胁迫生理学、水生生物学、海洋学和遥感等◆实验室、野外均可使用◆测量面积范围广,小至微米,大至整块草坪◆用户可根据实验需要,自定义测量参数FlourCam叶绿素荧光成像技术应用领域•植物光合特性和代谢紊乱植株的筛选•生物和非生物胁迫的检测•植物抗胁迫能力或者易感性研究•气孔非均一性研究•长势与产量评估•植物——微生物交互作用研究•植物——原生动物交互作用研究Kautsky effect in a diuron‐inhibited leaf(敌草隆抑制电子传递实验)OJI PScreen mutants by NPQ parameters (通过荧光淬灭分析筛选变异植株)水分对沙漠中苔藓的光合特性的影响加水0.5 h后高光胁迫获得的衣藻突变体重金属胁迫条件下的烟叶荧光成像左图为对照烟叶,中图为通过叶脉浸泡硫酸铜30分钟后的荧光成像,右图为经硫酸铜浸泡处理60分钟后的荧光成像。

叶绿素荧光技术在植物生理研究中的应用植物作为生态学中不可或缺的一个重要组成部分,一直以来受到人们的广泛关注。
植物受到周围环境的影响,不仅在形态上发生变化,同时也会产生一定的生理反应。
为了更好地研究植物的生理反应以适应不同的生态环境,叶绿素荧光技术得到了广泛的应用。
下面就叶绿素荧光技术在植物生理研究中的应用进行探讨。
一、叶绿素荧光技术的研究思路叶绿素荧光技术是一种基于叶绿素发射荧光的非损伤性测定方法。
通过这一技术,我们可以对植物光合作用中产生的荧光进行检测并加以分析。
研究人员通常选择不同的叶片部位来进行叶绿素荧光测定,并针对不同的荧光参数进行分析。
这种技术可以帮助我们在生理水平上分析植物的生长,代谢和光合效率等参数,以了解植物在不同环境下的适应能力。
二、叶绿素荧光技术在植物胁迫反应研究中的应用由于环境的不断变化,植物面临着各种胁迫,如氧气、盐度、干旱和温度等。
这些胁迫因素会对植物的代谢和生长产生负面影响。
通过叶绿素荧光技术,可以对植物在不同的胁迫条件下的生理反应进行评估。
在研究中,通过对荧光糖基化,激发叶子的荧光信号,并测量荧光反应中的氮气气体的发射强度,可以分析植物对于各种胁迫的生理反应。
叶绿素荧光技术所提供的这些数据将有助于调节植物环境,提升植物的适应能力。
三、叶绿素荧光技术在植物营养研究中的应用植物的生长和健康状态的一个重要因素是正确的营养摄入。
基于叶绿素荧光技术的研究可以帮助我们了解植物营养状况,以及如何对不同的营养缺乏情况进行调整。
通过对荧光强度和荧光时程等参数的分析,可以准确地评估植物的营养状况。
叶绿素荧光技术可以用于优化植物的钾、磷、氮等营养成分的吸收效率,并帮助我们了解不同的营养需求和生理反应。
四、叶绿素荧光技术在植物基因通路研究中的应用叶绿素荧光技术也可以应用于研究植物的基因调控机制。
通过检测叶绿素荧光参数的变化,可以了解不同基因通路激活或抑制情况。
研究人员可以探索基因调控机制的影响,评估其可能的生理影响并优化植物生长状态。

PlantScreen叶绿素荧光与RGB自动扫描成像分析系统PlantScreen叶绿素荧光与RGB自动扫描成像分析系统集成了自动化控制系统、FluorCam大型叶绿素荧光成像测量分析、RGB植物真彩成像分析等先进技术,实现对各种培养植物——从拟南芥、水稻到各种其它植物的生理生态与形态结构成像分析,用于高通量植物表型成像分析测量、植物胁迫响应成像分析测量、生态毒理学与污染生态学研究、性状识别及植物生理生态分析研究、作物育种与抗性检测、生物多样性/遗传多样性表型检测分析及土壤种子库研究等。
成像平台可在主机箱内XYZ三维自动化移动,自动扫瞄成像范围为60cm x 129cm,植物最大高度约50cm。
系统配置与工作原理:系统由XYZ三维自动控制箱、XYZ三维移动成像平台及自动控制与分析软件等组成,LED光源、FluorCam叶绿素荧光成像、RGB成像集成于一个可XYZ三维自动化移动的成像平台上,程序控制XYZ三维精确定位和定时,在线数据分析。
采用世界上单幅成像面积最大的叶绿素荧光成像系统,成像面积达35×35cm。
技术指标:1.XYZ三轴机械臂可自由移动至植物上方成像分析,成像扫瞄面积范围60cm x 129cm(可选配其它大型系统),植物高度49cm,镜物距25cm,Z轴最大负重30kg2.标准配置X轴活动范围0-101cm,精确度±1mm;Y轴活动范围0-72cm,精确度±1mm;Z轴活动范围0-49cm,精确度±5mm;3.叶绿素荧光成像:镜头分辨率1392x1040像素,单幅成像面积35x35cm,测量光橙色618nm,橙色和白色双波长光化学光,饱和光闪为白色,最大光强3600μmol/m2/s,具735nm红外光源4.叶绿素荧光成像测量参数包括Fo, Fm, Fv,Fo’, Fm’,Fv’, Ft,Fv/Fm, Fv’/Fm’,Phi_PSII, NPQ, qN,qP, Rfd等几十个叶绿素荧光参数5.RGB成像分析测量参数包括:1)叶面积(Leaf Area: Useful for monitoring growth rate)2)植物紧实度/紧密度(Solidity/Compactness. Ratio between the area covered by theplant’s convex hull and the a rea covered by the actual plant)3)叶片周长(Leaf Perimeter: Particularly useful for the basic leaf shape and widthevaluation (combined with leaf area))4)偏心率(Eccentricity: Plant shapeestimation, scalar number, eccentricityof the ellipse with same secondmoments as the plant (0...circle, 1...linesegment))5)叶圆度(Roundness: Based on evaluatingthe ratio between leaf area andperimeter. Gives information about leafroundness)6)叶宽指数(Medium Leaf Width Index: Leafarea proportional to the plant skeleton(i.e. reduction of the leaf to linesegment))7)叶片细长度SOL (Slenderness of Leaves)8)植物圆直径(Circle Diameter. Diameter of a circle with the same area as the plant)9)凸包面积(Convex Hull Area. Useful for compactness evaluation)10)植物质心(Centroid. Center of the plant mass position (particularly useful for theeccentricity evaluation))11)节间距(Internodal Distances)12)生长高度(Growth Height)13)植物三维最大高度和宽度(Maximum Height and Width of Plant in 3 Dimensions)14)相对生长速率(Relative growth rate)15)叶倾角(Leaf Angle)16)节叶片数量(Leaf Number at Nodes)17)其它参数如用于植物适合度估算的颜色定量分级、绿度指数(Other parameters suchas color segmentation for plant fitness evaluation, greening index and others)6.高灵敏度RGB成像传感器,CMOS 1/2”,分辨率2560x1920像素,像素大小2.2μm,四个LEDs高强白色光源,成像信息包括时间和位置,纪录格式为日期-月份-年度-小时-分钟-秒-Pos_X_Y_Z.bmp7.系统控制与数据采集分析系统:用户友好的图形界面,用户定义、可编辑自动测量程序(protocols),控制单元有主电源开关、紧急关闭、XYZ三维轴启动开关、暂停键、移动键等,用户名和密码保护8.程序控制XYZ三维精确定位和定时,并纪录带时间和三维空间位置的数据(四维信息数据)9.三相电源供电,3x230/220VAC,50/60Hz10.大小规格200cm(长)x150cm(宽)x230(高),重量约400kg产地:欧洲。

FluorCam叶绿素荧光成像技术应用案例(第二期)——藻类研究中的应用PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术与CCD技术结合在一起,研制成功了FluorCam叶绿素荧光成像技术(Nedbal等,2000),并于1997年为美国华盛顿大学提供了第一台商业FluorCam系统。
FluorCam叶绿素荧光成像技术成为上世纪90年代叶绿素荧光技术的重要突破,使科学家们对光合作用与叶绿素荧光的研究正式进入了二维世界和显微世界。
目前FluorCam叶绿素荧光成像技术已成为世界上最权威、使用最广、种类最全面、发表论文最多的叶绿素荧光成像技术,已经发展出FluorCam便携式叶绿素荧光成像仪、FluorCam便携式Chl/GFP荧光成像仪(Handy GFPCam)、FluorCam便携式光合联用型叶绿素荧光成像系统、FluorCam封闭式叶绿素荧光成像系统、FluorCam封闭式Chl/GFP荧光成像系统(Closed GFPCam)、FluorCam封闭式多光谱荧光成像系统、FluorCam开放式标准版叶绿素荧光成像系统、FluorCam开放式大型版叶绿素荧光成像系统、FluorCam开放式多光谱荧光成像系统、FKM多光谱荧光动态显微成像系统、FluorCam移动式大型版叶绿素荧光成像系统、FluorCam样带扫瞄叶绿素荧光成像系统等一系列仪器系统。
现有SCI发表参考文献近400篇,可联系Ecolab生态实验室索取或点击以下链接下载FluorCam 叶绿素荧光成像部分参考文献名录链接本期应用案例主要介绍使用FluorCam叶绿素荧光成像技术进行藻类研究的各种案例。
一、蓝藻固氮与光合放氧的关系(论文发表于Science)文献:I Berman-Frank, et al. 2001. Segregation of Nitrogen Fixation and Oxygenic Photosynthesis in the Marine Cyanobacterium Trichodesmium. science, 294: 1534-1537使用仪器技术:FKM多光谱荧光动态显微成像技术和FRRF快速重复荧光测量技术(FRRF技术介绍链接)FKM技术详细介绍链接研究内容:现代海洋中,有相当一部分固氮作用是由Trichodesmium属蓝藻完成的。
叶绿素荧光成像技术在植物生理生态学中的应用研究随着现代科学技术的不断进步,对于植物生理生态学研究的需求也越来越大,尤其是在对于植物生长发育、病虫害诊断、环境适应等方面的研究。
而叶绿素荧光成像技术作为一种新兴的技术手段,近年来在植物生理生态学的研究中得到了广泛的应用。
一、叶绿素荧光成像技术的原理叶绿素荧光成像技术是指利用荧光成像技术对植物中的叶绿素荧光进行定量分析的方法。
其原理就是利用荧光光谱分析来确定植物体内叶绿素荧光产生的数量和强度,从而反映出植物体内的光合作用效率和压力情况。
通俗地说,就是通过荧光成像技术观察植物叶片在不同光照强度下的荧光变化,进而得出植物对光合作用的响应情况。
二、叶绿素荧光成像技术的应用2.1 植物病虫害诊断通过叶绿素荧光成像技术,可以观察植物叶片在病虫害感染后的荧光变化,进而对植物的受损程度进行定量分析,早期发现病虫害的征兆,提高诊断的准确度和敏感度,有利于及时采取措施进行防治。
2.2 植物的光合作用效率研究光合作用是植物生物体能量的来源,因此对于光合作用的研究也是植物生理生态学的一个重要研究领域。
叶绿素荧光成像技术可以通过观察绿色叶片的荧光亮度和分布,推断出植物对光的捕捉效率、光合作用初级产物的合成速率和光能量在植物体内的利用效率等各项指标,为光合作用研究提供有力的方法和手段。
2.3 植物环境适应性研究植物的生长发展很大程度上受到环境因素的影响,因此对于植物的环境适应性研究也是植物生理生态学的研究重点之一。
通过叶绿素荧光成像技术观察植物在极端环境下(如干旱、寒冷等)的荧光变化,可以研究植物的光应激响应机制以及对于环境胁迫的响应适应能力,有利于探索植物的生态适应性和遗传改良。
三、技术手段的不断创新和完善叶绿素荧光成像技术的应用价值不容小觑,而随着技术手段的完善和创新,其应用领域将越来越广泛。
例如,目前已经研制出了基于无人机和航空拍摄技术的叶绿素荧光成像系统,可以对大规模植物群落的荧光响应进行高效快速的采集和分析。
叶绿素荧光成像技术在植物生理学中的应用叶绿素荧光成像技术是一种研究植物光合作用的重要手段。
本文将介绍这种技术的原理、应用以及未来发展方向。
一、叶绿素荧光成像技术原理叶绿素是植物进行光合作用的关键物质。
当植物叶片受到光照后,叶绿素会吸收光能并转化为化学能,也就是光合作用。
叶绿素荧光指的是叶绿素吸收光能后发出的荧光。
荧光的强度和叶绿素的光合作用效率密切相关。
荧光强度越强,说明光合作用效率越低。
荧光强度越弱,说明光合作用效率越高。
因此,测量荧光强度可以反映植物的光合效率。
叶绿素荧光成像技术是一种非侵入性的手段,可以通过成像仪器记录植物叶片荧光发射的亮度和分布情况,从而获得各个部位光合作用效率的信息。
二、叶绿素荧光成像技术在植物生理学中的应用1.测量植物叶片光合作用效率叶绿素荧光成像技术可以提供植物叶片光合作用效率的空间分布图。
不同区域的荧光强度反映了不同区域光合作用效率的差异。
这些差异可以有针对性的通过调节环境条件、育种培育等手段解决。
2.分析植物的光捕捉能力植物的光能捕捉能力是影响光合作用效率的关键因素之一。
通过叶绿素荧光成像技术,可以直接观察植物叶片的光合量和荧光强度的关系,从而分析植物的光捕捉能力。
3.研究植物光合作用途径叶绿素荧光成像技术可以直观的反映出不同光途径在不同环境下对植物光合作用的影响。
比如,光合作用和呼吸作用的竞争关系、非光合作用和日夜变化等外界因素的影响等。
三、未来发展方向叶绿素荧光成像技术在植物生理学中的应用前景十分广阔。
随着技术的不断发展和提高,将推动该技术在植物医学、生态学以及工业生产等领域得到更广泛的应用。
应用方面:将进一步在自然环境下对植物群体的生物量与CO2吸收进行准确测量,获得植物采样数据,并对注水实验等进行跟踪、监测等。
技术方面:将进一步探索光谱激发和组合,开发使用更广泛更灵敏的荧光标记物和探头,比如调控引物、基因编辑、CRISPR/Cas等。
总之,叶绿素荧光成像技术在植物生理学中的应用前景广阔,将为植物生态学研究、农业生产、环境保护等方面提供强大的技术支持。
叶绿素荧光技术在植物研究中的应用
叶绿素是植物体内最常见的类胡萝卜素,是一种能够捕获太阳光能并将其转化
为生物能的重要物质。
然而,叶绿素不仅仅是一个抓光能的工具,它同时也是一种复杂的生化分子,可以为研究者提供进一步了解植物生长和发育的重要线索。
而叶绿素荧光技术,可以有效地利用叶绿素的这种特性,为植物研究提供了另一种高效、无创的工具。
叶绿素荧光技术,顾名思义,就是利用叶绿素发出的荧光来探究植物体内一些
生理和生化过程的变化。
具体来说,叶绿素在吸收光能后,会发生光合作用,这个过程中会释放出荧光。
事实上,荧光并不是植物生长和发育过程中的一个“附属产物”,而是由于叶绿
素不同的荧光光谱带来的。
这种荧光的发出方式和叶绿素的结构、环境、状态等因素都有着密切关系。
因此,研究叶绿素荧光的物理和化学特性,可以使我们更好地理解叶绿素在植物生长和发育过程中的作用及其受到的影响,有助于进一步揭示植物这个复杂生态系统的内在机制。
同时,通过叶绿素荧光技术可以获取到各种生理生化指标,如叶片的净光合速率、光抑制水平、抗氧化能力等等,从而对植物进行全面评价和监测。
除此之外,叶绿素荧光技术在环境监测和病理诊断等领域也有着广泛的应用。
随着植物研究的不断深入,叶绿素荧光技术必将为我们的研究带来更加丰富、全面的结果和新的突破。
总的来说,叶绿素荧光技术在植物研究和工程应用中有着广泛的应用前景。
在
未来的研究中,我们可以进一步深入研究叶绿素荧光的物理和化学特性,使其成为一项更加全面、更加精确的分析方法,为研究植物生长和发育的内在机制、遗传遗传变异和环境反应等问题提供有力的支持。
植物叶绿素荧光成像技术在国内的应用(第四期)植物叶绿素荧光成像技术作为最早实用化的叶绿素荧光成像技术,是目前世界上最权威、使用范围最广、种类最全面、发表论文最多的叶绿素荧光成像技术。
涵盖了从叶绿体、单个细胞、微藻到叶片、果实、花朵,乃至整株植物和植物灌层,几乎可以测量所有的植物样品,甚至包括含有叶绿素的微生物和动物。
叶绿素荧光成像技术最早在21世纪初引进到国内,但一直到2010年后国内的科学家才在国际交流中逐渐发现这项技术的巨大价值,在短短数年中也利用这一技术发表了几十篇高水平SCI 文献。
本期主要介绍目前叶绿素荧光成像技术在国内的应用情况。
一、 植物光合生理研究叶绿素荧光可以直接反应植物光系统的生理状况,因此从叶绿素荧光技术发明之初,就被用于各种植物光合生理研究。
山东农科院使用FluorCam 叶绿素荧光成像技术研究了小麦旗叶与外露花梗光合能力的差异[1]。
研究中发现在小麦生长前中期,旗叶与外露花梗的最大光化学效率Fv/Fm 和量子产额ΦPSII 基本相同。
但在生长后期,旗叶的光合能力显著下降,而花梗光合能力的下降幅度要小于旗叶(图1)。
这证明了在生长后期的灌浆期,花梗对维持籽粒的生长更为重要。
之后,他们又研究了小麦叶片和颖片季节衰老过程中以及颖果发育过程中光合特性的变化[2;3,图2]。
图2. 不同生长期小麦叶片和颖片的最大光化学效率Fv/Fm (A )、量子产额ΦPSII (B )和非光化学淬灭NPQ (C )的变化图1. 不同生长阶段的旗叶(A ,C )和外露花梗(B ,D )的Fv/Fm (A ,B )和ΦPSII (C ,D )典型叶绿素荧光成像图二、植物生物/非生物逆境胁迫与抗逆性研究由于几乎所有种类的生物/非生物逆境胁迫都会影响到植物光合系统的正常生理功能,而叶绿素荧光技术是公认的植物逆境光合功能研究最灵敏的无损探针。
因此通过叶绿素荧光成像技术不但能反映植物受胁迫程度和抗逆能力的差异,而且能指明胁迫影响光合系统的具体机理过程。
叶绿素荧光成像技术在植物科学中的应用叶绿素荧光成像技术,在植物科学中有着广泛的应用。
它是通过观察植物的叶片荧光来研究植物的生长、代谢和适应环境的能力。
这一技术不仅为科学家提供了更直观的方式来观察植物的状态,也为研究植物适应环境的机制提供了更多的线索。
叶绿素是植物细胞中重要的光合色素,是进行光合作用的关键物质。
在光合作用过程中,光子被吸收后会激发叶绿素分子中的电子,而这些电子最终被用于光合作用的反应中。
但是,光子被吸收而不能被利用的情况也时常发生。
这些没能被利用的光子会导致一些副作用,产生荧光。
因此,可以通过观察荧光情况来了解植物叶片的光合作用状况。
叶绿素荧光成像技术是一种非常值得肯定的技术。
在科学研究和生产实践中,它有着广泛的应用。
叶绿素荧光成像技术可以帮助科学家了解植物的生长状况,并为生产实践提供更好更有效的生产措施。
叶绿素荧光成像技术的应用在于,它可以全面地观察植物叶片的光合作用状态和适应环境的机制。
通过这种技术我们可以了解植物在过程中被怎样的光照射下,能否将光子完全吸收转化为电子能,进而提高植物的光合稳定性和生长速度。
同时,这种技术还可以用于检测植物在恶劣环境下的自我保护机制。
在这种情况下,叶绿素荧光成像技术可以用来解析植物适应环境的机制,以及它们所表现的生理和生化变化。
叶绿素荧光成像技术可以广泛应用于植物生长、光能转化和水分蒸发研究等方面。
以植物生长为例,叶绿素荧光成像技术可以观察植物的叶片生长速率、叶片内部结构与硬度等,以此来监控植物生长状态,评定植物的健康程度。
而在光能转化方面,叶绿素荧光成像技术可以研究植物光合作用的多个阶段,以判断光合作用能否正常进行,从而提高植物的光合稳定性。
在水分蒸发方面,叶绿素荧光成像技术可以帮助研究者研究植物的蒸腾作用,使其有助于理解植物的生长、供水和环境变化等方面的生长特点。
总结一下,叶绿素荧光成像技术具有非常广泛的应用价值。
它在植物科学研究中起着重要的作用,其主要是用于研究植物生长过程中所表现的抗逆性、适应性和韧性等方面。
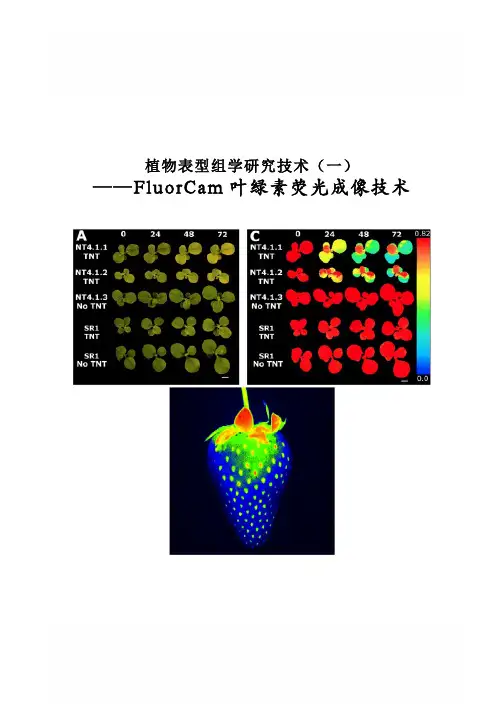
植物表型组学研究技术(一) ——FluorCam叶绿素荧光成像技术FluorCam叶绿素荧光成像技术Rousseau等(High throughput quantitative phenotyping of plant resistance using chlorophyll fluorescence image analysis.Plant Methods, 2013, 9:17),利用FluorCam开放式叶绿素荧光成像系统作为高通量表型分析平台,采用图像阈值分割等分析方法,对植物病原体感染进行了定量分析检测,根据Fv/Fm将感染分为不同阶段/等级,特别是可以将用其它方法难以分辨出来的感染前期加以分辨,并对5个品种的菜豆对普通细菌性疫病的抗性进行了定量分析评价。
PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术(Pulse Amplitude Modulated technique——脉冲调制技术)与CCD技术结合在一起,于1996年在世界上成功研制生产出FluorCam叶绿素荧光成像系统(Heck等,1999;Nedbal等,2000;Govindjee and Nedbal, 2000)。
FluorCam叶绿素荧光成像技术成为上世纪90年代叶绿素荧光技术的重要突破,使科学家对光合作用与叶绿素荧光的研究一下子进入二维世界和显微世界,广泛应用于植物生理生态、植物胁迫与抗性监测、作物育种、植物表型分析等。
不同于其它成像分析技术,FluorCam叶绿素荧光成像只对叶绿素荧光波段敏感,可以有效避免环境光的干扰,特异性、高灵敏度反映植物生理生态状况。
主要功能特点如下:1)高灵敏度CCD,时间分辨率可达50帧/秒,有效抓取叶绿素荧光瞬变;可选配高分辨率CCD,分辨率1392x1040像素,用于气孔功能成像分析、稳态荧光如GFP荧光测量等2)具备完备的自动测量程序(protocol),可自由对自动测量程序进行编辑:a)Fv/Fm:测量参数包括Fo,Fm,Fv,QY等b)Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数c)荧光淬灭分析:Fo,,Fm,Fp,Fs,Fv,QY,ΦIINPQ,Qp,Rfd,qL等50多个参数d)光响应曲线LC:Fo,Fm,QY,QY_Ln等荧光参数e)PAR吸收f)GFP等静态荧光测量g)OJIP与JIP-test(FKM与封闭式荧光成像系统):Fo,Fj,Fi,P 或Fm,Mo(OJIP曲线初始斜率)、OJIP固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等26个参数3)自动重复实验功能,可无人值守自动循环完成选定的实验程序,重复次数及间隔时间客户自定义,成像测量数据自动按时间日期存入计算机4)FluorCam成像分析软件:具在线功能(Live)、实验程序选配功能(Protocols)、成像预处理功能(Pre-processing)及成像分析结果展示报告功能(Result)四大功能模块a)在线功能(live):可对仪器和样品进行在线测试调试、快照、显示实验进度、在线显示荧光瞬变动态视频等b)实验程序选配功能(protocols):可选配不同的实验程序,并可对实验程序进行编辑、设置、储存(以备以后使用同样的实验程序)等c)成像预处理功能:可浏览整个测量视频及任何点、任何区域的荧光动态变化曲线,可进行“选区操作”或“分级操作”(图像阈值分割功能);选区操作可对成像进行自动或手动选区(ROI),还可使用“模具”包括多孔板模具、培养皿模具、桌面模具进行模具选区;分级操作具备荧光强度刻度标尺和四个“游标”,通过移动4个游标可以将成像按不同强度划分成不同的荧光范围组进行分析处理,可设置不同的阈值进行图像阈值分割d)结果展示报告功能:可展示所有选区(ROI)的叶绿素荧光参数值及其图像、每个参数的频率直方图及每个ROI的荧光动态图等,可对原数据(kinetic)、叶绿素荧光参数等导出到excel表,还可对每个参数成像图存储成位图5)数据分析具备“信号计算再平均”模式(算数平均值)和“信号平均再计算模式”两种功能模式,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式以过滤掉噪音带来的误差FluorCam叶绿素荧光参数:参数符号概念描述Size 面积(像素值),经校准可测量实际面积Fo 暗适应后的最小荧光Fo_Dn 暗松弛最小荧光,红外光诱导PSIFo_Ln 光适应后的最小荧光,红外光诱导PSIFo_Lss 光适应后稳态最小荧光,红外光诱导PSIFm 暗适应后最大荧光Fm_Dn 暗松弛最大荧光Fm_Ln 光适应最大荧光Fm_Lss 光适应稳态最大荧光Fp Kautsky诱导效应最大荧光Ft_Dn 暗松弛即时荧光Ft_Ln 光适应即时荧光Ft_Lss 光适应稳态荧光Fv Fm-FoNPQ_Dn 暗松弛非光化荧光淬灭,=(Fm-Fm_Dn)/Fm_DnNPQ_Ln 光适应非光化荧光淬灭,=(Fm-Fm_Ln)/Fm_LnNPQ_Lss 稳态非光化荧光淬灭,=(Fm-Fm_Lss)/Fm_LssqP_Dn 暗松弛光化学荧光淬灭,=(Fm_Dn−Ft_Dn)/Fm_Dn−Fo_DnqP_Ln 光适应光化学淬灭,=(Fm_Ln−Ft_Ln)/(Fm_Ln−Fo_Ln)qP_Lss 稳态光适应光化学淬灭,=(Fm_Lss−Ft_Lss)/(Fm_Lss−Fo_Lss)qL_Ln 基于“Lake”模型的光适应光化学淬灭qL_Lss 基于“Lake”模型的稳态光适应光化学淬灭QY_Dn 暗松弛光量子效率,=(Fm_Dn−Ft_Dn)/Fm_DnQY_Ln或ΔF/Fm 光适应光量子效率,=(Fm_Ln−Ft_Ln)/Fm_LnQY_Lss 稳态光量子效率,=(Fm_Lss−Ft_Lss)/Fm_LssFv/Fm或QY_max 最大光量子效率Fv/Fm_Ln 光适应光量子效率,=(Fm_Ln−Fo_Lss)/Fm_LnFv/Fm_Lss 稳态光量子效率,=(Fm_Lss−Fo_Lss)/Fm_LssRfd_Ln 光适应荧光衰减率,用于评估植物活力,=(Fp−Ft_Ln)/Ft_LnRfd_Lss 稳态荧光衰减率,用于评估植物活力,=(Fp−Ft_Lss)/Ft_Lss除上述叶绿素荧光参数外,还可以成像测量PAR吸收、植物光谱反射指数NDVI等,叶片大小(或植物大小)可以反映植物的生长等。
FluorCam叶绿素荧光成像技术仪器系统:1.FluorCam便携式光合联用叶绿素荧光成像系统:可与LCProSD光合仪、Licor6400光合仪等联用2.FluorCam便携式叶绿素荧光成像系统:成像面积3.5x3.5cm,具暗适应叶夹及多功能轻便三脚架,主机重量不足2kg,高度集成、高度便携、高性价比,可用于实验室或野外测量和监测,是便携性植物表型分析的最佳选择。
可同时选配FluorPen手持式叶绿素荧光仪用于测量OJIP等3.FluorCam便携式Chl/GFP荧光成像系统:为便携式荧光成像系统的扩展版,可同时进行叶绿素荧光成像分析和GFP绿色荧光蛋白成像分析,不仅可用于2D叶绿素荧光成像分析,还可以用于作物育种转基因绿色荧光蛋白标记检测等4.FluorCam封闭式叶绿素荧光成像系统:LED光源、CCD荧光监测镜头、控制单元等集成于暗适应操作箱内形成一个完整的主机系统,是世界上唯一可进行QA再氧化动力学和OJIP测量分析的叶绿素荧光成像系统,封闭式操作箱还可用于植物光培养(光强、光质可调)成像面积13x13cm。
下图为OJIP成像分析结果5.FluorCam封闭式Chl/GFP荧光成像系统:为封闭式叶绿素荧光成像系统的扩展版,可同时进行叶绿素荧光成像分析和GFP绿色荧光蛋白成像分析,成像面积为13x13cm6.FluorCam开放式叶绿素荧光成像系统:模块式,具备高度可扩展性,可自由选配不同的激发光源及相应滤波器以对叶绿素荧光动态及稳态荧光(如GFP等)等进行成像分析,镜头高度可调,标准配置成像面积13x13cm,大型版成像面积可达20x20cm7.FKM多光谱荧光动态显微成像与光谱分析系统:多激发光、多光谱荧光成像与光谱分析,可对叶绿素荧光动态、QA再氧化、OJIP快速荧光动力学进行显微成像分析和光谱分析,还可对GFP荧光、细胞荧光染色等进行显微成像分析,是植物细胞和亚细胞水平上最强有力的表型分析平台8.Fluorcam移动式大型叶绿素荧光成像系统:大型叶绿素荧光成像平台安装在具轮子的支架上,方便移动,成像平台可上下移动以适于不同高度的植物,成像面积达35x35cm,可选配RGB真彩成像分析和GFP绿色荧光蛋白成像检测9.FluorCam样带扫瞄式叶绿素荧光成像系统:大型成像平台可在100-500cm的支架上对样带进行扫瞄成像,标配扫瞄区域长度为400cm,成像平台可沿样带精确定位自动扫瞄,可选配RGB真彩扫瞄成像,从而实现叶绿素荧光成像和真彩成像分析10.FluorCam多光谱荧光成像系统:属多激发光、多光谱荧光成像系统,不仅可对叶绿素荧光进行成像分析,还可对UV紫外光激发F440(蓝色荧光)、F520(绿色荧光)、F690(红色荧光)和F740(红外荧光)进行成像分析用于全方位研究检测植物胁迫与抗性,有标准配置、扩展配置和大型配置3种型号案例1: 北京市土壤种子库萌发23天后的叶绿素荧光成像分析。
左图为Rfd,右图为采用FluorCam图像阈值分割方法特异性选择土壤表面的藻类(彩色部分)叶绿素荧光成像(数据来源为Ecolab实验室)案例2: 芦荟干旱胁迫叶绿素荧光成像分析,其中蓝色为干旱胁迫状态,红色为浇水后24小时(数据来源为Ecolab 实验室)案例3: 菜豆对敌草隆(Diuron)吸收过程叶绿素荧光成像(图片来源:Hartmut等,Uptake of diuron and concomitant loss of photosynthetic activity in leaves as visualized by imaging the red chlorophyll fluorescence.Photosynth Res. (2013) 116:355-361)0 0.20.40.60.8 1 QY_maxFv/Fm_L1Fv/Fm_L2 Fv/Fm_L3 Fv/Fm_L4Fv/Fm_LssFv/Fm_D1 Fv/Fm_D2 Fv/Fm_D3QY_L1QY_L2QY_L3QY_L4QY_Lss QY_D1 QY_D2 QY_D3 00.1 0.20.3 0.4 NPQ_L1 NPQ_L2 NPQ_L3 NPQ_L4NPQ_Lss NPQ_D1NPQ_D2 NPQ_D3qN_L1qN_L2qN_L3qN_L4 qN_Lss qN_D1 qN_D2 qN_D3案例4: 紫露草叶绿素荧光参数成像(左)及其实验叶片部分频率直方图(中)和在正常空气中的叶尖部分频率直方图(右):A为为干燥脱水、低氧(2%)、正常CO2(350ppm),D为干燥脱水2小时、低氧、正常CO2,G为干燥脱水2小时、低氧、高浓度CO2(5%)。