酸碱滴定管的使用练习题
- 格式:docx
- 大小:13.61 KB
- 文档页数:1

酸碱中和滴定练习一、滴定实质1. 酸碱完全中和时()A.酸与碱的物质的量一定相等B.酸所能提供的H+和碱所能提供的OH-的物质的量相等C.酸与碱的质量相等D.溶液呈中性2.物质的量浓度相同、体积也相同的一元酸和一元碱相互中时,溶液()A.显酸性B.显碱性C.显中性D.酸碱性无法判断3. 下列溶液一定是碱性的是( )A.溶液中c(OH-)>c(H+)B.滴加甲基橙后溶液显红色C.溶液中含有OH-D.滴加甲基橙后溶液显黄色二、仪器和药剂的判断1. 有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管中的溶液全部流下排出,盛接在量筒中,量筒内溶液的体积()A. 大于40.0 mLB.为40.0 mLC.小于40.0 mLD.为10.0 mL2. 在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为()A.5mLB.20mLC.大于5mLD.小于5mL3. 有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是()A. a mLB.(50―a)mLC. 大于(50―a)mLD. 大于a mL4. 准确量取25.00mL高锰酸钾溶液,可选用的仪器是()A.50mL量筒B.10mL量筒C.50mL酸式滴定管D.50mL碱式滴定管5. 下列仪器中,没有“0”刻度线的是()三、指示剂的选择练习1. 以上是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2③酚酞8.2~10,现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂()A.都可以用B.只能用③C.可以用①或②D.可以用②或③2.(08高考)实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4;石蕊:5.0~8.0;酚酞:8.2~10.0。

滴定操作基本练习一、 教学要求1. 详细讲解酸式滴定管的洗涤、检漏、涂油、漂洗、赶除气泡等操作的方法,并通过练习,使学牛止 确掌握酸式滴定管的准备过程;2•详细讲解碱式滴定管的洗涤、检漏、漂洗、赶除气泡等操作的方法,并通过练习,使学生正确掌握 碱式滴定管的准备过程;3. 详细讲解酸式和碱式滴立管的滴尬控制、读数以及摇动锥形瓶的方法,并通过练习,使学牛止确掌 握滴定操作方法;4•讲解滴处终点的判断和控制方法,通过让学/练习比较滴定使其掌握滴定终点的判断及控制方法。
5.讲解滴定分析数据记录的一般格式,要求学生掌握并使用此格式进行数据记录。
二、 预习内容1. 实验原理:滴定操作练习:农科化学实验(第二版)P164~170。
2. 滴定管的使用方法:1)酸式滴定管的准备;2)碱式滴足管的准备;3)酸式和碱式滴定管赶除气泡的方法;4)酸式和 碱式滴定管的滴定控制方法;5)滴定管的读数方法;6)滴定速度的调节与控制;7) —•般记录格式。
3. 实验操作内容三、 基木操作(一)认知酸式和碱式滴定管a b ca 酸式溥定管b 碱式備定管E1酸式備定管和碱式備定管(二)酸式滴定管的准备1. 洗涤:1)用洗涤剂或珞酸洗液洗涤;2) 口來水洗涤。
2. 涂油:1)取下橡皮圈和活塞;2)用吸水纸擦干活塞及活塞套;3)将滴定管平放;4)蘸取少量凡士林, 在活塞两端均匀涂一薄层;5)将活塞插入活塞套,向一个方向转动,至凡士林层完全透明为止。
/ nrk-0l=n=^J3.检漏4.漂洗5.赶除气泡:装满溶液后,右手持滴定管上部,使其倾斜30°,左手迅速打开活塞,让溶液冲出,将气泡带走(三)碱式滴定管的准备1.洗涤1)用洗涤剂或侪酸洗液洗涤;2)口来水洗涤2.检漏3.胶管及玻璃珠的更换4.漂洗5.赶除气泡:装满溶液肩,右手持滴定管上部,使其倾斜30°,左手拇指和食指捏住玻璃珠中间偏上部位,并将乳胶管向上弯1山,出口管斜向上,向一旁挤压玻璃珠,使溶液从管口流出,将气泡赴出,在轻轻使乳胶管恢复仲直,松开拇指和食指(四)滴定操作1.读数:2.滴定控制1)酸式滴定管活塞开、关的控制和碱式滴定管的开关控制2)开始前,滴定管尖嘴外悬挂溶液的处理:靠在锥形瓶的外壁3)滴定速度控制:调节活塞开孔度的大小或调节捏乳胶管的力度4)停止后,滴定管尖嘴外悬挂溶液的处理:靠在锥形瓶的内壁5)锥形瓶的摇动:右手持锥形瓶,并摇动使溶液向一个方向旋转6)接近终点时锥形瓶洗涤:用洗瓶沿锥形瓶上部,由上向下转动冲洗,并控制用水量不能太多。

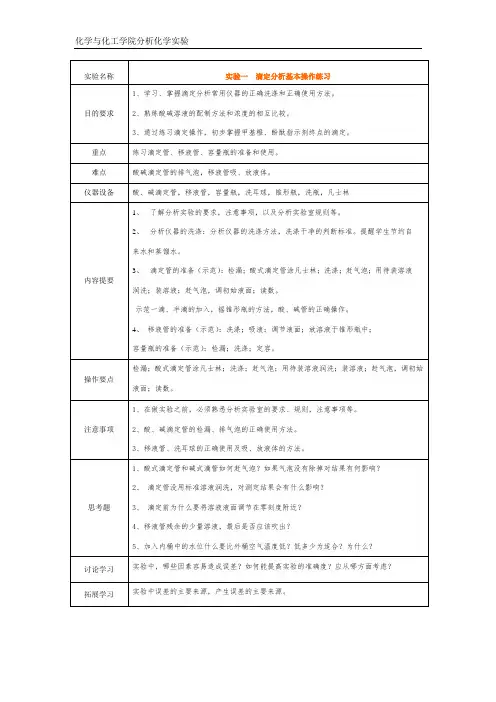
化学与化工学院分析化学实验实验名称实验一滴定分析基本操作练习目的要求1、学习、掌握滴定分析常用仪器的正确洗涤和正确使用方法。
2、熟练酸碱溶液的配制方法和浓度的相互比较。
3、通过练习滴定操作,初步掌握甲基橙、酚酞指示剂终点的滴定。
重点练习滴定管、移液管、容量瓶的准备和使用。
难点酸碱滴定管的排气泡,移液管吸、放液体。
仪器设备酸、碱滴定管,移液管,容量瓶,洗耳球,锥形瓶,洗瓶,凡士林内容提要1、了解分析实验的要求,注意事项,以及分析实验室规则等。
2、分析仪器的洗涤:分析仪器的洗涤方法,洗涤干净的判断标准。
提醒学生节约自来水和蒸馏水。
3、滴定管的准备(示范):检漏;酸式滴定管涂凡士林;洗涤;赶气泡;用待装溶液润洗;装溶液;赶气泡,调初始液面;读数。
示范一滴、半滴的加入,摇锥形瓶的方法,酸、碱管的正确操作。
4、移液管的准备(示范):洗涤;吸液;调节液面;放溶液于锥形瓶中;容量瓶的准备(示范):检漏;洗涤;定容。
操作要点检漏;酸式滴定管涂凡士林;洗涤;赶气泡;用待装溶液润洗;装溶液;赶气泡,调初始液面;读数。
注意事项1、在做实验之前,必须熟悉分析实验室的要求、规则,注意事项等。
2、酸、碱滴定管的检漏、排气泡的正确使用方法。
3、移液管、洗耳球的正确使用及吸、放液体的方法。
思考题1、酸式滴定管和碱式滴管如何赶气泡?如果气泡没有除掉对结果有何影响?2、滴定管没用标准溶液润洗,对测定结果会有什么影响?3、滴定前为什么要将溶液液面调节在零刻度附近?4、移液管残余的少量溶液,最后是否应该吹出?5、加入内桶中的水位什么要比外桶空气温度低?低多少为适合?为什么?讨论学习实验中,哪些因素容易造成误差?如何能提高实验的准确度?应从哪方面考虑?拓展学习实验中误差的主要来源,产生误差的主要来源。

滴定实验专题练习班级___________ 姓名__________一、把握酸碱中和滴定的“五考”1.“考”实验仪器酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。
其中常考的是滴定管,如正确选择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。
2.“考”操作步骤(1)滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)、调液面、读数;(2)注定:移液、滴加指示剂、滴定至终点、读数;(3)计算。
3.“考”指示剂的选择(1)强酸强碱相互滴定,可选用甲基橙或酚酞;(2)若反应生成的强酸弱碱溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞)。
(3)石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。
4.“考”误差分析写出计算式,分析操作对V标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背结论。
此外对读数视线问题要学会画图分析。
5.“考”数据处理实验中测量酸或碱的体积要平行做2~3次滴定,取体积的平均值求算未知溶液的浓度,但对于“离群”数据(指与其他数据有很大差异的数据)要舍弃,因为数据“离群”的原因可能是操作中出现了较大的误差。
滴定操作不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应,NaOH、Na2CO3混合溶液与盐酸的反应及沉淀反应。
1.氧化还原滴定法(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性、但能与某些还原剂或氧化剂反应的物质。
(2)试剂:常用于滴定的氧化剂有KMnO4、K2Cr2O7等;常用于滴定的还原剂有亚铁盐、草酸、维生素C 等。
指示剂选择:氧化还原滴定法的指示剂有三类。
①氧化还原指示剂;②专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝;③自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅粉红色。


酸碱中和滴定练习题【1】及答案一、酸碱中和反应的概念定义:用已知________ 酸(或碱)来测定 ___________物质的量浓度的碱(或酸)的方法.二、指示剂(1)用已知浓度的强酸滴定未知浓度的强碱时若选用_酚酞,溶液由_________色变__________色.(2)用已知浓度的强碱滴定未知浓度的强酸时若选用_酚酞,溶液由_________色变__________色.三、酸碱中和滴定的原理:(1)中和反应的实质: _______________________________(2)中和反应中量的关系:________________________________四、中和滴定的误差分析(用标准液滴定待测液,待测液放在锥形瓶中)(1)装标准液的滴定管未用标准液润洗,则测得待测液的浓度偏______(2)装待测液的滴定管未用待测液润洗, 则测得待测液的浓度偏______(3)锥形瓶用待测液润洗,则测得待测液的浓度偏_____(4)滴定过程中锥形瓶中有少量待测溶液溅出则测得待测液的浓度偏______(5)在酸碱中和滴定中润洗滴定管的目的是 ___________________五、选择题(基础)1、把PH=3 ([H+]=0。
001mol/L)的H2SO4和PH=10的NaOH溶液混合,如果混合液的PH=7,则H2SO4和NaOH溶液的体积比是A. 1:1 B、 1:10 C、1:2 D、1:202、混合0.1mol/L盐酸和0.05mol/L氢氧化钡溶液,配制成200mlPH=11的溶液,所需盐酸的体积是A、 9.9mlB、10.1mlC、99mlD、101ml3、要准确量取25.00ml的稀盐酸,可用的仪器是A、25ml的量筒B、25ml的酸式滴定管C、25ml的碱式滴定管D、25ml的烧杯4、中和滴定时,用于量取待测液体积的仪器是A、烧杯B、量筒C、滴定管D、胶头滴管5、用标准浓度的氢氧化钠溶液来滴定末知浓度的盐酸,在滴定操作时,盐酸应放在A、锥形瓶中B、烧杯中C、滴定管中D、量筒中6、进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是A、锥形瓶B、酸式滴定管C、碱式滴定管D、移液管7、下列仪器中,没有“0”刻度线的是A、量筒B、温度计C、酸式滴定管D、托盘天平游码刻度尺8、在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是A、参加反应的酸和碱的物质的量相等B、参加反应的酸中氢离子的总量和碱中氢氧根离子的总量相等C、反应后,混合液PH=79、中和滴定时需要润洗的仪器有A、滴定管B、锥形瓶C、烧杯D、移液管10、下列有关滴定的操作正确的顺序是①用标准液润洗滴定管②往滴定管中注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤A、⑤①③②④B、③⑤①②④C、⑤②③①④D、②①③⑤④11、下列几种情况,对中和滴定结果无影响的是A、滴定管用水冲洗后即注入标准液B、滴定管尖端末充满液体C、滴定前标准液在“0”刻度以上D、锥形瓶里有少量水一、选择题(每小题4分,共40分。

酸碱中和滴定一、选择题(共12题)1.刻度“0”在上方的用于测量液体体积的仪器是()A.滴定管B.移液管C.量筒D.烧杯2.如果将25 mL液体注入25 mL的酸式滴定管中,则液面的位置() A.恰好在“0”刻度处B.恰好在25 mL刻度处C.接近25 mL刻度处D.接近“0”刻度处3.用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,使用酚酞作为指示剂,下列叙述中说明恰好达到滴定终点的是()A.由红色变为深红色B.由无色变为深红色C.由浅红色变成深红色D.由无色变为浅红色4.下列有关化学实验的叙述正确的是()A.用待测液润洗滴定用的锥形瓶B.一定不能用标准液润洗滴定用的滴定管C.用稀盐酸洗涤盛放过石灰水的试剂瓶D.NaOH溶液保存在带玻璃塞的试剂瓶中5.现用0.10 mol·L-1 HCl溶液滴定10 mL 0.05 mol·L-1 NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是()A.10 mL B.5 mLC.大于5 mL D.小于5 mL6.向盛有10 mL NaOH溶液的烧杯中逐滴滴加稀盐酸,下列图象能够体现溶液的pH变化情况的是()7.下列与滴定实验有关的说法中正确的是()A.用NaOH滴定盐酸时,只能用酚酞作指示剂B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂C.用滴定管准确量取20.0 mL盐酸D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高8.下列有关中和滴定的操作:①用标准液润洗滴定管;②向滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是()A.③⑥①②⑤④B.⑤①②⑥④③C.⑤④③②①⑥D.③①②④⑤⑥9.(双选)用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是()A.配制标准溶液的固体KOH中混有NaOH杂质B.滴定终点读数时,俯视滴定管的刻度,其他操作正确C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液10.用1.0 mol·L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH 溶液的体积V关系如图所示。

酸碱滴定法习题一、判断题:1.用0.01mol·L-1HCl标液滴定0.01mol·L-1NaOH溶液至甲基橙变色时,终点误差为正误差。
( )2.用0.1mol·L-1HCl标液滴定0.1mol·L-1NaOH溶液至甲基橙变色时,终点误差为负误差。
( )3.酸碱滴定突跃范围的大小与酸碱的强弱无关。
( )4.用0.01mol·L-1HCl标准溶液滴定0.01mol·L-1NaOH溶液,应该用甲基橙作指示剂。
( )5.酸碱滴定中,由于K a或K b过小而不能直接滴定的酸碱,也不能用返滴定法滴定。
( )6.用0.1mol·L-1NaOH滴定同浓度的HCl,以甲基橙为指示剂时,其终点误差是正误差。
( )7.往20mL0.1mol·L-1的HAc溶液中滴加19.98mL 0.1mol·L-1NaOH时,溶液呈碱性。
( )8.若滴定剂和被测物浓度减小10倍,则强酸滴定强碱的pH突跃范围减小1个pH单位。
( )9.若用因保存不当而吸收了部分CO2的NaOH标准溶液滴定弱酸,则测定结果偏高。
( )10.某弱酸型指示剂的酸色为黄色,碱色为蓝色,p K HIn=5.0。
指示剂溶液呈蓝色时,其pH>6。
( )11.用0.01mol·L-1HCl标液滴定0.01mol·L-1NaOH,用甲基橙指示剂时,终点误差为负误差。
( )12.配制NaOH标准溶液时,可用量筒取水。
( )13.可用邻苯二甲酸氢钾作基准物标定HCl溶液。
( )14.当滴定剂与被测物浓度增加10倍时,NaOH滴定HAc溶液的pH突跃范围增加1个单位。
( )15.相同浓度的HCl和HAc溶液的pH值相同。
( )16.滴定pH相同、体积也相同的HCl和HAc溶液,消耗相同量的NaOH溶液。
( )17.酸碱指示剂的实际变色范围是pH=p K a±1。


酸碱滴定法试题库(选择题)1 .某弱酸的pH=2.00,则[H+]的有效数字位数为:(B)A 1位B 2位C 3位D 4位2 .酸碱滴定法选择指示剂时可以不考虑的因素是(D)A 滴定突跃的范围B 指示剂的变色范围 C指示剂的颜色变化 D指示剂相对分子质量的大小3 .欲配制pH=9.00的缓冲溶液最好应选用(D)A NaHCO3 Na2CO3B NaH2PO4Na2HPO4C HAc NaAcD NH3.H2O NH4Cl4. 在下列叙述仪器“0”刻度位置正确的是( B )A. 在量筒的上端B. 在滴定管上端C. 在托盘天平刻度尺的正中D. 在托盘天平刻度尺的右边5. 准确量取25.00ml KMnO4溶液,可选用的仪器是( B )A. 25ml量筒B. 25ml酸式滴定管C. 25ml碱式滴定管D. 有刻度的50ml烧杯6. 下列实验中,由于错误操作导致所测出的数据一定偏低的是(D)A. 用量筒量取一定体积液体时,俯视读出的读数B. 用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值C. 测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量D. 做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值7. 酸碱中和反应属于放热反应,酸碱中和生成1mol水时所放出的热量称为中和热。
放下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是( B )A. 与NaOH反应时,HCL的中和热小于CH3COOH的中和热B. 与NaOH反应时,HCl的中和热大于CH3COOH的中和热C. 与NaOH反应时,H2SO4的中和热大于HCL的中和热D. 与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍8. 下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( A )A. 两种溶液中OH-的浓度相同B. 需要等浓度、等体积的盐酸中和C. 温度升高10℃,两溶液的pH仍相等D. 两种溶液中溶质的物质的量浓度相同9. 下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
实验三滴定分析基本操作练习与比较滴定练习一、实验目的1. 学习酸(碱)式滴定管的使用方法和滴定操作技术2. 掌握酸碱滴定终点的正确判断;通过比较滴定求出滴定终点时酸、碱溶液的体积比。
二、实验原理当酸和碱溶液反应达到等量点时,就有C H+ •V H+ = C OH—•V OH—,那么C(NaOH) / C (HCl) =V(HCl) / V (NaOH) , C(HCl) / C(NaOH)=V(NaOH) / V(HCl) 。
三、实验仪器与试剂1.仪器酸式滴定管碱式滴定管锥形瓶(250 mL)2.试剂HCl溶液(0.1 mol·L–1)NaOH溶液(0.1 mol·L–1)甲基橙指示剂(0.2 %)酚酞指示剂(0.2 %)四、实验内容1. 滴定前的准备酸管和碱管的检漏、洗涤、润洗、装液、赶气泡、调液面。
2. 滴定练习(1)由酸式滴定管中放出20.00 mL 0.1 mol·L–1HCl溶液于另一250 mL锥形瓶中,加入1滴酚酞指示剂,用0.1 mol·L–1 NaOH溶液滴定至微红色,30 s内不褪色,即为终点。
(2)由碱式滴定管中放出20.00 mL 0.1 mol·L–1 NaOH溶液于250 mL锥形瓶中,加入1滴甲基橙指示剂,用0.1 mol·L–1 HCl溶液滴定至由黄色变为橙色,即为终点。
(3)酸碱相互回滴,反复辨认终点颜色,控制好滴定速度,反复练习一滴和半滴的操作,直至熟练掌握为止。
3. 比较滴定(1)NaOH溶液滴定HCl溶液由酸式滴定管中准确放出20.00 mL 0.1 mol·L–1HCl溶液于250 mL锥形瓶中,加入1滴酚酞指示剂,用0.1 mol·L–1NaOH溶液滴定,边滴边不断摇动锥形瓶,使溶液混合均匀,当溶液从无色刚变为微红色,半分钟内不褪色,即为终点,准确记录滴定所消耗NaOH溶液的体积。
第七章酸碱滴定法练习题及答案一、单选题:1、为标定HCl溶液可以选择的基准物是------------( )(A) NaOH (B) Na2CO3(C) Na2SO3(D) Na2S2O31、HPO42-的共轭碱是-----------------------------------( )(A) H2PO4- (B) H3PO4(C)PO43- (D) OH-2、下列溶液用酸碱滴定法能准确滴定的是-( )(A) 0.1 mol/L HF (pKa = 3.18) (B) 0.1 mol/L HCN (pKa = 9.21) (C) 0.1 mol/L NaAc [pKa(HAc) = 4.74] (D) 0.1 mol/L NH4Cl[pKb(NH3) = 4.75]3、在水溶液中共轭酸碱对Ka与Kb的关系是------------------( )(A) Ka·Kb=1 (B) Ka·Kb=Kw (C) Ka/Kb=Kw (D) Kb/Ka=Kw4、浓度相同的下列物质水溶液的pH最高的是-----------( )(A) NaCl (B) NaHCO3 (C) NH4Cl (D) Na2CO35、为标定HCl溶液可以选择的基准物是------------( )(A) NaOH (B) Na2CO3(C) Na2SO3(D) Na2S2O36. 酸碱滴定中选择指示剂的原则是()(A)指示剂变色范围与化学计量点完全符合(B)指示剂应在pH =7.00时变色(C)指示剂的变色范围应全部或部分落入滴定pH突跃范围之内(D)指示剂变色范围应全部落在滴定pH突跃范围之内7、下列操作中正确的是A、用HCl滴定NaOH,以酚酞为指示剂,溶液呈粉红色为终点B、用NaOH滴定HCl,以酚酞为指示剂,溶液呈粉红色为终点C、用HCl滴定NaOH,以甲基红为指示剂,溶液呈红色为终点D、用NaOH滴定HCl,以甲基红为指示剂,溶液呈橙色为终点8、酸碱指示剂的变色范围A、pKIN ±1 B、pKIN±0.05916/n C、Ф,IN±1 D、Ф,IN±0.05916/n9、下列操作哪一种是正确的( )。
滴定分析题库技能比武试题题库一、选择题:1、滴定管的读数操作正确的是( B )A.在滴定管架上读B.拿下来两手捏住液面上方并使其自然下垂读2、酸式滴定管只能盛放酸性溶液( B )A.正确B.不正确3、酸式滴定管的活塞涂油时应当( A )A.只在两端涂一薄层B.全面都涂一薄层4、滴定开始前,尖嘴外的液滴应( A )A.靠在锥形瓶外壁B.靠在锥形瓶内壁5、滴定停止时,尖嘴外的液滴应(B )A.靠在锥形瓶外壁B.靠在锥形瓶内壁6、滴定接近终点时( A )A.应当用蒸馏水冲洗锥形瓶内壁B.不能用蒸馏水冲洗锥形瓶内壁7、用NaOH滴定酸溶液时(B )A.只能选用酚酞作指示剂B.既可用酚酞也可用甲基红做指示剂8、滴定开始时,滴定管内装液的液面( B )A.必须调整至恰好为“0”刻线B.应在“0”或“0”刻线以下9、间接碘量法是利用碘离子的()作用与()反应生成游离的碘。
( A )A.还原氧化性物质 B.氧化还原性物质10、标准溶液指的是(A)的溶液A.已知准确浓度B.已知准确体积C.已知准确质量D.使用标准物质11、我国化学试剂分为(A.B.C.D)A.优级纯B.分析纯C.化学纯D.实验试剂12、关于容量瓶的正确说法是(A.D)A.有刻度B.无刻度C.容量瓶可以用来长期存放配制好的溶液D.容量瓶不可以用来长期存放配制好的溶液13、原始记录要求(A.B.C)A.记录测定条件B.真实C.数据清楚D.经过批准14、标准物质具有(A.B.C.D)处理A.均匀性B.稳定性C.准确一致性D.通用性15、电位法的依据是(B)A、朗伯-比尔定律B、能斯特方程C、法拉第第一定律D、法拉第第二定律16、淀粉是一种 ( C )指示剂A、自身B、氧化还原型C、专属D、金属17、电位滴定与容量滴定的根本区别在于:(B)A、滴定仪器不同B、指示终点的方法不同C、滴定手续不同D、标准溶液不同18、分析工作中实际能够测量到的数字称为()。
一、填空题
1、滴定管一般分为两种:一种是,另一种是。
酸式滴定管的下端有开关,用来装和溶液,不宜盛性溶液。
碱式滴定管的下端连接,管内有以控制溶液的流出,橡皮管的下端再接一尖嘴玻璃管。
碱十滴定管主要用于装溶液,不能盛放溶液。
滴定管是滴定时准确测量标准液体积的量器,它是具有精确刻度而内径均匀的细长玻璃管,读数可估计到。
2、酸式滴定管的活塞要,且密不漏水。
一只新的滴定管或已经使用但发现漏水以及活塞转动不灵活的,都需要将活塞拆下涂。
碱式滴定管则需要更新。
3、刷洗滴定管时,尽量用自来水冲洗,或用滴定管刷蘸上肥皂水或洗涤剂,不能用。
4、酸式滴定管的使用步骤
是:、、、、、、。
5、为防止滴定液的浓度不被稀释,在装滴定液前先用将滴定管荡洗2-3次,这种过程叫。
6、滴定管读书时,对无色或者浅色溶液,读取,且视线要。
若是深颜色的,不能看到凹液面,则读取液面的。
读数要保留到小数点后。
7、酸式滴定管滴定时,手操作滴定管,用左手控制滴定管,右手摇控制活塞时左手大拇指在,食指和中指在,打开活塞时手指轻轻向里扣住。
整个操作过程中,左手一直不能离开右手一直摇动目光一直观察。
8、滴定操作时,流速不能太快,要保持,临近终点时必须
或加入,半滴的操作是有半滴溶液悬与管口,将内壁与管口相接触,使溶液流出,再用纯化水冲洗锥形瓶。
9、移液管的使用步骤是:、、。
10、使用碱式滴定管时,左手拇指在,食指在,捏住橡皮管中玻璃珠所在部位处,捏挤橡皮管,使橡皮管和玻璃珠之间形成一条缝隙,溶液即可流出。
注意不能捏玻璃珠下方的橡皮管,否则进入形成气泡。
二、问答题
1、酸式滴定管如何排气泡?
2、碱式滴定管如何排气泡?。