药物合成反应复习资料.doc
- 格式:doc
- 大小:141.54 KB
- 文档页数:9

药物合成知识点总结一、基本原理1. 药物合成的基本原理药物合成的基本原理是有机合成化学的一部分,它包括有机化学反应、合成路线设计和实验操作等方面的知识。
在药物合成的过程中,需要根据药物的结构特点和合成可行性,设计出合成路线,并通过实验操作将合成路线转化为有效的药物产物。
2. 药物结构与活性关系药物的结构与活性之间存在着密切的关系。
药物的分子结构决定了其在生物体内的作用机制和药理活性。
通过对药物结构的深入了解,可以有针对性地设计出具有特定生物活性的新型药物分子。
3. 药物合成的目标药物合成的目标是将具有一定生物活性的小分子化合物合成为具有特定药理活性的药物分子,为临床治疗提供有效的药物剂型。
药物合成需要充分考虑合成效率、合成可行性和产品纯度等因素,在实际操作中需要综合考虑各种因素,确保合成路线的稳定性和可靠性。
二、合成路线设计1. 合成路线设计的基本原则合成路线设计是药物合成的关键步骤之一。
在设计合成路线时,需要考虑多种因素,包括反应的选择、官能团的保护和去保护、合成中间体的构建等。
合成路线设计需要遵循一定的化学原则和反应规律,确保合成路线的可行性和稳定性。
2. 合成路线设计的策略在合成路线设计中,需要根据目标药物的结构特点和反应类型,确定合成路线的策略。
合成路线设计的策略包括直接合成、片段合成、立体选择性等。
通过合成路线设计的策略,可以有效地将复杂的有机分子合成为目标药物。
3. 合成路线的优化合成路线的优化是药物合成过程中的重要工作之一。
优化合成路线可以提高合成效率、减少副反应和提高产物纯度。
合成路线的优化需要结合实际操作,充分考虑反应条件、反应产物和中间体的稳定性,确保合成路线的可靠性和稳定性。
三、反应类型1. 羟基化反应羟基化反应是有机合成中常见的反应类型之一。
羟基化反应可以将烯烃、芳香化合物等转化为羟基化合物,为药物合成提供了重要的合成方法。
2. 羧基化反应羧基化反应是有机合成中的一种重要反应类型。
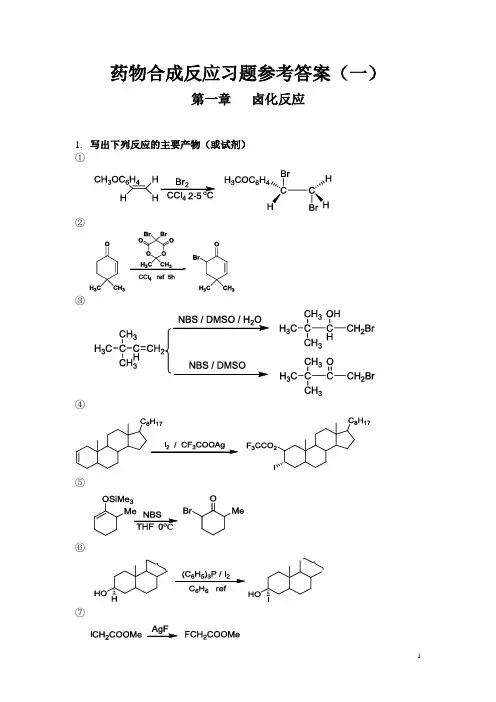
药物合成反应习题参考答案(一)第一章卤化反应1.写出下列反应的主要产物(或试剂)①②③④⑤⑥⑦⑧⑨⑩2.写出下列反应的可能产物①②③④3.写出下列反应的主要试剂及条件①②③④第二章烃化反应1. 完成下列反应①③④⑤⑥⑦⑧OH3C LDA / CH3OCH2CH2OCH3-40~0 o C, 酮过量O-Li⊕ H3C2.完成下列反应过程①②③④第三章 酰化反应1.完成下列反应①OCH 3OCH 3H 3CO +CH 3COClAlCl 3OCH 3OCH 3H 3COCOCH 3②C O 2NH OH C NHCOCHCl 2HCH 2OH +CH 3(CH 2)16COClC 6H 6C O 2N H OH C NHCOCHCl 2HCH 2OCO(CH 2)16CH 3Py③ClCH 2CONH+N SOCOOH CH 2S H 2N N NNNCH 3DCC THFN SOCOOHCH 2S N N NNCH 3SCO 2H NOCH 3ClCH 2CONHS CONH NOCH 3④CH 3CH 3(CH 2)5COClAlCl 3ClCH 2CH 2Cl, 0 o CCH 3CH 3O⑤OCH 3H 3CO H 3COH 3CO OCH 3H 3CO H 3COH 3COCHODMF/POCl 3⑥+C 6H 5N CHOPOCl 390-95 oCCHOCH 3CH 3CO C H 2C O OC 2H 5+HO140 oC 4~5hrCH 3CO C H 2C O O2.完成下列合成路线①OH OC 2H 5DMFPOCl 3OC 2H 5COClNaOH/C 2H 5BrOC 2H 5CHOOC 2H 5CONH SOH 2NCH 3CH 3CO 2NaSOCH 3CH 3CO 2Na② 以苯和丁二酸酐为起始原料合成四氢萘O OOOOH O AlCl 3Zn-Hg HCl (gas)OHO OPPAHCl (gas)Zn-Hg第四章 缩合反应1. 改错(只能改动一处)①Ph 3PCHCH 3+CHOHCH 3H HCH 3HXCH 3CH 2CH 2CCH 3O+CH 3COOC 2H 5C 3H 7H 3CCCHCOOC 2H 5XCH 3CH 2CH 2COCH 2COCH 3C 2H 5ONa③CHO+ClCH 2CO 2C 2H 5Zn +C 6H 6(C 2H 5)2OH CCHCOOC 2H 5BrCH 2CO 2C 2H 5x2. 完成下列反应式①O+NO 2CHO OH /H 2OCH 3OCH 3O 2N②OOCHCH 3H 3CHC Ph 3P=CHCH 3> 2mol③O+CH 2O (excess)Ca(OH)2H 2OOCH 2OH CH 2OHHOH 2C HOH 2C④C 6H 5CHOC H CCOOH C 2H 5C 3H 7CO 2K(C 3H 7CO)2O⑤OClCH 2CO 2CH 3CH 3ONaH 2OOH-H+OCO 2CH 3OCO 2CHO+C 6H 5CH 2CNC 6H 5H C CNC OC 2H 5O(CO 2C 2H 5)2C 2H 5ONaor C 2H 5OCO 2C 2H 5⑦(C 6H 5)3P C H 2C HCH 2OCH 2CH 2CHO CH 3C 6H 6BrNaNH 2Ph 3P=CH-CH=CH 2O CH 2CH 2CH=CH-CH=CH 2CH 3⑧H 3COOCH 3CO 2CH 3BrCH 2CO 2CH 3ZnC 6H 6(C 2H 5)2O,ref.CH 3CO 2H H 2O+H 3COCHCO 2CH 3CH 3CO 2CH 33. 完成下列合成过程 ①CCOOC 2H 5C 2H 5COOC 2H 5CH 3CH 3CH 2BrCH 2CNCH 2CO 2C 2H 5CH(CO 2C 2H 5)2C 2H 5Br/C 2H 5ONaC(CO 2C 2H 5)2C 2H 5C 2H 5ONaOC 2H 5OOC 2H 5NBSKCN1. H +/H 2O2. C 2H 5OH H 2SO 4CH 3CH 3H 2C CH 3C HCHOCH 3CH 3CH 3CHOCH 3CH 2CH(CH 3)CHOCH 3CH 3CH 3CHO H 2, Pd/CCH 3CH 2CHO NaOHCrO 2Cl 24. 填写下列各部分产物(1)H 3CCHOCH 3H 3CCHOH 3C CH 2OH H 3CCH H 3C CH 2OH OHCO 2H AB O H 3C H 3C OHOC NH 2CH 2CH 2CO 2CH 2PhCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2CH 2PhOH DH 3OCH 3H 3C CH 2OHCHCONHCH 2CH 2CO 2H OH E+ PhCH 2OHHCHO OH(2)OCOCH 3(C 2H 5)2N CH 2CH 2COCH 3CH 3CH 3ONa CH 3OH C 6H 6KOH CH 3OH/H 2O, ref.H 3O +O COCH 3COCH 3OCOCH 3Zn/BrCH 2CO 2EtH 3O +HBr KCNSOCl 2AlCl 3OHCEtO 2CCH=CHOHO 2COHLAHCN(4)N HMeCO 2EtMeHCOOH, HClor DMF/POCl 3CH 2(CO 2H)2PiperidineN HMeCO 2EtMeOHCN HMe CO 2EtMeHO 2C-HC=HC第五章 重排反应1.完成下列反应式 (1)OHOHdilute H 2SO 4O(2)CONH 2H OH HO H H OH HOH CH 2OHNaOCl / H 2OCHO HO H H OH H OH CH 2OH(3)NC 2H 5CH 3CH 2OCH 3C 6H 5Li Et 2ON C 2H 5CH 2CH 3OCH 3N ClC 6H 5Libenzene, heatN(5)N CH 2N(CH 3)3CH 3NaNH 2 / NH 3N CH 3CH 3CH 2N (CH 3)2(6)CH 3CH 3OH OH H +- H 2OCH 3OCH 3(7)OCH 3CONH 2NaOCl, NaOHOCH 3OCH 3NH 2OCH 3(8)NC EtOOC180 o CNC EtOOC(9)OOCH 3CH 3CH 3PhNEt 2reflux 2hOHOCH 3(10)CH 3NaNO 2 / H +HOCH 2NH 2CH 3OHOCH 3C(OEt)3142-147o C, 8daysCO 2C 2H 5(12)1. HCl-HOAc-Ac 2O2. H 3O +MeCO 2MeMeC CHMe 2MeN HOMeCO 2MeMeCHMe 2NH 22.完成下列合成过程 (1)OCHOO COOH OHOCNOOOONaOH H 3O(2)OCH 2OH +CH 3OC 2H 5OCH 3CHO OOCH 3OCH 3CHO ClaisenCopeOCH 3CHOH 2, Pd-C(3)CH 3C 2H 5OCH 3OCH 3+H 3CO 2COHCH 3ClaisenRearrangement2,4-O 2NC 6H 5OHTol OC 2H 5CO 2CH 3CH 3CO 2CH 3C 2H 5OCH 3CO2CH3C2H5OHCH3CH3C2H5OCH3OCH3CO2CH3C2H5CH3C2H5OHNaBH4MeOHNaBH4MeOHCO2CH3CH3C2H5OC2H5CO2CH3C2H5CH3C2H5OClaisen第六章氧化反应1.完成下列反应式①CH3NO2CrO3/Ac2OH2SO4CHONO2②CH3COOHNa2Cr2O7, H2O③CH3CH3CH3COClAlCl3CH 3COOHCH3CH3CH3COCH3 1. Br2,NaOH2. H+④HO OHMnO2CHCl3,25°CRHO OR⑤OAcOKMnO4BaOHKIO4//H2O/K2CO3/35°COOAcOOH⑥CH3NO2 OCH3CrO2Cl2CS225°CCHONO2OCH3⑦HO CH2OH(C5H5N)2CrO3CH2Cl225°CHO CHO ⑧0.5 M SeO2C2H5OH, ref.OH⑨H3CO HOOHH3PO4RTDMSO-DCCH3COOO⑩C OCH 3C OCH 3ORO ROH 2O 2, NaOH⑾H 3C H 3CH HHHClCOOOH(C 2H 5)2O 25°C H 3CH 3CHHHHO⑿HCOCH 3C 6H 5COOOHCHCl 325°CHOCOCH 32. 试以化学式表示实现下列变化的各步反应①CHOAg 2O1.SOCl 22.NH 3RCO 3Haq NaOHC 2H 5CHO C 2H 5COOH C 2H 5CONH 2C 2H 5CONH 2O②HO(CH 2)6CH 3H 3CSO 2ClOHC(CH 2)5CH 3H 3CSO 2O(CH 2)6CH 3DMSO③OH1.H 2SO 42.KMnO 4CHOCHO CHOOH OHPb(OAc)4aqNaOH④OH Bu-tO Bu-tOOBu-t1. CrO 3-H 2SO 4-H 2O2.SeO 21. KOH2. HCl,第七章 还原反应1、完成下列反应 ①H 3CCHO0.25M NaBH 4H 3CCH 2OH②NO 2NH 2NH 2H 2O Pd-C /C 2H 5OHNH 2③OOH0.25M NaBH 4④CO(CH 2)2CH 2Br OCH 3OCH 3Zn-Hg.HClCH 2(CH 2)2CH 2BrOCH 3OCH 3⑤H3CCH 3CH 3H B 2H 6THF,25°CNaOHH 2OH 3CCH 3CH 3H2BHH 3CCH 3HOH CH 3H⑥OCH 3CH 3COClOCH 3CH 3CHOPd-BaSO 4/H 2⑦2PhCH 2C HCH 2+Pd/C2PhCH 2CH 2CH 3⑧OH 2 / (Ph 3P)3RhClO⑨OOPhH 2 / Pd-CAcOH , HClO 4HOOPh⑩N H 3COCNC HCH 2Al(OCH(CH 3)2)3(CH 3)2CHOHONH 3COCHN C HCH 2HO2. 改错①COOHCOOEtLAHCH 2OHCOOEtCH 2OHCH 2OH②CH 3C O COOEtZn-Hg HClCH 3CH 2COOEtCH 3CCHOOEtOH③C CH 3O C H 3C H C H 3C CH 3CH 3C CH 3OHC H 3C H C H 3C CH 3CH 3H C CH 3H C H 3C H C H 3C CH 3CH 3OH LAH3. 完成下列合成题①试由环己醇,氯乙酸,乙醇合成C 10OOH-H 2O1. O 32. Pd/C, H 2ZnCl 2/ HCl Cl(CH 2)6ClClCH 2COOHNaCNOH -C 2H 5OHCH 2(COOC 2H 5)2CH 2(COOC 2H 5)2+Cl(CH 2)6Cl C 2H 5ONa(COOC 2H 5)2CH(CH 2)6CH(COOC 2H 5)21. NaOH, H 2O 2. EtOH, H +C 2H 5OOC(CH 2)8COOC 2H 5Na, NH 3PhCH 3(CH 2)2OHO(CH 2)2O②试由O OCH 3合成O。

《药物合成反应》复习题一、写出下列缩写所代表的结构式和名称1、NBS:2、DMSO;3、DCC;4、THF;5、DMAP。
6、NCS:7、DMF;8、HMT;9、PPY;10、HMPA/HMPTA。
11、TCC 12、LTA 13、DEAD 14、TsCl 15、DDQ二、解释下列反应并各举一例说明1、Friedel-Crafts(傅-克)反应:2、Oppenauer氧化反应:3、Clemmensen反应:4、Wittig反应:5、Baeyer-Villiger(拜义尔-威力奇)反应:6、Williamson反应:7、Ullmann反应:8、Gabrieal反应:9、Mannich反应:10、Dalton反应:11、Perkin(柏琴)反应:12、Hofmann(霍夫曼)重排:13、Reformatsky(雷福尔马茨基)反应14、Darzens(达参)缩合15、Cannizzaro(康尼查罗)反应16、Beckmann(贝克曼)重排三、完成下列反应1、2、3、()()()4、()5、6、7、( )( );8、9、( );10、11、12、13、BrCHO( )( )14、15、( )COOH NH 2NaNO 2 H 2SO 4( )COOHOAc16、(H 2C)5NHOMe 2SO 4( )17、 18、19、HOMeHO Me OHMnO 220、NNH OO H 3COCO HOMeDMSO/DCC H 3PO 421、22、23、( )C(CH 2OH)4C(CH 2Br)424、25、26、27、28、29、30、四、判断题1、卤代烃的活性顺序: 苄卤,卤乙烯,叔卤代烷,仲卤代烷,伯卤代烷2、常用酰化剂(RCO-)的反应活性顺序:RCOX, (RCO)2O, RCOOR ’, RCONR ’23、氧化顺序由易到难排列:李良助,C HO H 2COHR C R OR C OHO,4、以下负离子都是亲核试剂,其碱性的大小次序为:NH 2- , HO - , RO - , I - , Ac - .5、F-C 烷基化反应中常用Lewis 酸催化剂的活性顺序:AlCl 3,FeCl 3,BF 3 ,SnCl 4 ,ZnCl 2 ;6、将下列化合物按消去HBr 难易次序排序:7、F-C 烷基化反应常用质子酸的活性次序:HF H 2SO 4 P 2O 5 H 3PO 4 8、卤代烃的活性顺序: ①叔卤代烷 仲卤代烷 伯卤代烷 ②RF RCl RBr RI五、合成题1、由少于碳五的有机物合成2、由指定原料合成目标产物丁卡因,其余试剂任选。


1、靶分子:(Target Molecule):就合成设计而言,凡是所需合成的有机分子均可成为“靶分子”,或者是最终产物,或者是有机合成中的某一个中间体。
2、合成子(Synthons): 反合成分析时,目标分子切割成的片段(Piece)叫合成子3、逆合成分析:也称为反合成分析,即由靶分子出发,用你想切断、连接、重排和官能团互换、添加、除去等方法,将其变换成若干中间产物或原料,然后重复上述分析,直到中间体变换成所有价廉易得的和橙子等价试剂为止。
6、逆向切断(dis):用切断化学键的方法把靶分子骨架剖析城不同性质的合成子,成为逆向切断。
7、逆向官能团转化(con):在不改变靶分子基本骨架的前提下变换官能团的性质或所处位置的方法,包括逆向官能团转换(FGI)、逆向官能团添加(FGA)二、重要的化学反应1、卤化反应:在有机化合物分子中简历碳-卤键的反应称为卤化反应。
2、烃化反应:用烃基取代有机分子中的氢原子,包括在某些官能团或碳架上的氢原子,均称烃化反应。
3、酰化反应:在有机化合物分子中的碳、氧、氮、硫等原子上引入酰基的反应。
4、缩合反应:两个或多个有机化合物分子通过反应形成一个新的较大分子的反应或同一个分子发生分子内的反应形成新分子都可称为缩合。
5、重排反应:在同一分子内,某一原子或基团从一个原子迁移至另一个原子而形成新分子的反应。
6、氧化反应:有机物分子中氧原子的增加,氢原子的清除,或者两者兼而有之,不包括形成C-X、C-N、C-S的反应。
7、还原反应:在化学反应中,使有机物分子中碳原子总的氧化态降低的反应称为还原反应。
1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。


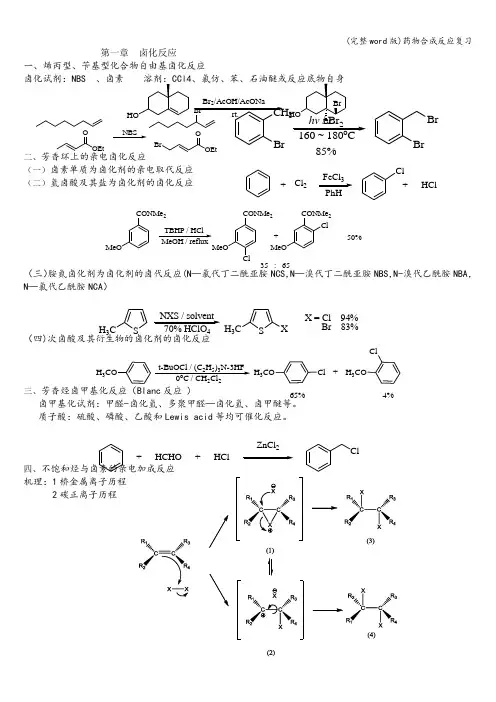
第一章卤化反应一、烯丙型、苄基型化合物自由基卤化反应卤化试剂:NBS二、(一)卤素单质为卤化剂的亲电取代反应(二)氢卤酸及其盐为卤化剂的卤化反应(三)胺氮卤化剂为卤化剂的卤代反应(N—氯代丁二酰亚胺NCS,N—溴代丁二酰亚胺NBS,N-溴代乙酰胺NBA,N—氯代乙酰胺NCA)(四)次卤酸及其衍生物的卤化剂的卤化反应三、芳香烃卤甲基化反应(Blanc反应 )卤甲基化试剂:甲醛-卤化氢、多聚甲醛—卤化氢、卤甲醚等。
质子酸:硫酸、磷酸、乙酸和Lewis acid等均可催化反应。
四、不饱和烃与卤素的亲电加成反应机理:1桥金属离子历程2碳正离子历程OEtO3hv / Br2160 ~ 180o CBrBr85%+Cl23Cl+HClMeOCONMe2MeOCONMe2ClMeOH / refluxTBHP / HCl+MeOCONMe2Cl50%35 : 65SH3C SH3C XX = Cl 94%Br 83%NXS / solvent4H3CO H3CO H3COClClt-BuOCl / (C2H5)3N-3HF0o C / CH2Cl265%4%++HCHO+HClZnCl2ClBr五.不饱和烃与卤化氢、氢卤酸的亲电加成六、羰基化合物α—位卤化反应 卤化剂:X2、N —卤代酰胺、 次卤酸酯、硫酰卤 溶剂:CCl4, CHCl3, Et2O , AcOH七、羟基的置换卤化反应卤化剂:卤化氢、氢卤酸、卤化磷、含硫卤化物(基本规律:1苄醇=烯丙醇>叔醇>仲醇〉伯醇2HI 〉HBr>HCL>HF)二章 硝化反应 直接硝化(电子云密度高的芳烃)第四章 氧化反应一、Baeyer —Villiger 贝耶尔—菲林格氧化(酮类化合物用过氧酸氧化生成酯) 机理:酮羰基先与过氧酸发生亲核加成,然后远羰基上的一个烃基带着一对电子迁移到过氧键的氧原子上,同时过氧键异裂,脱去过氧酸中的羧酸而形成酯。

药物合成复习题药物合成复习题药物合成是药学领域中的重要内容之一,它涉及到化学合成、药物设计和药效评价等多个方面。
对于药学专业的学生来说,掌握药物合成的基本原理和方法是必不可少的。
为了帮助大家巩固这方面的知识,本文将提供一些药物合成的复习题,希望能够对大家的学习有所帮助。
1. 请简要描述药物合成的基本步骤。
药物合成的基本步骤包括:合成目标的确定、原料药的选择、反应条件的确定、反应方案的设计、合成路线的选择、反应的实施、产物的纯化与分离、结构的鉴定和合成路线的改进等。
在实际操作中,药物合成往往需要考虑反应的选择性、产率的高低、废物的处理等因素。
2. 请简要介绍一下药物合成中常用的反应类型。
药物合成中常用的反应类型包括:酯化反应、酰胺化反应、烷基化反应、芳基化反应、氧化反应、还原反应、缩合反应、加成反应、消除反应等。
这些反应类型可以根据具体的合成需求选择,并且可以通过反应条件的调节和催化剂的选择来实现目标产物的高产率和高选择性。
3. 请简要描述一下如何选择合适的合成路线。
选择合适的合成路线是药物合成中的重要环节之一。
通常情况下,选择合成路线需要考虑以下几个方面的因素:合成步骤的简洁性、原料的易得性、反应条件的温和性、产物的纯化难易度、合成中间体的稳定性等。
在实际操作中,根据这些因素进行综合考虑,选择最优的合成路线,可以提高合成效率和产物的纯度。
4. 请简要介绍一下药物合成中常用的保护基策略。
在药物合成过程中,为了保护特定的官能团不被其他反应物或副反应所影响,常常需要引入保护基。
常见的保护基包括:酯保护基、醚保护基、羰基保护基等。
通过引入保护基,可以在合成过程中对特定的官能团进行保护,以免其发生不必要的反应。
在需要恢复原始官能团时,可以通过适当的条件和反应来去除保护基。
5. 请简要介绍一下药物合成中常用的合成方法。
药物合成中常用的合成方法包括:传统有机合成方法、金属有机化学方法、生物合成方法和计算机辅助合成方法等。

第一章绪论1、药物合成反应中反应类型有哪些?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a、亲核试剂、b、亲电试剂);自由基反应;协同反应2、药物合成反应主要研究对象:化学合成药物3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性”就是指在化学品合成过程中,合成方法与工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小2、硝化试剂的活泼中间离子为:硝酰正离子NO2○+3、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar-X+N2 (X:Cl,Br,-CN)4、常用的重氮化试剂一般就是由盐酸、硫酸、过氯酸与氟硼酸等无机酸与亚硝酸钠作用产生。
5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C—NO2、N—NO2与O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸与各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些?NaNO2+HCl/H2SO4第三章卤化反应1、Ph上取代基对卤化反应的影响①催化剂的影响;②芳环结构的影响;③反应温度的影响;④卤化剂的影响;⑤反应溶剂影响2、醇与HCl发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇氢卤酸的活性顺序:HI >HBr >HCL3、NBS 的应用(N —溴代丁二酸亚胺) ①N —卤代酰胺与不饱与烃的卤取代反应机制:RCH 2CH=CH 2+NBSRCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N —卤代酰胺与不饱与烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的催化下,N —卤代酰胺与烯烃加成易制备—卤代醇的重要方法。

四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。
药物合成反应知识点总结药物合成是一门综合化学、生物学、医学等学科知识的交叉学科,在药物研发、制备方面有着重要的地位。
掌握合成反应知识对于开发新药物、改进药物生产工艺以及合成新型医用化合物有着重要的意义。
下面将对药物合成反应知识点进行总结。
一、酯化反应酯化反应是一种醇和酸酐进行酯键形成的反应,常用于制备药物中的酯类化合物。
酯化反应通常需要酸性催化剂,如硫酸、氯化锌等。
常见的酯化反应包括醋酸乙酯和苯酚反应,以及异丁酸和异丁醇反应等。
酯化反应在药物合成中具有重要的应用价值,可以制备许多重要的药物原料和药物分子。
二、取代反应取代反应是指一种功能团被另一种功能团取代的化学反应。
在药物合成中,取代反应可用于引入新的官能团或者进行位置选择性修饰。
常见的取代反应包括亲电取代反应、芳香核烷基取代反应、核烷基取代反应等。
取代反应技术在药物合成中的应用广泛,可以实现对目标分子的精准调控。
三、溴化反应溴化反应是一种以溴化试剂为催化剂,将氢原子直接溴化的反应。
在药物合成中,溴化反应通常用于芳香环的溴化,在合成多种药物原料和中间体中具有重要应用价值。
溴化反应可以通过光化学、热化学等多种途径进行,是药物合成中不可或缺的反应类型。
四、氢化反应氢化反应是指将双键或者芳香环上的芳香核加氢生成饱和化合物的化学反应。
在药物合成中,氢化反应通常用于去除分子中的双键或者芳香环,改变化合物的性质和活性。
常见的氢化反应包括氢气加压氢化反应、催化氢化反应等。
氢化反应在药物合成中应用广泛,可以制备众多的药物原料和合成中间体。
五、缩合反应缩合反应是指将两个或者更多的分子通过断裂键和形成新键,生成较大的分子的化学反应。
在药物合成中,缩合反应可以用于合成多种多样的药物原料和药物分子。
常见的缩合反应包括醛缩合、酮缩合、酰胺缩合等。
缩合反应技术在药物合成中的应用非常广泛,是药物研发和制备的重要手段之一。
六、水解反应水解反应是指利用水分子将化合物中的官能团断裂,生成新的化合物的化学反应。
化学药物是指凡具有预防、治疗、缓解、诊断疾病或调节机体功能化学物质。
(绪论)按照药物合成反应机理,卤化反应包括亲电加成(大多数不饱和烃的卤加成反应),亲电取代(芳烃和羰基α位的卤取代反应),亲核取代(醇羟基、羧羟基和其他官能团的卤置换反应),自由基反应(饱和烃、苄位和烯丙位的卤取代反应,某些不饱和烃的卤加成反应以及羧基、重氮基的卤置换反应)。
(第一章卤化反应p1)不对称烯烃与溴化氢的加成会产生过氧化物效应(加成方向符合反马氏规则)(第一章卤化反应p11)。
卤化剂氯化亚砜的分子式是 SOCl2(第一章卤化反应 p36)在卤化氢对醇羟基的置换卤化反应中,各种醇的反应活性顺序是: 叔醇>仲醇>伯醇) (第一章卤化反应 p27)发生烃化反应的化合物称为被烃化物, 常见的被烃化物有: 醇,酚 (在羟基氧上引入烃基), 胺类 (在氨基氮上引入烃基) 和活性亚甲基,芳烃(在碳原子上引入烃基)。
(第二章烃化反应 p44)请写出制备伯胺的任意两种方法:过量的氨与卤代烃反应、 Gabriel(加布里)反应、改良的Gabriel反应(三氟甲磺酰胺法)、 Délépine(德莱潘)反应、利用二苯硫基胺制备伯胺、还原烃化法。
(第二章烃化反应p56-57)环氧乙烷是羟乙基化试剂 (第二章烃化反应p50)在用卤代烃作烃化剂的Friedel—Crafts烃化反应中,下列卤代烃(氯甲烷仲卤代烃伯卤代烃一氯苄)活性最大的是:一氯苄(第二章烃化反应 p65)为催化剂时,下列酰化剂(酰氯酰Friedel—Crafts酰化反应中,以AlCl3溴酰氟酰碘)活性最大的是酰碘(第三章酰化反应 p111 )伯胺和仲胺, 脂肪胺和芳香胺类药物与相同的酰化试剂发生酰化反应,其反应的难易程度顺序:脂肪胺>芳香胺伯胺>仲胺(第三章酰化反应p104)酰化反应中,常用的酰化剂为酰卤、羧酸、酸酐及酰胺等,上述的几种物质酰化能力大小顺序为酰卤>酸酐>羧酸>酰胺(第三章酰化反应p88)在有机物分子结构中的碳、氮、氧原子上导入酰基的反应称为酰化反应,相应的酰化反应的产物分别为: 酮(醛) , 酰胺 , 酯。
第一章绪论1、药物合成反应中反应类型有哪些?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a・亲核试剂、b.亲电试剂);自由基反应;协同反应2、药物合成反应主要研究对象:化学合成药物3、化学品的安全使用说明书一一MSDS4、原子经济性反应:“原子经济性”是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小2、硝化试剂的活泼中间离子为:硝酰正离子NO?㊉3、桑德迈尔反应定义及应用定义:在氯化亚铜或漠化铜的存在下,重氮基被氮或漠置换的反应;重氮基被氧基置换:将重氮盐与氧化亚铜的配合物在水介质中作用,可以使重氮基被氧基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X ---------- >Ar-X+N2(X:CI,Br,・CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生。
5、硝化艮应定义:指向有机分子结构屮引入硝基(一NO?)的反应过程,广义的硝化反应包括生产(C—NO2、N —1\1。
2和0—反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用牛成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酹及各种Lewis酸的混合物。
8、生成硝基烷桂的难易顺序:卤代怪中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些?NaNO2+HCI/H2SO4第三章卤化反应1、Ph上取代基对卤化反应的影响①催化剂的影响;② 芳环结构的影响;③ 反应温度的影响;④ 卤化剂的影响;⑤ 反应溶剂影响醇疑基的活性顺序:叔(莱基、烯丙基)醇〉仲醇〉伯醇 氢卤酸的活性顺序:HI>HBr>HCL 3、NBS 的应用(N —漠代丁二酸亚胺) hv ①N —卤代酰胺与不饱和坯的卤取代反应机制:RCH 2CH=CH 2+NBS ------------- > RCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基② N —卤代酰胺与不饱和桂的加成反应:在质子酸(醋酸、漠氢酸、高氯酸)的 催化下,N —卤代酰胺与烯怪加成易制备错误!未找到引用源。
一卤代醇的重要方 法。
③ N —卤代酰胺与醇疑基的置换反应:具有光学活性的醇疑基化合物用N —卤代 酰胺置换反应时,另加入三苯代麟(Ph 3P )不但反应温和,而且原不对称碳原子 的构型发生反转。
4、卤代氢与乙醇发生卤代;活性顺序:HI>HBr>HCL ,仲醇〉伯醇5、拨基的a-H 比较活泼,在酸或碱的催化下,可被卤原子取代,生成Q —卤代糖基化合物。
卤化试剂中卤正离子和卤负离子都能对有机物进行卤化,卤化 试剂中能提供卤负离子和卤正离子的各有哪些?答:可提供卤素负离子的卤化剂有:卤素、氢卤酸、含磷卤化物、含硫卤化 物等,如 X2、HX 、POX 3> PX3、PX5、S2CL2、SCL 2> SOCL2等。
可提供卤素正离子的卤化剂有:卤素、N —卤代酰胺、次卤酸等,如X2、NBS 、 XOH 等。
6、卤化反应的目的有哪些?药物合成反应中引入卤素的目的又是什么?答:目的是引入卤素原子。
药物合成反应中引入卤素的目的:(1)使有机物分 子的极性增加,反应活性增加;(2)可以提高药理活性,降低毒性,改变其性能(3)可作为中间体。
[发生卤代反应的活性顺序:叔(节位,烯丙位)醇〉仲醇〉伯8、 饱和桂卤化是自由基反应三阶段:链引发、链增长、链终止9、 竣基被卤素取代:反应活性顺序:脂肪竣酸〉芳香竣酸〉,芳环上具有供电子取代基的芳香竣 酸〉无取代基的芳香竣酸>具有吸电子取代基的芳香竣酸10、 卤化试剂: 11>自由基机理:NBS: 2、 [与HC1发生卤置换反应活性顺序Ph+ RCONH 2 ■ ■■NCS:NBP:XNBA:12、含磷卤化剂:活性顺序13 >含硫卤化剂:AlBr 3,其活性顺序为: AlBr3>AlC13>SbCl 5>FeC13>FeCl 2>SnC14>TiCl 4>TeCl 4>BiCl 3>ZnCl 2当AICI B 催化卤代正丁烷或叔丁烷与苯反应时,活性顺序为:RF>RCl>RBr>RI 2、 卤代桂作为姪化试剂对炷基进行绘化的知识点?活化顺序?① 知识点:卤化绘作为绘化试剂对径基进行绘化试剂时,卤化桂活性顺序中, 醇活性的顺序属于SN1反应。
② 活化顺序:卤化桂在碱性条件下与醇疑基进行疑化反应生成二烷基醯,对 R 相同的卤化炷,卤化炷的活性次序按RCl<RBr<RI3、 活泼亚甲基化合物C-炷化:(C 负离子)吸电子基的活性顺序:Ph-<RS0-<-C00R<-C=N<-S03R<-C0R<-N02碱性顺序:4、 常用的桂化试剂:卤代怪、醇、烯怪5、 F-C 烷基化的定义:卤化姪在催化剂存在下与芳香族化合物进行芳核上碳原 子烷基化反应,该法常用与合成烷基取代的芳香衍生物。
6、 怪化试剂种类:卤代桂、磺酸酯和其他酯类、醇类、隴类、烯坯类、有机金 属类、甲醛和甲酸等。
7、 制备伯胺的反应:A 、Gabriel 伯胺合成反应:由于氨分子结构屮有三个氢原子都可被坯基取代, 得到的产物常是混合物。
B 、Delepine 伯胺合成法:活性卤代怪与环六次甲基四胺的反应生成环六次甲基 四胺复盐,然后在乙醇中用盐酸水解得到伯胺盐酸盐的反应。
8、 什么是疑乙基化反应:定义:在氧、氮和碳原子上引入瓮乙基的反应。
9、 制备叔胺:环氧乙烷与芳胺发生反应生成B-轻乙基芳胺,并可进一步羟乙基 化反应得到叔胺。
10、 格式试剂的通式:R-MgX11、 卤代绘对烯炷的加成反应:遵循马氏规则,氢加在氢多的地方,-X 加在氢 少的地第四章桂化反应1、傅克烷基化(Friedel-Crafts )反应中活性](Lwies )是方,包括亲电加成和自由基加成。
第五章酰化反应1、酰化反应:是指在有机物分子结构中的碳、氮、氧等原子上导入酰基的反应, 其产物分别是酮(醛)、酰胺和酯等。
竣酸在质子酸的催化下,对芳坯进行亲电取代反应生成芳酮,称为Friedel-Crafts (酰化)反应,其反应机制的实质为芳香环上的亲电取代反应。
能发生F-C酰基化反应的试剂有:Lewis酸,DCC2、酰化试剂的类型有:1•竣酸2.酰氯3.酸酹4.竣酸酯5•酰胺活性顺序:酰氯〉3、付克酰基化反应是发生在苯环上的,苯环的取代基对该反应有影响。
如果苯环上活化基(给电子基)多,反应容易,反之就难。
4、N酰化中,活性顺序:N酰化中胺的活性顺序:伯胺〉仲胺〉叔胺。
乙胺〉苯胺。
5、酰氯作为酰化试剂发生酰化反应时,最更要的中间体离子是酰基正离子6、酰氯的制备途径:在某些竣酸为酰化剂的反应中,加入S0C12、P0C13、PC13 和PC15等氯化剂,使之在反应中生成酰氯。
7、酰化反应的分类1、0■酰化反应2、N-酰化反应3、G酰化反应8、DEAD: DMAP: THF: TEA: CDI:9、hoesch 反应:第六章缩合反应1、什么是轻醛缩合其对应产物是什么?含a -H的醛、酮在碱或酸的催化下发生自身缩合,或与另一分子的醛、酮发牛缩合,牛成B—轻基醛、酮,再经脱水消除牛成a , B—不饱和醛、酮,这类反应称为疑醛缩合反应,又称醛醇缩合反应(Aldol缩合反应)。
2、不对称的酮自身酸碱条件下缩合的产物是什么?B —轻基酮或其脱水产物。
3、什么是径甲基化反应?在醛酮的a位引入-CH20H基团的反应称为轻甲基化反应。
生成0 -不饱和醛、酮4、疑醛缩合机制,以及催化剂对该反应的影响?含a—H的醛、酮自身缩合属亲核加成一消除反应机制。
催化剂对醛、酮的自身缩合反应影响较大。
常用的碱催化剂有磷有吋也可用阴离子交换树脂。
氢化钠等强碱一般用于活性差、空间位阻人的反应物Z间的缩合,如酮一酮缩合,并且在非质子溶剂中进行反应。
常用的酸催化剂有盐酸、硫酸、对甲苯磺酸碳酸钠(钾)、氢氧化钠(钾)、乙醇钠、叔丁醇铝、氢化钠、氨基钠等, 以及三氟化硼等Lewis酸。
5、氯甲基化反应?Blanc在无水氯化锌存在下,芳炷与甲醛及氯化氢作用,芳炷上的氢原子被氯甲基取代。
此反应叫氯甲基化反应。
6、Micheal加成反应?活性亚甲基化合物和a , B—不饱和按基化合物在碱性催化剂的存在下发生加成而缩合的按烷基类化合物的反应,称为Micheal反应。
反应通式:7、安息醛缩合:第七章氧化反应1、醇可被氧化成哪些有机物?答:①可氧化成醛、酮②伯醇氧化成竣酸③1,2-二醇可被氧化剂裂解成两分子拨基化合物,常用氧化剂有Pb(Oac)“ 和络酸等2、下列氧化剂的区别?A.酸性高镒酸钾B.活性MnO2C. Sarret试剂D.碱性高镒酸钾答:①酸性高镒酸钾氧化能力强,可以氧化伯醇生成酸,氧化仲醇生成酮,氧化双键②碱性高镭酸钾氧化轻基同时能氧化双键③活性MnO选择性氧化烯丙位的径基④Sarret试剂可氧化伯醇、仲醇、不饱和醇等生成相应的醛和酮3、拨基Q-位的甲基、亚甲基或次甲基的氧化?答:按基a-位的活性桂基可被氧化成a-疑基酮。
当用Pb(0ac)4或醋酸汞[Hg(Oac)2]做氧化剂时,反应先在拨基位上引入乙酰氧基,再水解即生成a- 轻基酮。
亚甲基或次甲基的氧化均可发牛以上反应。
4、NaI04作为常用氧化剂特点?答:NsI04作为常用氧化剂,可以氧化裂解邻二醇得到二拨基化合物。
在低温下,控制Ndl04的用量可选择性的氧化硫化物生成亚砚;在叫高温度下使用过量NaI04则可以氧化硫化物生成砚。
此外,在酸性硅胶或氧化铝的存在下,NaI04 可以在室温下高选择性的氧化硫化物的到目标产物亚飒。
收率进乎定量。
5、Cr类氧化试剂种类?Jones试剂Collins 试剂氯辂酸毗呢重珞酸毗旋6、0s04答:0s04做为一种亲电试剂参与烯怪的双疑基化反应。
0s04非常昂贵、且有剧毒,高挥发性,故实际使用中常采用催化两的0s04,以N-甲基吗咻-N-氧化物或铁孰化钾做共氧化剂进行反应。
第八章还原反应分类1、还原反应分类?根据还原剂及操作方法的不同,可分为以下三类①在催化剂的存在下借助于分子氢进行的催化氢化还原反应,包括氢化和氢解②使用化学物质做还原剂进行化学还原反应,主要包括负氢离子转移试剂还原、金属与供质子剂还原及含硫负离子还原、月井还原等其他还原反应。