盖斯定律的应用和计算复习练习习题例题
- 格式:doc
- 大小:162.50 KB
- 文档页数:6
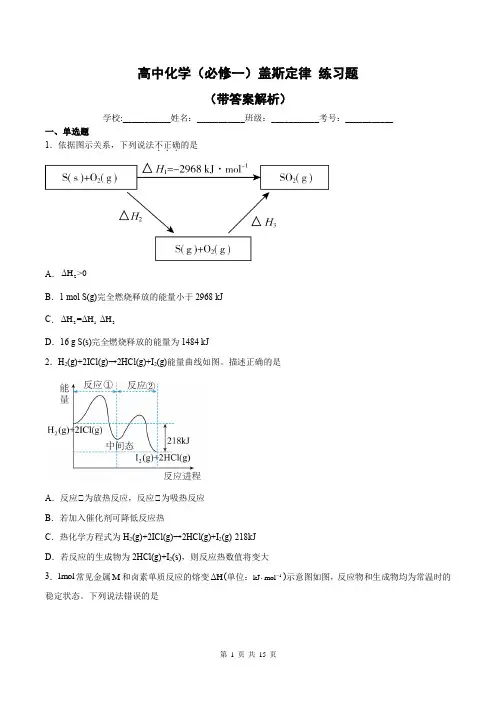
高中化学(必修一)盖斯定律练习题(带答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.依据图示关系,下列说法不正确...的是ΔH>0A.2B.1 mol S(g)完全燃烧释放的能量小于2968 kJΔH=ΔH-ΔHC.213D.16 g S(s)完全燃烧释放的能量为1484 kJ2.H2(g)+2ICl(g)→2HCl(g)+I2(g)能量曲线如图。
描述正确的是A.反应①为放热反应,反应①为吸热反应B.若加入催化剂可降低反应热C.热化学方程式为H2(g)+2ICl(g)→2HCl(g)+I2(g)-218kJD.若反应的生成物为2HCl(g)+I2(s),则反应热数值将变大3.1mol常见金属M和卤素单质反应的熔变ΔH(单位:1⋅)示意图如图,反应物和生成物均为常温时的kJ mol-稳定状态。
下列说法错误的是A .2MBr 与2Cl 反应的ΔH<0B .由2MCl (s)分解制得M 的反应是吸热反应C .化合物的热稳定性顺序:2222MI MBr MCl MF >>>D .2222MF (s)Br (l)MBr (s)F (g)+=+ -1ΔH=+600kJ mol ⋅4.硫酸工业中的钒催化剂参与反应的相对能量变化如图所示,下列热化学方程式错误的是A .-1243252V O (s)+SO (g)V O (s)+SO (g)ΔH=-24kJ mol ⋅ B .-142432VOSO (s)V O (s)+2SO (g)ΔH=+200kJ mol ⋅C .-12524242V O (s)+2SO (g)2VOSO (s)+V O (s)ΔH=-352kJ mol ⋅D .-125234V O (s)+SO (g)+SO (g)2VOSO (s)ΔH=-376kJ mol ⋅ 5.N 2O 和CO 是环境污染性气体,可在Pt 2O +表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。

专题4 盖斯定律的应用及反应热的计算学号姓名1.[2017江苏]通过以下反应可获得新型能源二甲醚(CH3OCH3)。
下列说法不正确的是①C(s) + H2O(g)CO(g) + H2 (g) ΔH1 = a kJ·mol−1②CO(g) + H2O(g)CO2 (g) + H2 (g) ΔH 2 = b kJ·mol−1③CO2 (g) + 3H2 (g)CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol−1④2CH3OH(g)CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol−1A.反应①、②为反应③提供原料气B.反应③也是CO2资源化利用的方法之一C.反应CH3OH(g)12CH3OCH3 (g) +12H2O(l)的ΔH =2dkJ·mol−1D.反应2CO(g) + 4H2 (g)CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−12.[2019新课标Ⅲ节选]近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。
因此,将氯化氢转化为氯气的技术成为科学研究的热点。
回答下列问题:(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+12Cl2(g) ΔH1=83 kJ·mol− 1CuCl(s)+12O2(g)=CuO(s)+12Cl2(g) ΔH2=− 20 kJ·mol− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=− 121 kJ·mol− 1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol− 1。
3.(2018年全国I卷28题)①已知:2N2O5(g) = 2N2O5(g) + O2(g) ΔH1= −4.4 kJ·mol−1,2NO2(g)=N2O4(g) ΔH 2 = −55.3 kJ·mol−1,则反应N2O5(g) = 2NO2(g) + 12O2(g)的ΔH =______ kJ·mol−1.4.(2018年全国II卷27题)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。

课练18 盖斯定律的应用及反应热的计算————————[狂刷小题 夯基础]—————————[练基础]1.以N A 代表阿伏加德罗常数,则关于热化学方程式:C 2H 2(g)+52O 2(g)===2CO 2(g)+H 2O(l) ΔH =-1 300.0 kJ·mol -1的说法正确的是( )A .当有10N A 个电子转移时,该反应就放出1 300 kJ 的能量B .当有N A 个水分子生成且为液态时,吸收1 300 kJ 的能量C .当有22.4 L C 2H 2(g)完全燃烧生成CO 2和液态H 2O 时,该反应就放出1 300 kJ 的能量D .当有8N A 个碳氧共用电子对生成时,该反应就吸收1 300 kJ 的能量 2.Mn 2+催化H 2O 2分解:2H 2O 2(l)===2H 2O(l)+O 2(g) ΔH 1,其反应机理如下:若反应Ⅱ的焓变为ΔH 2,则反应Ⅰ的焓变ΔH 为(反应Ⅰ、Ⅱ的计量数均为最简整数比)( )A .ΔH 1-ΔH 2B .ΔH 1+ΔH 2C .2ΔH 1-ΔH 2D .ΔH 1-2ΔH 2 3.已知下列反应的热化学方程式为:①C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ·mo l -1;②CH 3COOH(l)+2O 2(g)===2CO 2(g)+2H 2O(l) ΔH 2=-870.3 kJ·mol -1; ③H 2(g)+1/2O 2(g)===H 2O(l) ΔH 3=-285.8 kJ·mol -1。
则2C(s)+2H 2(g)+O 2(g)===CH 3COOH(l)的反应热(焓变)为( ) A .488.3 kJ·mol -1B .-488.3 kJ·mol -1C .-244.15 kJ·mol -1D .244.15 kJ·mol -14.已知:①2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH1②2CO(g)+O2(g)===2CO2(g) ΔH2③2H2(g)+O2(g)===2H2O(l) ΔH3④2H2(g)+O2(g)===2H2O(g) ΔH4⑤CO(g)+2H2(g)===CH3OH(g) ΔH5下列关于上述反应焓变的判断正确的是( )A.ΔH1>0,ΔH2<0B.ΔH3>ΔH4C.ΔH1=ΔH2+2ΔH3-ΔH5D.2ΔH5+ΔH1<05.(多选)根据下表判断下列说法正确的是( )断裂或生成的化学键能量数据断裂1 mol H2分子中的化学键吸收能量436 kJ断裂1 mol Cl2分子中的化学键吸收能量243 kJ断裂1 mol HCl分子中的化学键吸收能量431 kJ A.元素的非金属性越强,其形成单质的分子中化学键键能越大B.相同条件下,氢分子具有的能量低于氯分子具有的能量C.生成1 mol HCl时反应放热431 kJD.反应H2(g)+Cl2(g)===2HCl(g)的ΔH=-183 kJ·mol-16.已知:①2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1②氢气燃烧的能量变化示意图:下列说法正确的是( )A.1 mol C(s)完全燃烧放出110 kJ的热量B.H2(g)+1/2O2(g)===H2O(g) ΔH=-480 kJ·mol-1C.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+130 kJ·mol-1D.欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量[练高考]1.[2016·海南卷]油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l)已知燃烧1 kg该化合物释放出热量3.8×104 kJ。

盖斯定律习题一、选择题1.化学反应中常常伴有能量变化,下列说法错误的是 ( ) A 原电池是将部分化学能转化为电能 B TNT 爆炸是将部分化学能转化为动能 C 铝热反应是将部分化学能转化为热能 D 甲烷燃烧是将全部的化学能转化为热能2.分析右面的能量变化示意图,确定下列选项中正确的是( )A.2 A (g )+ B(g) 2 C (g )△H <0B.2 A (g )+ B(g) 2 C (g ) △H >0 2 C △H <0C.2A + B 2 A +B △H <0D.2C 3.从如右图所示的某气体反应的能量变化分析,以下判断错误的是( )A.这是一个放热反应B.该反应可能需要加热C.生成物的总能量低于反应物的总能量D.反应物比生成物更稳定 4.(2007年海南卷)已知:(1)Zn (s )+1/2O 2(g )=ZnO (s );ΔH=-348.3 kJ/mol(2)2Ag (s )+1/2O 2(g )=Ag 2O (s );ΔH=-31.0 kJ/mol则Zn (s )+Ag 2O (s )=ZnO (s )+2Ag (s )的ΔH 等于( ) A .-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol5.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。
下列说法正确的是 ( ) A .电解熔融的Al 2O 3可以制得金属铝和氧气,该反应是一个放出能量的反应 B .水分解产生氢气和氧气时放出能量C .相同状况下,反应2SO 2+O 2=2SO 3是一个放热反应,则反应2SO 3=2SO 2+O 2是一个吸热反应D .氯化氢分解成氢气和氯气时需要放出能量6.下列图象分别表示有关反应的反应过程与能量变化的关系据此判断下列说法中正确的是 ( ) A .石墨转变为金刚石是吸热反应 B .白磷比红磷稳定C .S(g)+O 2(g)=SO 2(g) ΔH 1,S(s)+O 2(g)=SO 2(g) ΔH 2,则ΔH 1>ΔH 2D .CO(g)+H 2O(g)=CO 2(g)+H 2(g) ΔH >07.[双选题]已知25℃、101 kPa 条件下:①4Al(s)+3O 2(g)===2Al 2O 3(s) ΔH =-2 834.9 kJ/mol ②4Al(s)+2O 3(g)===2A l2O 3(s) ΔH =-3 119.1 kJ/mol 由此得出的正确结论是( )A .等质量的O 2比O 3的能量低,由O 2变O 3为放热反应B .等质量的O 2比O 3的能量低,由O 2变O 3为吸热反应C .O 3比O 2稳定,由O 2变O 3为放热反应D .O 2比O 3稳定,由O 2变O 3为吸热反应 8.(2012·吉林一中质检)根据下列热化学方程式: (1)C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ/mol (2)H 2(g)+12O 2(g)===H 2O(l) ΔH 2=-285.8 kJ/mol(3)CH 3COOH(l)+2O 2(g)===2CO 2(g)+2H 2O(l) ΔH 3=-870.3 kJ/mol 可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A .ΔH =+244.1 kJ/mol B .ΔH =-488.3 kJ/mol C .ΔH =-996.6 kJ/mol D .ΔH =+996.6 kJ/mol 9.(2007年海南卷)已知:(1)Zn (s )+1/2O 2(g )=ZnO (s );ΔH=-348.3 kJ/mol (2)2Ag (s )+1/2O 2(g )=Ag2O (s );ΔH=-31.0 kJ/mol则Zn (s )+Ag 2O (s )=ZnO (s )+2Ag (s )的ΔH 等于( ) A.-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol10.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g); △H= + 49.0 kJ·mol -1②CH 3OH(g)+1/2O 2(g)=CO 2(g)+2H 2(g);△H=-192.9 kJ·mol -1 下列说法正确的是 ( )A .CH 3OH 的燃烧热为192.9 kJ·mol -1B .CH 3OH 的燃烧热为133.9 kJ·mol -1低高物质所具有的总能量2 A (g) + B(g) 2 C (g)C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应: CH 3OH(l)+1/2O 2(g)=CO 2(g)+2H 2(g)的△H>-192.9kJ·mol -1 11.肼(N 2H 4)是火箭发动机的一种燃料,反应时N 2O 4为氧化剂,反应生成N 2和水蒸气。


盖斯定律及应用练习题【基础达标】1.已知C(s)+H2O(g)=CO(g)+H2(g)ΔH=+130kJ•mol-12C(s)+O2(g)=2CO(g)ΔH=-220kJ•mol-1H-H、O=O和O-H键的键能分别为436 kJ•mol-1、a kJ•mol-1和462kJ•mol-1,则a为()A.496B.118C.350D.130【答案】A【解析】试题分析:已知热化学方程式①C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-220kJ/mol,则根据盖斯定律可知②-①×2即得到热化学方程式O2(g)+2H2(g)=2H2O(g)△H=-(220+2×130)kJ/mol。
由于反应热等于断键吸收的能量与形成新化学键所放出的能量的差值,则akJ/mol+2×436 kJ/mol-2×2×462 kJ/mol=-(220+2×130)kJ/mol,解得a=496,答案选A。
考点:考查盖斯定律的应用2.已知CH4(g)+2O2(g)→CO2(g)+2H2O(g)ΔH== -Q1;2H2(g)+O2(g)→2H2O(g)ΔH== -Q2;H2O(g)→H2O(l)ΔH==-Q3常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为()A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3【答案】D【解析】试题分析:本题涉及盖斯定律的内容,物质燃烧后恢复到常温,所以考虑水的状态,则甲烷燃烧的热方程式表示为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)ΔH==-(Q1+2Q3);氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)ΔH==-(Q2+2Q3),由题意判断甲烷的物质的量为5mol,氢气的物质的量为1mol,计算得到放出的热量为:4Q1+0.5Q2+9Q3。

⾼考化学总复习练习盖斯定律及反应热的简单计算课练18 盖斯定律及反应热的简单计算⼩题狂练?1.以N A 代表阿伏加德罗常数,则关于热化学⽅程式:C 2H 2(g)+52O 2(g)===2CO 2(g)+H 2O(l)ΔH =-1 300.0 kJ·mol-1的说法中,正确的是( )A .当有10N A 个电⼦转移时,该反应就放出1 300 kJ 的能量B .当有N A 个⽔分⼦⽣成且为液态时,吸收1 300 kJ 的能量C .当有22.4 L C 2H 2(g)完全燃烧⽣成CO 2和液态H 2O 时,该反应就放出1 300 kJ 的能量D .当有8N A 个碳氧共⽤电⼦对⽣成时,该反应就吸收1 300 kJ 的能量答案:A解析:反应中每有1 mol C 2H 2参加反应,转移10 mol 电⼦,放出1 300 kJ 能量,故A 正确;当有N A 个⽔分⼦⽣成且为液态时,放出1 300 kJ 的能量,故B 错误;22.4 L C 2H 2(g),不⼀定是标准状况,故C 错误;1 mol CO 2分⼦含有4 mol 碳氧共⽤电⼦对,反应中有8N A 个碳氧共⽤电⼦对⽣成时,放出1 300 kJ 的能量,故D 错误。
2.[2019·辽宁丹东五校联考]已知:25 ℃、101 kPa 时:①4Al(s)+3O 2(g)===2Al 2O 3(s) ΔH =-2 835 kJ·mol -1 ②4Al(s)+2O 3(g)===2Al 2O 3(s) ΔH =-3 119 kJ·mol -1 下列说法正确的是( )A .O 3⽐O 2稳定,由O 2转化为O 3是吸热反应B .O 2⽐O 3稳定,由O 2转化为O 3是放热反应C .等质量的O 2⽐O 3能量⾼,由O 2转化为O 3是放热反应D .等质量的O 2⽐O 3能量低,由O 2转化为O 3是吸热反应答案:D解析:根据盖斯定律,由①-②可得3O 2(g)===2O 3(g),则有ΔH =(-2 835 kJ·mol -1)-(-3 119 kJ·mol -1)=+284 kJ·mol -1,故O 2转化为O 3的反应是吸热反应;据此推知,等质量的O 2具有的能量⽐O 3具有的能量低,故O 2⽐O 3更稳定。

高考化学经典试题总复习盖斯定律及其在热化学方程式中的应用一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/molH 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O(l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。

高中化学学习材料金戈铁骑整理制作盖斯定律专题训练1.已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,例如图(1)所示:ΔH 1=ΔH 2+ΔH 3。
根据上述原理和图(2)所示,判断对应的各反应热关系中不正确的是A .AF :ΔH =-ΔH 6 B .A D :ΔH =ΔH 1+ΔH 2+ΔH 3C .ΔH 1+ΔH 2+ΔH 3+ΔH 4+ΔH 5+ΔH 6=0D .ΔH 1+ΔH 6=ΔH 2+ΔH 3+ΔH 4+ΔH 52.已知:①2CO(g)+O 2(g)2CO 2(g) △H=-566 kJ·mol -1 ②N 2(g)+O 2(g)2NO(g) △H = +180kJ·mol -1,则2CO(g)+2NO(g)N 2(g)+2CO 2(g)的△H 是 A .-386 kJ·mol -1 B .+386 kJ·mol -1 C .+746 kJ·mol -1 D .-746 kJ·mol-13.已知:CH 3CH 2CH 2CH 3(g)+132O 2(g)4CO 2(g)+5H 2O(l) ∆H =-2878 kJ(CH 3)2CHCH 3(g)+132O 2(g)4CO 2(g)+5H 2O(l) ∆H =-2869 kJ下列说法正确的是A .正丁烷分子储存的能量大于异丁烷分子B .正丁烷的稳定性大于异丁烷C .异丁烷转化为正丁烷的过程是一个放热过程D .异丁烷分子中的碳氢键比正丁烷的多4.在常温常压下,已知:4Fe(s)+3O 2(g)===2Fe 2O 3(s) ΔH 1 4Al(s)+3O 2(g)===2Al 2O 3(s) ΔH 2 2Al(s)+Fe 2O 3(s)===Al 2O 3(s)+2Fe(s) ΔH 3。
则ΔH 3与ΔH 1和ΔH 2之间的关系正确的是A .ΔH 3=12(ΔH 1+ΔH 2) B .ΔH 3=ΔH 2-ΔH 1 C .ΔH 3=2(ΔH 2+ΔH 1) D .ΔH 3=12(ΔH 2-ΔH 1) 5.已知25℃、101kPa 条件下:①4Al(s)+3O 2(g)===2Al 2O 3(s) ΔH =-2834.9kJ/mol ②4Al(s)+2O 3(g)===2Al 2O 3(s) ΔH =-3119.1kJ/mol 。

盖斯定律的例题及解析一、什么是盖斯定律?盖斯定律,也称为网络效应定律或马太效应,是指在某个系统中,一些优势节点会越来越优势,而一些弱势节点则会越来越弱。
这种现象在社交网络、经济市场等领域都有体现。
二、盖斯定律的例题下面以社交网络为例,解释盖斯定律的具体运作方式。
假设有一个社交网络平台,其中有1000个用户,他们之间可以互相关注和互动。
其中有一个用户A拥有1000个粉丝,而其他用户只拥有10-20个粉丝。
根据盖斯定律,用户A的影响力将会越来越大,而其他用户的影响力则会逐渐减小。
三、盖斯定律的解析1. 原因分析这种现象可以通过以下原因进行解释:首先是“富者愈富”的原因。
在社交网络中,受欢迎的用户更容易获得更多的关注和互动机会。
这些机会进一步增加了他们的影响力和受欢迎程度。
相反地,在社交网络中不那么受欢迎的用户则很难获得这些机会,从而导致他们的影响力逐渐减小。
其次是“弱者愈弱”的原因。
在社交网络中,用户之间的关注和互动是基于一定的兴趣相似性。
因此,那些不受欢迎的用户可能会被忽视或被边缘化,他们很难获得更多的关注和互动机会。
这种边缘化进一步削弱了他们的影响力和受欢迎程度。
2. 盖斯定律的应用盖斯定律在许多领域都有广泛的应用。
例如:在商业领域中,盖斯定律可以解释为什么大公司越来越大,而小公司则越来越小。
大公司拥有更多的资源和市场份额,这使得它们更容易获得更多的客户和利润,并进一步扩大规模。
在科学研究领域中,盖斯定律可以解释为什么少数科学家拥有更多的发表论文、引用次数和奖项。
这些科学家通常可以获得更多资金、资源和合作机会,这使得他们能够进行更深入、更广泛的研究,并获得更多的成就。
在教育领域中,盖斯定律可以解释为什么一些学生比其他学生更容易获得好成绩。
这些学生通常拥有更多的资源、支持和机会,这使得他们能够更好地发挥自己的潜力并取得更好的成绩。
四、如何应对盖斯定律?虽然盖斯定律在许多领域都有广泛应用,但我们仍然可以采取一些措施来缓解其影响。

2025届化学一轮复习夯实练39 盖斯定律及应用1.下列依据热化学方程式得出的结论正确的是( )A .已知Ni(CO)4(s)===Ni(s)+4CO(g) ΔH =Q kJ·mol -1,则Ni(s)+4CO(g)===Ni(CO)4(s) ΔH =-Q kJ·mol -1B .在一定温度和压强下,将0.5 mol N 2和1.5 mol H 2置于密闭容器中充分反应生成NH 3(g),放出热量19.3 kJ ,则其热化学方程式为12N 2(g)+32H 2(g)NH 3(g) ΔH =-19.3 kJ·mol -1C .已知2H 2(g)+O 2(g)===2H 2O(l) ΔH 1,2H 2(g)+O 2(g)===2H 2O(g) ΔH 2,则ΔH 1>ΔH 2D .已知C(s ,石墨)===C(s ,金刚石) ΔH >0,则金刚石比石墨稳定 2.(2023·太原模拟)分别向1 L 0.5 mol·L-1的Ba(OH)2溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应时的热效应分别为ΔH 1、ΔH 2、ΔH 3,下列关系正确的是( ) A .ΔH 1>ΔH 2>ΔH 3 B .ΔH 1<ΔH 2<ΔH 3 C .ΔH 1>ΔH 2=ΔH 3D .ΔH 1=ΔH 2<ΔH 33.(2023·北京市第一六六中学高三期中)以CO 和H 2为原料合成甲醇是工业上的成熟方法,直接以CO 2为原料生产甲醇是目前的研究热点。
我国科学家用CO 2人工合成淀粉时,第一步就需要将CO 2转化为甲醇。
已知:①CO(g)+2H 2(g)===CH 3OH(g) ΔH 1=-90.5 kJ·mol -1 ②CO(g)+H 2O(g)===CO 2(g)+H 2(g) ΔH 2=-41.1 kJ·mol -1 ③2H 2(g)+ O 2(g)===2H 2O(g) ΔH 3=-483.6 kJ·mol -1 下列说法不正确的是( )A .若温度不变,反应①中生成1 mol CH 3OH(l)时,放出的热量大于90.5 kJB .CO 2与H 2合成甲醇的热化学方程式为CO 2(g)+3H 2(g)===CH 3OH(g)+H 2O(g) ΔH =-49.4 kJ·mol -1C .通过电解制H 2和选用高效催化剂,可降低CO 2与H 2合成甲醇反应的焓变D .以CO 2和H 2O 为原料合成甲醇,同时生成O 2,该反应需要吸收能量 4.根据碘与氢气反应的热化学方程式: (ⅰ)I 2(?)+H 2(g)2HI(g) ΔH =-9.48 kJ·mol -1; (ⅱ)I 2(?)+H 2(g)2HI(g) ΔH =+26.48 kJ·mol -1。
盖斯定律练习(解析版)1.以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是()①6CO2(g)+6H2O(1)═C6H12O6(s)+6O2(g)△H1②C6H12O6(s)═2C2H5OH(1)+2CO2(g)△H2③C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1)△H3A.2△H3=﹣△H1﹣△H2B.△H3、△H1、△H2均为△H<0C.在不同油耗汽车中发生反应③,△H3会不同D.植物的光合作用通过反应①将热能转化为化学能【答案】A【解析】A、由盖斯定律可知:﹣①﹣②=③×2,则2△H3=﹣△H1﹣△H2,故A正确;B、假设反应热均小于0,根据2△H3=﹣△H1﹣△H2可知△H2=﹣△H1﹣2△H3,则若△H1<0,△H3<0,则△H2>0,与假设矛盾,故B错误;C、焓变与反应的始态和终态有关,则在不同油耗汽车中发生反应③,△H3相同,故C错误;D、植物的光合作用利用太阳能,将太阳能转化成化学能,故D错误。
故选:A。
2.2021年,NASA宣布将发起“CO2转化挑战赛“,这项研究有助于解决在火星上的生存问题。
下列说法不正确的是()A.△H1=﹣(△H2+△H3+△H4)B.用工业催化剂代替微生物发酵,△H5不变C.葡萄糖的燃烧热为﹣△H1D.“人造转化器”所起的作用就是催化剂【答案】D【解析】A、根据盖斯定律可知△H1=﹣(△H2+△H3+△H4),故A正确;B、催化剂不改变反应热,故用工业催化剂代替微生物发酵,△H5不变,故B正确;C、根据图示可知葡萄糖的燃烧热为﹣△H1,故C正确;D、“人造转化器”的目的使非自发反应反应发生,故D错误;故选:D。
4.2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是()A.△H2>0B.△H4+△H5+△H8=△H1C.在相同条件下,2K(g)→2K+(g)的△H3′<△H3D.△H6+△H7=△H8【答案】B【解析】A.Na从固态变为液态的程中需要吸收热量,则△H2>0,故A正确;B.由盖斯定律可知,过程1为2、3、4、5、6、7的过程之和,则△H2+△H3+△H4+△H5+△H6+△H7=△H1,故B错误;C.由钾原子原子核外有4个电子层,其失去最外层一个电子所需的能量较小,则2K(g)→2K+(g)的△H2<△H3,故C正确;D.由盖斯定律可知△H6+△H7=△H8,故D正确。
(完整版)盖斯定律练习(高考题)提高训练——高考链接1、【12北京】用Cl2生产某些含氯有机物时会产生副产物HC1。
利用反应A,可实现氯的循环利用。
反应A:已知:Ⅰ:反应A中,4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ:①H2O的电子式是_______________②反应A的热化学方程式是______________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl键所需能量相差约为__________KJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
2、【天津】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。
X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
X2M的燃烧热H=-a kJ/mol,写出X2M燃烧反应的热化学方程式______________________________3、【12新课标27】⑵工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1 、-285.8 kJ·mol-1 和-283.0 kJ·mol-1 ,则生成1 m3(标准状况)CO所需热量为_____________;4、【12江苏】4.某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是A、该反应为放热反应B、催化剂能改变反应的焓变C、催化剂能降低反应的活化能D、逆反应的活化能大于正反应的活化能5、(14分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H=a kJ·mol-1 3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ·mol-1①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=______kJ·mol-1(用含a、b的代数式表示)。
盖斯定律练习题1.1H 2S 的燃烧热ΔH = -a kJ·mol -1 ,则H 2S 燃烧反应的热化学方程式为 ;2已知:高温下,在密闭容器中用H 2还原WO 2可得到金属钨;当温度过高时,WO 2s 会转变为WO 2 g;请根据以下反应:①WO 2 s + 2H 2 gW s + 2H 2O g ; ΔH = +66.0 kJ · mol -1 ②WO 2 g + 2H 2 gW s + 2H 2O g ; ΔH = -137.9 kJ · mol -1 计算出WO 2 s WO 2 g ΔH = ______________________;2.已知:①2COg+O 2g =2CO 2g △H =-566kJ/mol②2H 2g+O 2g =2H 2Og △H =-484kJ/mol③CH 4g+2O 2g =CO 2g+2H 2Og △H =-890kJ/mol则:CH 4g+CO 2g =2COg+2H 2g △H =________________________;3.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法;高炉内可能发生的反应:①Cs+O 2g=CO 2g △H 1=-393.5kJ/mol②Cs+ CO 2g 2COg △H 2=+172.5 kJ/mol③4COg+Fe 3O 4s=4CO 2g+3Fes △H 3 =-13.7 kJ/mol则:3 Fes+2 O 2g= Fe 3O 4s ΔH = ________________________;4.已知下列反应的反应热:①CH 3COOHl+2O 2g=2CO 2g+2H 2Ol ΔH 1=-870.3kJ/mol②Cs+O 2g=CO 2g ΔH 2=-393.5kJ/mol③H 2g+1/2O 2g =H 2Ol ΔH 3=-285.8kJ/mol则:2Cs+O 2g+2 H 2g =CH 3COOHl ΔH = _______________________;5.已知反应:①H 2g+21O 2g==H 2Og △H 1 ②N 2g+2O 2==2NO 2g △H 2③12N 2g+23H 2g==NH 3g △H 3 则:4NH 3g+7O 2g==4NO 2g+6H 2Og ΔH =用含△H 1、△H 2、△H 3的式子表示;6.已知:①3Fe 2O 3s+COg2Fe 3O 4s+CO 2g △H=–47 kJ/mol ②Fe 3O 4s+COg3FeOs+CO 2g △H= +19 kJ/mol ③FeOs+COgFes+CO 2g △H=–11 kJ/mol 则:Fe 2O 3s+3COg 2Fes+3CO 2g △H= ;7.甲醇是一种优质燃料,可制作燃料电池;工业上可用下列两种反应制备甲醇:①COg + 2H 2gCH 3OHg ΔH 1 ②CO 2g + 3H 2g CH 3OHg + H 2Og ΔH 2 ③2H 2g+ O 2g=2H 2Og ΔH 3则:2COg +O 2g=2CO 2g ΔH= 用ΔH 1、ΔH 2、ΔH 3表示;8.已知:①N 2g+O 2g= 2NOg △H = a kJ·mol -1②N 2g+3H 2g= 2NH 3g △H 2= b kJ·mol -1③2H 2g+O 2g= 2H 2Og △H = c kJ·mol -1则:4NH 3g +4NOg +O 2g= 4N 2g+6H 2Og △H= ;9.生产水煤气过程中有以下反应:①Cs+CO 2g2COg △H 1; ②COg+H 2OgH 2g+CO 2g △H 2; ③Cs+H 2Og COg+H 2g △H 3;上述反应△H 3与△H 1、△H 2之间的关系为 ;。
盖斯定律的应用和计算复习练习习题例题HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】盖斯定律的应用与计算1.在25℃、1.01×105Pa 下,将22 g CO 2通入1 mol ·L -1NaOH 溶液750mL 中充分反应,测得反应放出x kJ 热量。
在该条件上,1 mol CO 2通入2 mol ·L -1NaOH 溶液1 L 中充分反应放出y kJ 热量。
则CO 2与NaOH 溶液反应生成NaHCO 3的热化学方程式是 ( )A .CO 2(g)+NaOH(a q) === NaHCO 3(a q);△H=-(2y -x) kJ·mol -1B .CO 2(g)+NaOH(a q) === NaHCO 3(a q);△H=-(2x -y) kJ·mol -1C .CO 2(g)+NaOH(a q) === NaHCO 3(a q);△H=-(4x -y) kJ·mol -1D .2CO 2(g)+NaOH(1) === NaHCO 3(1);△H=-(8x -2y) kJ ·mol -12.根据热化学方程式:S(g)+O 2(g)=SO 2(g);△H= -297.23kJ/mol 。
下列说法中正确的是A.S (g)+O 2(g)=SO 2(l); |△H|>297. 3kJ/molB.S(g)+O 2(g)=SO 2(l);|△H|<297. 3kJ/molC.1mol SO 2的键能总和小于1mol S 和1mol O 2键能之和D.1mol SO 2的键能总和等于1mol S 和1mol O 2键能之和3.已知:CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O △H=Q 1kJ /mol21H 2SO 4(浓)+NaOH(aq)=21Na 2SO 4(aq)+H 2O(1) △H=Q 2kJ /molHNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=Q3kJ/mol上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为A.Q1=Q2=Q3B.Q2>Q1>Q3C.Q2>Q3>Q1D.Q2=Q3>Q14、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1下列说法正确的是A.CH3OH的燃烧热为192.9kJ·mol-1 B.反应①中的能量变化如右图所示C.CH3OH转变成H2的过程一定要吸收能量D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>—192.9kJ·mol-15.已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )A.每生成2分子AB吸收b kJ热量B.该反应热ΔH=+(a-b) kJ·mol-1C.该反应中反应物的总能量高于生成物的总能量D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量B6.(2011·临沂二模)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。
盖斯定律及应用一、选择题1、下列关于焓变(ΔH)的叙述或判断中错误的是A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0B.500 ℃、30 MPa下,0.5 mol N2和 1.5 mol H2充分反应放出19.3 kJ 热量,则反应“N 2(g)+3H2(g) 2NH3(g)”的ΔH=-38.6 kJ·mol-1C.据下图1 知:ΔH1= ΔH2+ΔH3D.据下图2 知:E的大小对该反应的ΔH 无影响2、已知CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1; HCl(aq)与NaOH(aq)反应的△H =-55.6 kJ·mol-1。
则CH3COONa和HC1在水溶液中反应的△H等于( )A.-67.7 kJ·mol-1B.-43.5 kJ·mol-1C.+43.5 kJ·mol-1D.+67.7 kJ·mol-13、已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) ΔH=-571.6kJ·mol-1C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2220kJ•mol-1实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为A.2:3B.1:3C.3:2D.3:14、向足量H2SO4溶液中加入100mL 0.4mol/L Ba(OH)2溶液,放出的热量使5.12KJ。
如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1HCl溶液时,放出的热量为2.2 kJ。
则Na2SO4溶液与BaCl2溶液反应的热化学方程式为A.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1B.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1C.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1D.Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-15、在298 K、101 kPa时,已知:①2H2 (g)+O2 (g) ===2H2O(g) ΔH1②Cl2(g)+H2(g)===2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3则ΔH3与ΔH1和ΔH2间的关系正确的是()A.ΔH3=2ΔH2-ΔH1B.ΔH3=ΔH1+ΔH2C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH26、室温下将1mol 的CuSO 4·5H 2O (s )溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s )溶于水会使溶液温度升高,热效应为△H 2;CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O (s )═CuSO 4(s )+5H 2O (l ),热效应为△H 3.则下列判断正确的是( )A .△H 2>△H 3B .△H 1>△H 3C .△H 1=△H 2+△H 3D .△H 1+△H 2>△H 37、已知:Fe 2O 3(s )+C (s )=CO 2(g )+2Fe (s )△H=+234.1kJ•mol ﹣1C (s )+O 2(g )=CO 2(g )△H=﹣393.5kJ•mol ﹣1则2Fe (s )+O 2(g )=Fe 2O 3(s )的△H 是( )A .﹣824.4kJ•mol ﹣B .﹣627.6kJ•mol ﹣1C .+744.7kJ•mol ﹣1D .﹣169.4kJ•mol ﹣18、已知:①CH 4(g)+ 2(g)=CO(g)+2H 2O(l) △H= -a kJ·mol -1 ② 2C(s)+O 2(g) =2CO(g) △H=-b kJ·mol -1③ C(s)+CO 2(g)=2CO(g) △H=+c kJ·mol -1且a 、b 、c 均大于0,则甲烷的燃烧热(△H)为( )AB C .()-22/a b c kJ mol ++D .()22/a b c kJ mol +++9、在1 200 ℃时,天然气脱硫工艺中会发生下列反应H 2S(g)+32O 2(g)=SO 2(g)+H 2O(g) ΔH 1 2H 2S(g)+SO 2(g)= 32S 2(g)+2H 2O(g) ΔH 2 H 2S(g)+ 12O 2(g)=S(g)+H 2O(g) ΔH 32S(g)=S2(g) ΔH4则ΔH4的正确表达式为()A.ΔH4=23(ΔH1+ΔH2-3ΔH3)B.ΔH4=23(3ΔH3-ΔH1-ΔH2)C.ΔH4=32(ΔH1+ΔH2-3ΔH3)D.ΔH4=32(ΔH1-ΔH2-3ΔH3)10、已知2P(s)+3Cl2(g)=2PCl3(g)△H=﹣612kJ•mol﹣1.PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ•mol﹣1.则P(s)+Cl2(g)=PCl5(g)的△H是()A.﹣705kJ•mol﹣1B.﹣399kJ•mol﹣1C.﹣203kJ mol﹣1D.﹣213kJ•mol﹣111、现有三个热化学方程式:(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol(3)H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )A.-488.3 kJ/molB.+488.3 kJ/molC.-2 228.9 kJ/molD.+191 kJ/mol12、已知:①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1②CO(g)+1/2O2(g) ===CO2(g) ΔH=-283 kJ·mol-1③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1则反应Fe2O3(s)+3C(s)+ 3/2O2(g) ===2Fe(s)+3CO2(g)的焓变是A.-355 kJB.+355 kJC.-355 kJ • mol-1D.+355 kJ • mol-1二、答案1、B解析:A选项,由反应方程式可知正反应是熵减过程(ΔS<0),故反应在常温下能自发进行,其焓变(ΔH)必须小于0,故A正确;B选项,因N 2(g)+3H2(g) 2NH3(g)是可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应,若完全反应放出热量应大于19.3 kJ ,故B 错误;知识点:盖斯定律及应用2、B解析:根据题意可写出两个热化学方程式:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-12.1kJ/mol (①式)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-55.6kJ/mol (②式)用盖斯定律,将②式-①式得CH3COONa(aq)+HCl(aq)=CH3COOH(aq)+NaCl(aq) ΔH=(-55.6kJ/mol)-(-12.1kJ/mol)=-43.5kJ/mol,答案选B。
盖斯定律的应用与计算1.在25℃、1.01×105Pa 下,将22gCO 2通入1mol ·L -1NaOH 溶液750mL 中充分反应,测得反应放出xkJ 热量。
在该条件上,1molCO 2通入2mol ·L -1NaOH 溶液1L 中充分反应放出ykJ 热量。
则CO 2与NaOH 溶液反应生成NaHCO 3的热化学方程式是() A .CO 2(g)+NaOH(a q)===NaHCO 3(a q);△H=-(2y -x)kJ·mol -1 B .CO 2(g)+NaOH(a q)===NaHCO 3(a q);△H=-(2x -y)kJ·mol -1 C .CO 2(g)+NaOH(a q)===NaHCO 3(a q);△H=-(4x -y)kJ·mol -1D .2CO 2(g)+NaOH(1)===NaHCO 3(1);△H=-(8x -2y)kJ ·mol -12.根据热化学方程式:S(g)+O 2(g)=SO 2(g);△H=-297.23kJ/mol 。
下列说法中正确的是A.S (g)+O 2(g)=SO 2(l);|△H|>297.3kJ/molB.S(g)+O 2(g)=SO 2(l);|△H|<297.3kJ/molC.1molSO 2的键能总和小于1molS 和1molO 2键能之和D.1molSO 2的键能总和等于1molS 和1molO 2键能之和3.已知:CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O △H=Q 1kJ /mol21H 2SO 4(浓)+NaOH(aq)=21Na 2SO 4(aq)+H 2O(1)△H=Q 2kJ /mol HNO 3(aq)+KOH(aq)=KNO 3(aq)+H 2O(1)△H=Q 3kJ /mol上述反应均为溶液中的反应,则Q 1、Q 2、Q 3的绝对值大小的关系为 A.Q 1=Q 2=Q 3B.Q 2>Q 1>Q 3C.Q 2>Q 3>Q 1D.Q 2=Q 3>Q 14、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g);△H =+49.0kJ ·mol -1 ②CH 3OH(g)+1/2O 2(g)=CO 2(g)+2H 2(g);△H =-192.9kJ ·mol -1 下列说法正确的是A .CH 3OH 的燃烧热为192.9kJ ·mol -1B .反应①中的能量变化如右图所示C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应CH 3OH(l)+1/2O 2(g)=CO 2(g)+2H 2(g) 的△H >—192.9kJ ·mol -15.已知化学反应A 2(g)+B 2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )A .每生成2分子AB 吸收b kJ 热量B.该反应热ΔH=+(a-b)kJ·mol-1C.该反应中反应物的总能量高于生成物的总能量D.断裂1molA—A和1molB—B键,放出a kJ能量B 6.(2011·临沂二模)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7kJ/molB.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1076.7kJ/molD.N2H4(g)+N2O4(g)===N2(g)+2H2O(g) ΔH=-1076.7kJ/mol 7.将1000mL0.1mol·L-1BaCl2溶液与足量稀硫酸充分反应放出a kJ 热量;将1000mL0.5mol·L-1HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将500mL1mol·L-1H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( ) A.(5a-2b)kJ B.(2b-5a)kJC.(5a+2b)kJ D.(10a+4b)kJ8.有关键能数据如表22△H=-989.2/kJ·mol-1,则X的值为()A.423.3 B.460C.832D.9209.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。
键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
下列是一些化学键的键能。
键能/(kJ ·mol 1-)414 489 565 155根据键能数据估算下列反应的反应热ΔH 为:CH 4(g )+4F 2(g)=CF 4+4HF(g )()A.–1940kJ·mol -1B.1940kJ·mol -1C.–485kJ·mol -1D.485kJ·m ol -110.已知()()()22H g Br l 2HBr g ;72kJ/mol.H +=∆=-蒸发1molBr 2(l )需要吸收的能量为30kJ ,其它相关数据如下表: 则表中a 为A .404B .260C .230D .20011.在298K 、100kPa 时,已知:2222()(g)2()H O g O H g =+⊿1H22(g)(g)2l(g)Cl H HC +=⊿2H2222(g)2(g)4l(g)(g)Cl H O HC O +=+⊿3H则⊿3H 与⊿1H 和⊿2H 间的关系正确的是() A.⊿3H =⊿1H +2⊿2H B ⊿3H =⊿1H +⊿2H C.⊿3H =⊿1H -2⊿2H D.⊿3H =⊿1H -⊿2H12.甲醇是人们开发和利用的一种新能源。
已知:①2H 2(g)+O 2(g)===2H 2O(l) ΔH 1=-571.8kJ/mol ;②CH 3OH(g)+1/2O 2(g)===CO 2(g)+2H 2(g)ΔH 2=-192.9kJ/mol 。
(1)甲醇 蒸气完全燃烧的热化学反应方程式为________________________________________________________________________________________________________。
(2)反应②中的能量变化如图所示,则ΔH 2=________kJ/mol(用E 1、E 2表示)13.?2005广东22·4?由金红石?TiO 2?制取单质Ti ,涉及到的步骤为::TiO 2TiCl 4−−−−→−ArC /800/0镁Ti 已知:①C ?s ?+O 2?g ?=CO 2?g ?;?H 1=?393?5kJ ·mol ?1 ②2CO ?g ?+O 2?g ?=2CO 2?g ?;?H 2=?566kJ ·mol ?1③TiO 2?s ?+2Cl 2?g ?=TiCl 4?s ?+O 2?g ?;?H 3=+141kJ ·mol ?1 则TiO 2?s ?+2Cl 2?g ?+2C ?s ?=TiCl 4?s ?+2CO ?g ?的?H =。
14.发射卫星时可用肼(N 2H 4)为燃料和NO 2作氧化剂,这两者反应生成N 2和水蒸气.又已知:①N 2(气)+2O 2(气)==2NO 2(气);△H=+67.7kJ/mol②N 2H 4(气)+O 2(气)=N 2(气)+2H 2O(气);△H=-534kJ/mol试写出肼与NO2反应的热化学方程式15.(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
(2)量取反应物时,取50mL0.50mol·L-1的盐酸,还需加入的试剂是(填序号)。
A.50mL0.50mol·L-1NaOH溶液B.50mL0.55mol·L-1NaOH溶液C.1.0gNaOH固体(3)已知稀盐酸与稀氢氧化钠溶液反应的中和热ΔH=-57.3kJ·mol-1,请用离子方程式表示该中和反应的热化学方程式。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为。
16.(15分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。
甲烷气体燃烧和水汽化的热化学方程式分别为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3kJ·mol-1,H2O(l)===H2O(g) ΔH=+44kJ·mol-1;则356 g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为_________________。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为_________________________________________;(3)家用液化气中主要成分之一是丁烷。
当1 g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。
试写出丁烷燃烧反应的热化学方程式____________________________。
(4)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H 2(g)CH3OH(g)ΔH=-90.7kJ·mol-12CH 3OH(g)CH3OCH3(g)+H2O(g)ΔH=-23.5kJ·mol-1CO(g)+H 2O(g)CO2(g)+H2(g)ΔH=-41.2kJ·mol-1则CO2和氢气合成CH3OCH3(g)的热化学方程式为______________________________________________________________________。