热化学方程式的书写和盖斯定律的练习题
- 格式:docx
- 大小:35.21 KB
- 文档页数:5

热化学方程式与盖斯定律2013--2014全国高考题汇编(2014·全国卷Ⅰ)28、已知:甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol -1甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))△H3=+50.7KJ·mol -1则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=KJ·mol -1(2014·重庆卷)⒍已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-12C(s)+O2(g)=2CO(g) ΔH =-220kJ·mol-1H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )A.-332 B.-118 C.+350 D.+130(2014·广东卷)31.(16分)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)(2014·江苏卷)10.已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2 2CO(g)+O2(g)=2CO2(g) △H34Fe(s)+3O3(g)=2Fe2O3(s) △H43 CO(g)+Fe 2O 3(s)=3CO 2(g)+2Fe(s) △H 5下列关于上述反应焓变的判断正确的是( )A .△H 1>0,△H 3<0B .△H 2>0,△H 4>0C .△H 1=△H 2+△H 3D .△H 3=△H 4+△H 5[2013∙海南卷∙5]已知下列反应的热化学方程式:6C(s)+5H 2(g)+3N 2(g)+9O 2(g)=2C 3H 5(ONO 2)3(l)△H 12 H 2(g)+ O 2(g)=2H 2O(g)△H 2 C(s)+ O 2(g)=CO 2(g) △H 3则反应4C 3H 5(ONO 2)3(l)=12CO 2(g)+10H 2O(g) + O 2(g) +6N 2(g)的△H 为( )A .12△H 3+5△H 2-2△H 1B .2△H 1-5△H 2-12△H 3C .12△H 3-5△H 2-2△H 1D .△H 1-5△H 2-12△H 3[2013高考∙江苏卷∙20]白磷(P 4)可由Ca 3(PO 4)2、焦炭和SiO 2 在一定条件下反应获得。

1、已知热化学反应方程式: Zn(s)+21O 2(g)ZnO(s) ΔH =-351.5 kJ·mol -1; Hg(l)+21O 2(g) HgO(s);ΔH =-90.84 kJ ·mol -1, 则热化学反应方程式:Zn(s)+HgO(s) ZnO(s)+Hg(l)的ΔH 为( )A.ΔH =+260.7 kJ·mol -1B.ΔH =-260.7 kJ·mol -1C.ΔH =-444.2 kJ·mol -1D.ΔH =+444.2 kJ·mol -12、已知: Fe 2O 3 ( s ) + 3/2C ( s ) =3/ 2CO 2 (g )+2Fe(s) ΔH 1C ( s ) + O 2 ( g ) =CO 2 ( g ) ΔH 2则4Fe(s) + 3O 2 ( g )=2Fe 2O 3 ( s ) 的△H 是( )A. 2ΔH 1 +3ΔH 2B. 3ΔH 2 -2ΔH 1C. 2ΔH 1 -3ΔH 2D. 3/2ΔH 2 - ΔH 13、钛(Ti )被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti ,涉及的步骤为:已知①C(s)+O 2(g) CO 2(g);ΔH =-393.5 kJ·mol -1① 2CO(g)+O 2(g) 2CO 2(g);ΔH =-566 kJ·mol -1③TiO 2(s)+2Cl 2(g)==TiCl 4(s)+O 2(g);ΔH =+141 kJ·mol -1则TiO 2(s)+2Cl 2(g)+2C(s) TiCl 4(s)+2CO(g)的ΔH= 。
4、家用液化气中主要成分之一是丁烷。
在101 kPa 时,10 kg 丁烷完全燃烧生成CO 2和H 2O (l )放出热量5×105 kJ 丁烷的燃烧热为 ,丁烷燃烧的热化学方程式为: 。
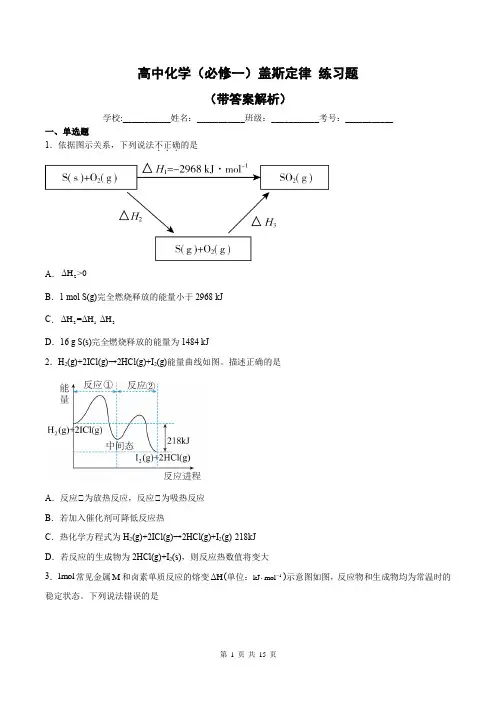
高中化学(必修一)盖斯定律练习题(带答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.依据图示关系,下列说法不正确...的是ΔH>0A.2B.1 mol S(g)完全燃烧释放的能量小于2968 kJΔH=ΔH-ΔHC.213D.16 g S(s)完全燃烧释放的能量为1484 kJ2.H2(g)+2ICl(g)→2HCl(g)+I2(g)能量曲线如图。
描述正确的是A.反应①为放热反应,反应①为吸热反应B.若加入催化剂可降低反应热C.热化学方程式为H2(g)+2ICl(g)→2HCl(g)+I2(g)-218kJD.若反应的生成物为2HCl(g)+I2(s),则反应热数值将变大3.1mol常见金属M和卤素单质反应的熔变ΔH(单位:1⋅)示意图如图,反应物和生成物均为常温时的kJ mol-稳定状态。
下列说法错误的是A .2MBr 与2Cl 反应的ΔH<0B .由2MCl (s)分解制得M 的反应是吸热反应C .化合物的热稳定性顺序:2222MI MBr MCl MF >>>D .2222MF (s)Br (l)MBr (s)F (g)+=+ -1ΔH=+600kJ mol ⋅4.硫酸工业中的钒催化剂参与反应的相对能量变化如图所示,下列热化学方程式错误的是A .-1243252V O (s)+SO (g)V O (s)+SO (g)ΔH=-24kJ mol ⋅ B .-142432VOSO (s)V O (s)+2SO (g)ΔH=+200kJ mol ⋅C .-12524242V O (s)+2SO (g)2VOSO (s)+V O (s)ΔH=-352kJ mol ⋅D .-125234V O (s)+SO (g)+SO (g)2VOSO (s)ΔH=-376kJ mol ⋅ 5.N 2O 和CO 是环境污染性气体,可在Pt 2O +表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。

1.(2021年高考河北卷)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。
已知25℃时,相关物质的燃烧热数据如表:则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________。
2.(2020年高考全国2卷)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:①ΔH=_________kJ·mol−1。
3.(2020年高考天津卷)理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是A. HCN比HNC稳定ΔH=+59.3kJ molB. 该异构化反应的-1C. 正反应的活化能大于逆反应的活化能D. 使用催化剂,可以改变反应的反应热4.(2021年1月浙江选考)已知共价键的键能与热化学方程式信息如下表:则2O(g)=O2(g)的ΔH为A.428kJ·mol-1B.-428kJ·mol-1C.498kJ·mol-1D.-498kJ·mol-15.(2019年高考全国3卷)Deacon 直接氧化法可按下列催化过程进行:CuCl 2(s)=CuCl(s)+12Cl 2(g) ΔH 1=83 kJ·mol -1 CuCl(s)+12O 2(g)=CuO(s)+12Cl 2(g) ΔH 2=-20 kJ·mol -1CuO(s)+2HCl(g)=CuCl 2(s)+H 2O(g) ΔH 3=-121 kJ·mol -1 则4HCl(g)+O 2(g)=2Cl 2(g)+2H 2O(g)的ΔH =_________ kJ·mol -1。
6.(2017年高考全国1卷)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
热化学硫碘循环水分解制氢系统(Ⅰ)()()()()242221H SO aq ===SO g H O l O g 2++11327kJ mol H -∆=⋅()()()()()22224SO g I s 2H O l 2HI aq H SO aq ++===+12151kJ mol H -∆=-⋅ ()()()222HI aq H g I s ===+13110kJ mol H -∆=⋅ ()()()()()22422H S g H SO aq S s SO g 2H O l +===++1461kJ mol H -∆=⋅热化学硫碘循环硫化氢分解联产氢气、硫磺系统(Ⅱ)通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为__________________________、______________________,制得等量2H 所需能量较少的是____________。

高中化学盖斯定律热化学反应方程式专项练习题一、单选题1.在101kPa 和25℃时,有关反应的热化学方程式如下: ()()()2C s +1/2O g =CO g -11=-110.5kJ mol H ∆⋅, ()()()222H g +1/2O g =H O g -12=-241.7kJ mol H ∆⋅, ()()()222H g +1/2O g =H O l -13=-285.8 kJ mol H ∆⋅下列说法正确的是( )A.()()()()22C s +H O g =CO g +H g -1-131.2 kJ mol H ∆=⋅B.2H 燃烧热的热化学方程式为()()()2222H g +O g =2H O l -1=-571.6 kJ mol H ∆⋅C.()()()2222H O g =H g +O g -1=-483.4 kJ mol H ∆⋅D.()()22H O g =H O l -1= -44.1 kJ mol H ∆⋅ 2.下列说法正确的是( )A.在101kPa 时,1mol 纯物质完全燃烧时所放出的热量,叫做该物质的燃烧热B.酸和碱发生中和反应生成1mol 水,这时的反应热叫中和热C.燃烧热或中和热是反应热的种类之一D.在稀溶液中,1mol 3CH COOH 和1mol NaOH 完全中和时放出的热量为57.3 kJ3.最新报道:科学家首次用X 射线激光技术观察到CO 与O 在催化剂表面形成化学键的过程。
反应过程的示意图如下:下列说法正确的是( )A.CO 和O 生成2CO 是吸热反应B.在该过程中,CO 断键形成C 和OC.CO 和O 生成了具有极性共价键的2COD.状态I→状态III 表示CO 与2O 反应的过程4.通过以下反应均可获取2H 。
下列有关说法正确的是( )①太阳光催化分解水制氢:-122212H O(l)=2H (g)+O (g)571.6kJ mol H ∆=⋅②焦炭与水反应制氢:-1222C(s)+H O(g)=CO(g)+H (g)131.3kJ mol H ∆=⋅ ③甲烷与水反应制氢:-14223CH (g)+H O(g)=CO(g)+3H (g)206.1kJ mol H ∆=⋅A.反应①中电能转化为化学能B.反应②为放热反应C.反应③使用催化剂,3H ∆减小D.反应42CH (g)=C(s)+2H (g)的-174.8kJ mol H ∆=⋅ 5.已知:① C(s)+O 2(g)=CO 2(g) ΔΗ1=-394kJ·mol -1 ② H 2(g)+12O 2(g)=H 2O(g) ΔΗ2=-242kJ·mol -1 ③ 2C 2H 2(g)+5O 2(g)=4CO 2(g)+2H 2O(g) ΔΗ3=-2510kJ·mol -1 ④ 2C(s)+H 2(g)=C 2H 2(g) ΔΗ4 下列说法正确的是( )A.反应①放出197kJ 的热量时,转移电子的数目为4N AB.由反应②可知,1mol 水蒸气分解放出的热量为242kJC.反应③是表示C 2H 2燃烧热的热化学方程式D.ΔΗ4=2ΔΗ1+ΔΗ2-12ΔΗ3 6.臭氧层中臭氧的分解历程如图所示,下列说法正确的是( )A.催化反应① 、② 均为放热反应B.催化剂不能改变总反应的焓变C.ClO 是总反应的催化剂D.在总反应过程中没有化学键的断裂与形成7.已知一定温度下:① N 2(g)+O 2(g)=2NO(g) ΔΗ1=+180kJ·mol -1, ② N 2(g)+3H 2(g)2NH 3(g) ΔΗ2=-92.4kJ·mol -1,③ 2H 2(g)+O 2(g)=2H 2O(g) ΔΗ3=-483.6 kJ·mol -1。

一、 选择题1.下列过程一定释放出能量的是( )A.化合反应B.分解反应 C .原子组成分子 D.分子拆成原子2.下列各图中,表示正反应是吸热反应的图是 ( )3.下列反应既属于氧化还原反应,又属于吸热反应的是( )A 灼热的碳与CO 2的反应B Ba(OH)2·8H 2O 与NH 4Cl 的反应C 铝片与稀盐酸反应D 甲烷在氧气中的燃烧反应4.下列说法正确的是A.化学反应都伴随着能量的变化B.个别化学反应与能量变化无关C.化学反应都要放出能量D.放热反应的发生无需任何条件5.下列说法正确( )A .需要加热才能发生的反应一定是吸热反应B .吸热反应不加热的条件一定不能发生C .放热的反应在常温下一定很容易发生D .反应是放热的还是吸热的须看反应物和生成物所具有的总能量的相对大小6.已知(l )H 2(g )+1/2O 2(g )=H 2O (g ); △H 1=a kJ/mol(2)2H 2(g )+O 2(g )=2H 2O (g ); △H 2=b kJ/mol(3)H 2(g )+1/2O 2(g )=H 2O (l ); △H 3=c kJ/mol(4)2H 2(g )+O 2(g ) =2H 2O (l ); △H 4=d kJ/mol下列关系式中正确的是 ( )A . a <c <0B .b >d >0C .2a =b <0D .2c =d >07.1mol 碳完全燃烧后可放出393.5KJ 的热量,下列热化学方程式正确的是 ( )A .C (固)+O 2(气)=CO 2(气); △H =+393.5 kJ/molB .C (固)+21O 2(气)=CO (气); △H =-393.5 kJ/mol C .C + O 2 = CO 2 ; △H =-393.5 kJ/molD .C (固)+O 2(气)=CO 2(气); △H =-393.5 kJ/mol8.在一定条件下,CO 和CH 4燃烧的热化学方程式分别为:2CO(g) + O 2(g) = 2CO 2(g) △H =-566 kJ/mol ;CH 4(g) + 2O 2(g) = CO 2(g) + 2H 2O(l) △H =-890 kJ/mol 由1molCO 和3molCH 4组成的混和气在上述条件下完全燃烧时,释放的热量为( )A .2912kJB .2953kJC .3236kJD .3867kJ9.强酸和强碱的稀溶液的中和热可表示为:H +(aq)+OH -(aq)=H 2O(1) △H = -57.3kJ /mol已知:CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O △H =- Q 1kJ /mol 1/2 H 2SO 4(浓) + NaOH(aq) == 1/2Na 2SO 4(aq) +H 2O(1) △H =- Q 2kJ /mol HNO 3(aq)+KOH(aq)=KNO 3(aq)+H 2O(1) △H =- Q 3kJ /mol 上述反应均为溶液中的反应,则Q 1、Q 2、Q 3的绝对值大小的关系为( )(A)Q 1=Q 2=Q 3 (B)Q 2>Q 1>Q 3 (C)Q 2>Q 3>Q 1 (D)Q 2=Q 3>Q 110.已知下列两个热化学方程式:2H 2(g )+O 2(g )=2H 2O (l );ΔH =-571.6kJ/molC 3H 8(g )+5O 2(g )=3CO 2(g )+4H 2O (l );ΔH =-2220kJ/mol实验测得氢气和丙烷的混合气体共5mol ,完全燃烧时放出热量3847kJ ,则混合气体中 氢气和丙烷的体积比为( )A . 1:3B .1:4C . 3:1D .1:111.1g 碳与适量水蒸气反应生成CO 和H 2,需吸收10.94KJ 热量,此反应的热化学方程式为A .C + H 2O == CO + H 2 ; ΔH == +131.3KJ ·mol —1B .C(s)+ H 2O(g) == CO(g) + H 2(g) ; ΔH == +10.94KJ ·mol —1C .C(s)+ H 2O(l) == CO(g) + H 2(g) ; ΔH == +131.3KJ ·mol —1D .C(s)+ H 2O(g) == CO(g) + H 2(g) ; ΔH == +131.3KJ ·mol —112. 已知101KPa 时的辛烷的燃烧热为-5518kJ/mol ,强酸与强碱在稀溶液中发生反应时的中和热为-57.3kJ/mol ,则下列热化学方程式书写正确的是( )①C 8H 18(l )+ 25/2O 2(g )= 8CO 2(g )+ 9H 2O (l ); △H = +5518kJ/mol②C 8H 18(l )+ 25/2O 2(g )= 8CO 2(g )+ 9H 2O (l ); △H = -5518kJ/mol③H +(aq )+ OH —(aq )= H 2O (l ); △H = -57.3kJ/mol④1/2H 2SO 4(aq) + NaOH(aq) =1/2Na 2SO 4(aq) + H 2O(l); △H = +57.3kJ/molA .①③B .②③C .②④D .②13、已知H —H 键能为436 KJ/mol ,H —N 键能为391KJ/mol ,根据化学方程式:N 2 + 3H 2 = 2NH 3ΔH=-92.4 KJ/mol ,则N ≡N 键的键能是 ( )A .431 KJ/molB .946 KJ/molC .649 KJ/molD .869 KJ/mol14、下列关于反应热的说法正确的是A .当∆H 为“-”时,表示该反应为吸热反应B .已知C(s)+21O 2(g)=CO(g)的反应热为110.5kJ/mol ,说明碳的燃烧热为110.5kJ C .反应热的大小与反应物所具有的能量和生成物所具有的能量无关D .化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关15.下列说法或表示方法正确的是( )A .等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多B .由C (石墨)= C (金刚石);△H =+1.90 kJ/mol 可知,金刚石比石墨稳定C .在101kPa 时,2g 氢气完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)= 2H 2O(l); △H =-285.8kJ/molD .在稀溶液中,H +(aq)+ OH -(aq) = H 2O(l); △H =-57.3kJ/mol,若将含0.5molH 2SO 4的浓硫酸与含1molNaOH 的溶液混合,放出的热大于57.3kJ16.下列说法中正确的是A .在化学反应过程中,发生物质变化的同时不一定发生能量变化B .生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应C .反应产物的总焓大于反应物的总焓时,反应吸热,ΔH >0D .ΔH 的大小与热化学方程式的计量系数无关二 填空题科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。

高二化学热化学方程式、盖斯定律、燃烧热练习题一、单选题1.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )A.2H 2(g) +O2(g)2H2O(l) △H1,2H 2(g)+O2(g)2H2O(g) △H2B.C(s)+1/2O 2(g)CO(g) △H1C(s)+O(g)CO 2(g) △H2C.S(g)+O 2(g)SO2(g) △H1S(s)+O 2(g)SO2(g) △H2D.H 2(g)+Cl2(g)2HCl(g) △H11/2H 2(g) +1/2Cl2(g)HCl(g) △H22.根据热化学方程式:S(s)+O 2(g)SO2(g) ΔH=a kJ·mol-1(a=-297.2),判断下列说法中不正确的是( )A.S(s)在O2(g)中燃烧的反应是放热反应B.S(g)+O 2(g)SO2(g) ΔH=b kJ·mol-1,则a<bC.1mol SO2(g)所具有的能量低于1mol S(s)与1mol O2(g)所具有的能量之和D.16g固体硫在氧气中充分燃烧,可放出148.6kJ热量3.下列说法错误的是( )A.热化学方程式中,各物质的化学计量数不表示分子个数,只代表该物质的物质的量B.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据C.同一化学反应,化学计量数不同,则ΔH不同;化学计量数相同而状态不同,ΔH也不相同D.化学反应过程中所吸收或放出的热量与参加反应的物质的物质的量成正比4.化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )A.N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c) kJ·mol-1B.N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a) kJ·mol-1C.12N2(g)+32H2(g)=NH3(l) ΔH=(b+c-a) kJ·mol-1D.12N2(g)+32H2(g)=NH3(g) ΔH=(a+b) kJ·mol-15.下列有关化学反应与能量变化的说法正确的是( )A.甲烷的燃烧热为890.3kJ·mol-1,则1mol甲烧燃烧时放出的热量一定为890.3kJB.氢气和氧气反应生成液态水时比生成等量的气态水时所放出的热量少C.由图可知,金刚石的燃烧热比石墨的燃烧热大D.铁在纯氧中完全燃烧时放出的热量就是其燃烧热6.已知反应:①25 ℃、101kPa时,2C(s)+O 2(g) 2CO(g) ΔH=‒221kJ·mol‒1,②稀溶液中,H+(aq)+OH‒(aq) H 2O(l) ΔH=‒57.3kJ·mol‒1。

盖斯定律及应用练习题【基础达标】1.已知C(s)+H2O(g)=CO(g)+H2(g)ΔH=+130kJ•mol-12C(s)+O2(g)=2CO(g)ΔH=-220kJ•mol-1H-H、O=O和O-H键的键能分别为436 kJ•mol-1、a kJ•mol-1和462kJ•mol-1,则a为()A.496B.118C.350D.130【答案】A【解析】试题分析:已知热化学方程式①C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-220kJ/mol,则根据盖斯定律可知②-①×2即得到热化学方程式O2(g)+2H2(g)=2H2O(g)△H=-(220+2×130)kJ/mol。
由于反应热等于断键吸收的能量与形成新化学键所放出的能量的差值,则akJ/mol+2×436 kJ/mol-2×2×462 kJ/mol=-(220+2×130)kJ/mol,解得a=496,答案选A。
考点:考查盖斯定律的应用2.已知CH4(g)+2O2(g)→CO2(g)+2H2O(g)ΔH== -Q1;2H2(g)+O2(g)→2H2O(g)ΔH== -Q2;H2O(g)→H2O(l)ΔH==-Q3常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为()A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3【答案】D【解析】试题分析:本题涉及盖斯定律的内容,物质燃烧后恢复到常温,所以考虑水的状态,则甲烷燃烧的热方程式表示为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)ΔH==-(Q1+2Q3);氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)ΔH==-(Q2+2Q3),由题意判断甲烷的物质的量为5mol,氢气的物质的量为1mol,计算得到放出的热量为:4Q1+0.5Q2+9Q3。

盖斯定律练习题(打印版)## 盖斯定律练习题### 一、选择题1. 根据盖斯定律,下列反应中哪一个反应的热效应与反应①2H₂(g)+ O₂(g) → 2H₂O(g)和反应②2H₂(g) + O₂(g) → 2H₂O(l)的热效应之和相等?A. 4H₂(g) + 2O₂(g) → 4H₂O(g)B. 4H₂(g) + 2O₂(g) → 4H₂O(l)C. 2H₂(g) + O₂(g) → 2H₂O(l) + 2H₂O(g)D. 2H₂(g) + O₂(g) → 2H₂O(g) + 2H₂O(l)2. 盖斯定律表明,如果一个化学反应可以通过一系列其他化学反应的组合来实现,那么这个反应的热效应与直接进行该反应的热效应相同。
以下哪个选项正确地描述了盖斯定律?A. 反应的热效应仅取决于反应物和生成物的量。
B. 反应的热效应仅取决于反应物的量。
C. 反应的热效应仅取决于生成物的量。
D. 反应的热效应取决于反应物和生成物的量以及反应的路径。
### 二、计算题3. 已知反应①:C(s) + O₂(g) → CO₂(g),ΔH₁ = -393.5kJ/mol;反应②:CO(g) + ½O₂(g) → CO₂(g),ΔH₂ = -283.0kJ/mol。
利用盖斯定律,计算反应C(s) + CO₂(g) → 2CO(g)的ΔH。
4. 已知反应③:H₂(g) + Cl₂(g) → 2HCl(g),ΔH₃ = -185.0kJ/mol;反应④:2HCl(g) → 2HCl(s),ΔH₄ = -92.3 kJ/mol。
利用盖斯定律,计算反应H₂(g) + Cl₂(g) → 2HCl(s)的ΔH。
### 三、简答题5. 盖斯定律在化学反应热力学研究中有何重要性?6. 简述如何使用盖斯定律来确定一个未知反应的热效应。
答案:1. B2. A3. 根据盖斯定律,我们可以将反应①和反应②相加得到目标反应,因此ΔH = ΔH₁ + ΔH₂ = -393.5 kJ/mol + (-283.0 kJ/mol) = -676.5 kJ/mol。

第三节盖斯定律化学反应热的计算中和热:在稀溶液中,酸与碱发生中和反应生成1mol H2O时所释放的热量称为中和热。
强酸与强碱反应生成可溶性盐的热化学方程式为:H+(aq)+ OH- (aq) == H2O(l) △H= -57.3kJ/mol盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
即化学反应的反应热只与反应体系的始态和终态有关,而与反应途径无关。
假设反应体系的始态为S,终态为L,若S→L,△H﹤0;则L→S,△H﹥0。
1、100g碳燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s)+1/2 O2(g)==CO(g)△H=-110.35 kJ·mol-1,CO(g)+1/2 O2(g)===CO2(g) △H=—282.57kJ·mol-1与这些碳完全燃烧相比较,损失的热量是( )A、392.92kJB、2489.44kJC、784.92kJD、3274.3kJ2、火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸汽。
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ·mol-1 N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1则1mol气体肼和NO2完全反应时放出的热量为( )A、100.3kJB、567.85kJC、500.15kJD、601.7kJ3、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H=-Q1kJ·mol-1H2(g)+O2(g)==2H2O(g) △H=-Q2kJ·mol-1H2(g)+O2(g)==2H2O(l) △H=-Q3kJ·mol-1常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况),经完全燃烧后恢复到到常温,放出的热量(单位:kJ)为( )A、0.4Q1+0.05Q3B、0.4Q1+0.05Q2C、0.4Q1+0.1Q3D、0.4Q1+0.2Q34、充分燃烧一定量丁烷气体放出的热量为Q,完全吸收它生成的CO2生成正盐,需要5mol·L-1的kOH溶液100mL ,则丁烷的燃烧热为( )A、16QB、8QC、4QD、2Q5、已知胆矾溶于水时溶液温度降低。

高考化学专题-热化学方程式与盖斯定律1、下列反应符合如图所示能量关系的是A、金属钠与水的反应B、氢气燃烧C、浓硫酸的稀释D、Ba(OH)2·8H2O与NH4Cl晶体混合搅拌2、下列反应既属于氧化还原反应,又属于放热反应的是A、灼热的炭与 C O2的反应B、高温下碳酸钙分解的反应C、铝热反应D、酸与碱的中和反应3、SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1 mol S(s) 转化为气态硫原子吸收能量280 kJ,断裂1 mol F-F、S-F键需要吸收的能量分别为160 kJ、330 kJ,则S(s)+3F2(g) === SF6(g)的反应热ΔH为A. 1220 kJ·mol-1B.-1980 kJ·mol-1C.-1220 kJ·mol-1D.-620 kJ·mol-14、下列描述中正确的是A、CO(g)的燃烧热ΔH是-283.0 kJ·mol-1,则2CO2(g) === 2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ·mol-1B、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热C、HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。
则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量5、中和热测定实验中,一定会降低准确性的操作是A、用滴定管(读数保留到0.01)取所用酸碱溶液的体积B、NaOH溶液在倒入小烧杯时,有少量溅出C、大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多D、测量HCl溶液的温度计用水洗净后再测NaOH溶液温度6、(2017·江苏,8)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
下列说法不正确的是①C(s)+H2O(g) === CO(g)+H2(g)ΔH1=a kJ·mol-1①CO(g)+H2O(g) === CO2(g)+H2(g)ΔH2=b kJ·mol-1①CO2(g)+3H2(g) === CH3OH(g)+H2O(g)ΔH3=c kJ·mol-1①2CH3OH(g)=== CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1A、反应①、①为反应①提供原料气B、反应①也是CO2资源化利用的方法之一C、反应CH3OH(g) === 12CH3OCH3(g)+12H2O(l)ΔH=d2kJ·mol-1D、反应2CO(g)+4H2(g) === CH3OCH3(g)+H2O(g)ΔH =(2b+2c+d) kJ·mol-17、已知:①C(s)+O2(g) === CO2(g)ΔH1=-394 kJ·mol-1①H2(g)+12O2(g) === H2O(g)ΔH2=-242 kJ·mol-1①2C2H2(g)+5O2(g) === 4CO2(g)+2H2O(g)ΔH3=-2 510 kJ·mol-1① 2C(s)+H2(g) === C2H2(g)ΔH4下列说法正确的是A、反应①放出197 kJ的热量,转移4 mol电子B、由反应①可知1 mol气态水分解所放出的热量为242 kJC、反应①表示C2H2标准燃烧热的热化学方程式D、ΔH4=2ΔH1+ΔH2-12ΔH38、H2与ICl的反应分①、①两步进行,其能量曲线如图所示,下列有关说法错误的是A、反应①、反应①均为放热反应B、反应①、反应①均为氧化还原反应C、反应①比反应①的速率慢,与相应正反应的活化能无关D、.反应①、反应①的焓变之和为ΔH=-218 kJ·mol-19、(2018·北京理综,7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,示意图如下。
专题强化练1 陌生情境中利用盖斯定律 推测并书写热化学方程式及进行反应热的计算1.(2019甘肃师大附中高二月考,)联氨(N 2H 4)在常温下为无色液体,可用作火箭燃料。
①2O 2(g)+N 2(g) N 2O 4(l) ΔH 1 ②N 2(g)+2H 2(g) N 2H 4(l) ΔH 2 ③O 2(g)+2H 2(g) 2H 2O(g) ΔH 3④2N 2H 4(l)+N 2O 4(l)3N 2(g)+4H 2O(g) ΔH 4=-1 048.9 kJ·mol -1下列说法不正确的是(深度解析) A.O 2(g)+2H 2(g)2H 2O(l) ΔH 5,ΔH 5>ΔH 3B.ΔH 4=2ΔH 3-2ΔH 2-ΔH 1C.1 mol O 2(g)和2 mol H 2(g)具有的总能量高于2 mol H 2O(g)具有的总能量D.联氨和N 2O 4作火箭推进剂的原因之一是反应放出大量的热 2.(2019福建福州八县、市高二期末联考,节选,)以H 2合成尿素CO(NH 2)2的有关热化学方程式有: ①N 2(g)+3H 2(g) 2NH 3(g) ΔH 1=-92.4 kJ·mol -1 ②NH 3(g)+12CO 2(g) 12NH 2CO 2NH 4(s) ΔH 2=-79.7 kJ·mol -1 ③NH 2CO 2NH 4(s)CO(NH 2)2(s)+H 2O(l) ΔH 3=+72.5 kJ·mol -1则N 2(g)、H 2(g)与CO 2(g)反应生成CO(NH 2)2(s)和H 2O(l)的热化学方程式为 。
3.(2020河北张家口一中高二实验班期中,节选,)铅的冶炼有很多种方法。
瓦纽科夫法熔炼铅中相关反应的热化学方程式如下: ①2PbS(s)+3O 2(g)2PbO(s)+2SO 2(g) ΔH 1=a kJ·mol -1②PbS(s)+2PbO(s) 3Pb(s)+SO2(g) ΔH2=b kJ·mol-1③PbS(s)+PbSO4(s) 2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1则PbS(s)+2O2(g) PbSO4(s) ΔH=kJ·mol-1(用含a、b、c的代数式表示)。
专题2利用盖斯定律推测并书写热化学方程式【规律和方法】1、盖斯定律的内容:对于一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的,即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关2、运用盖斯定律的技巧——“三调一加”(1)一调:根据目标热化学方程式,调整已知热化学方程式中反应物和生成物的左右位置,改写已知的热化学方程式(2)二调:根据改写的热化学方程式调整相应ΔH的符号(3)三调:调整中间物质的化学计量数(4)一加:将调整好的热化学方程式及其ΔH相加3、运用盖斯定律的三个注意事项(1)热化学方程式乘以某一个数时,反应热的数值必须也乘上该数(2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减(3)将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但数值不变4、常用关系式5、ΔH的二种计算式(1)ΔH=反应物总键能之和-生成物总键能之和(2)ΔH=生成物总能量-反应物总能量=H(生成物)-H(反应物)常见物质中的化学键数目物质CO2(C===O) CH4(C-H) P4(P-P) SiO2(Si-O) 石墨金刚石S8(S-S) Si 键数 2 4 6 4 1.5 2 8 2【题组集训】1、已知:H2(g)、CH3OH(l)的燃烧热(ΔH)分别为-285.8 kJ·mol-1和-726.5 kJ·mol-1CH3OH (l)===CH3OH (g)ΔH=+35.2 kJ·mol-1H2O(l)===H2O(g)ΔH=+44 kJ·mol-1则CO 2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=________kJ·mol-1序号热化学方程式①4NO 2(g)+CH4(g)4NO(g)+CO2(g)+2H2O (g)ΔH=-574 kJ·mol-1②4NO(g)+CH 4 (g)2N2(g)+CO2(g)+2H2O (g)ΔH=-1 160 kJ·mol-1则4NO(g)N 2(g)+2NO2(g)的ΔH=________3、TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行已知:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)ΔH1=+175.4 kJ·mol-12C(s)+O2(g)===2CO(g)ΔH2=-220.9 kJ·mol-1沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:___________________________________4、已知:4NH3(g)+6NO(g)===5N2(g)+6H2O(g)ΔH1=-a kJ/mol4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH2=-b kJ/molH2O(l)===H2O(g)ΔH3=+c kJ/mol则反应4NH3(g)+3O2(g)===2N2(g)+6H2O(l)的△H=___________ kJ/mol5、在528K、固定计提的容器中,反应CO(g)+2H 2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值该反应的热化学方程式为___________________________ ______________6、某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,一段时间后溶液变蓝。
盖斯定律1.根据盖斯定律判断如图所示的物质转变过程中焓变的关系正确的是( )A.1234HH H H ∆=∆=∆=∆ B.1234HH H H ∆∆=+∆∆+C 。
1234HH H H ++∆=∆∆∆D 。
1234HH H H =+∆+∆∆∆2。
已知热化学方程式:C (金刚石,s )221O (g)CO (g)H +===∆; C (石墨,s )222O (g)CO (g)+=∆H ; C (石墨,s )===C (金刚石,s )3 1.9kJ /molH ∆+。
下列说法正确的是( )A 。
金刚石比石墨稳定 B.12HH ∆>∆C.3122∆∆=∆-HH H D. 石墨转化成金刚石的反应是吸热反应3。
已知C (s )、2H (g)、3CH COOH(l)的燃烧热分别是1393.5kJ mol -⋅、1285.8kJ mol-⋅和1870.3kJ mol -⋅(注:3CH COOH 的燃烧产物是2CO 和2H O ),则反应2232C(s)2H (g)O (g)CH COOH(1)++===的H ∆为( )A.1488.3kJ mol --⋅ B 。
1762.6kJ mol --⋅ C 。
1654.9kJ mol --⋅ D 。
1191kJ mol -+⋅ 4。
2mol 金属钠和1mol 氯气反应的能量关系如图所示,下列说法不正确的是( )A.2H ∆>B.4581HH H H ∆+∆+∆=∆C 。
在相同条件下,2K(g)2K (g)+→的3H H ∆<∆ D.678HH H ∆+∆=∆5。
通过以下反应可获得新型能源二甲醚(33CH OCH )。
下列说法不正确的是( ) ①1221C(s)H O(g)CO(g)H (g)kJ mol H a -+===+∆=⋅ ②12222CO(g)H O(g)CO (g)H (g)kJ mol H b -+===+∆=⋅③122323CO (g)3H (g)CH OH(g)H O(g)kJ mol H c -+===+∆=⋅ ④-1333242CH OH(g)CH OCH (g)H O(g)kJ?mol H d ===+∆=A 。
盖斯定律在热化学方程式中的应用高金松盖斯定律指出化学反应不管是一步完成还是分几步完成,其反应热是相同的。
化学反应的反应热只与反应的始态与终态有关,而与具体的反应途径无关。
也就是说,相关热化学方程式之间可以“加减”,随之反应热△H也相应的“加减”。
下面列举盖斯定律在热化学方程式中的应用。
例1. 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:据此判断,下列说法正确的是()A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高解析:由于C(石墨,s);因为,所以由石墨制备金刚石是吸热反应,等质量的石墨比金刚石能量低。
答案:A例2. 磷在氧气中燃烧,可能生成两种固态氧化物。
3.1g单质磷(P)在3.2g 氧气中燃烧,至反应物耗尽,并放出XkJ热量。
(1)通过计算确定反应产物的组成是(用化学式表示)______________,其相应的质量(g)为___________________。
反应生成固态的反(2)已知单质磷的燃烧热为,则与O2应热______________。
(3)写出反应生成固态的热化学方程式:______________。
解析:磷的正化合价只有+3、+5两种,它的氧化产物是和。
写出化学方程式:采用待定系数法配平方程式:即又根据题意,3.1g单质磷和3.2g氧气反应放出XkJ热量,写出热化学方程式①:又根据单质磷的燃烧热为,写出热化学方程式②:根据盖斯定律:可得热化学方程式③:答案:(1)(2)(3)。
高中化学盖斯定律热化学反应方程式专项练习题一、单选题1.在101kPa 和25℃时,有关反应的热化学方程式如下: ()()()2C s +1/2O g =CO g -11=-110.5kJ mol H ∆⋅, ()()()222H g +1/2O g =H O g -12=-241.7kJ mol H ∆⋅, ()()()222H g +1/2O g =H O l -13=-285.8 kJ mol H ∆⋅下列说法正确的是( )A.()()()()22C s +H O g =CO g +H g -1-131.2 kJ mol H ∆=⋅B.2H 燃烧热的热化学方程式为()()()2222H g +O g =2H O l -1=-571.6 kJ mol H ∆⋅C.()()()2222H O g =H g +O g -1=-483.4 kJ mol H ∆⋅D.()()22H O g =H O l -1= -44.1 kJ mol H ∆⋅ 2.下列说法正确的是( )A.在101kPa 时,1mol 纯物质完全燃烧时所放出的热量,叫做该物质的燃烧热B.酸和碱发生中和反应生成1mol 水,这时的反应热叫中和热C.燃烧热或中和热是反应热的种类之一D.在稀溶液中,1mol 3CH COOH 和1mol NaOH 完全中和时放出的热量为57.3 kJ)3.最新报道:科学家首次用X 射线激光技术观察到CO 与O 在催化剂表面形成化学键的过程。
反应过程的示意图如下:下列说法正确的是( ) A.CO 和O 生成2CO 是吸热反应 B.在该过程中,CO 断键形成C 和O C.CO 和O 生成了具有极性共价键的2CO D.状态I→状态III 表示CO 与2O 反应的过程4.通过以下反应均可获取2H 。
下列有关说法正确的是( )。
①太阳光催化分解水制氢:-122212H O(l)=2H (g)+O (g)571.6kJ mol H ∆=⋅②焦炭与水反应制氢:-1222C(s)+H O(g)=CO(g)+H (g)131.3kJ mol H ∆=⋅③甲烷与水反应制氢:-14223CH (g)+H O(g)=CO(g)+3H (g)206.1kJ mol H ∆=⋅A.反应①中电能转化为化学能B.反应②为放热反应C.反应③使用催化剂,3H ∆减小D.反应42CH (g)=C(s)+2H (g)的-174.8kJ mol H ∆=⋅ 5.已知:① C(s)+O 2(g)=CO 2(g) ΔΗ1=-394kJ·mol -1;② H 2(g)+12O 2(g)=H 2O(g) ΔΗ2=-242kJ·mol -1 ③ 2C 2H 2(g)+5O 2(g)=4CO 2(g)+2H 2O(g) ΔΗ3=-2510kJ·mol -1 ④ 2C(s)+H 2(g)=C 2H 2(g) ΔΗ4 下列说法正确的是( )A.反应①放出197kJ 的热量时,转移电子的数目为4N AB.由反应②可知,1mol 水蒸气分解放出的热量为242kJC.反应③是表示C2H2燃烧热的热化学方程式D.ΔΗ4=2ΔΗ1+ΔΗ2-12ΔΗ36.臭氧层中臭氧的分解历程如图所示,下列说法正确的是( )A.催化反应①、②均为放热反应B.催化剂不能改变总反应的焓变C.ClO是总反应的催化剂D.在总反应过程中没有化学键的断裂与形成》7.已知一定温度下:① N2(g)+O2(g)=2NO(g) ΔΗ1=+180kJ·mol-1,② N 2(g)+3H2(g)2NH3(g) ΔΗ2=-92.4kJ·mol-1,③ 2H2(g)+O2(g)=2H2O(g) ΔΗ3=-483.6 kJ·mol-1。
盖斯定律练习题一、选择题:1. 盖斯定律表明在恒温恒压下,一个化学反应的热效应只与反应物和生成物的状态有关,而与反应途径无关。
以下哪项是盖斯定律的直接应用?A. 计算反应的焓变B. 预测反应的自发性C. 确定反应的平衡常数D. 计算反应的熵变2. 根据盖斯定律,如果已知反应A→B的焓变为ΔH1,反应B→C的焓变为ΔH2,则反应A→C的焓变可以通过以下哪种方式计算?A. ΔH1 + ΔH2B. ΔH1 - ΔH2C. ΔH1 / ΔH2D. ΔH1 * ΔH23. 盖斯定律在化学平衡中的作用是:A. 确定平衡位置B. 计算平衡常数C. 预测反应的速率D. 计算反应的熵变二、填空题:1. 盖斯定律表明,一个化学反应的______只与反应物和生成物的状态有关,而与反应途径无关。
2. 在恒温恒压下,如果已知一个反应的焓变,那么可以通过盖斯定律计算出该反应的______。
3. 盖斯定律不适用于______条件下的化学反应。
三、计算题:1. 已知反应:2H2(g) + O2(g) → 2H2O(l),其焓变为-571.6 kJ/mol。
如果需要制备1.0 mol的液态水,计算需要多少摩尔的氢气和氧气。
2. 已知两个反应:- 反应1:2NH3(g) → N2(g) + 3H2O(g),其焓变为ΔH1- 反应2:N2(g) + 3H2O(g) → 6H2(g) + 6O2(g),其焓变为ΔH2- 计算反应:2NH3(g) → 6H2(g) + 6O2(g)的焓变。
四、简答题:1. 简述盖斯定律在化学热力学中的应用。
2. 描述如何使用盖斯定律来设计一个化学反应的实验,以确定反应的焓变。
五、判断题:1. 盖斯定律只适用于气体反应。
(对/错)2. 盖斯定律可以用来计算任何化学反应的焓变,无论反应是否在恒温恒压下进行。
(对/错)3. 盖斯定律表明,反应的焓变与反应物和生成物的浓度有关。
(对/错)六、推导题:1. 推导在恒温恒容条件下,盖斯定律如何应用于计算反应的焓变。