第12章 萃取讲解
- 格式:ppt
- 大小:1.24 MB
- 文档页数:5





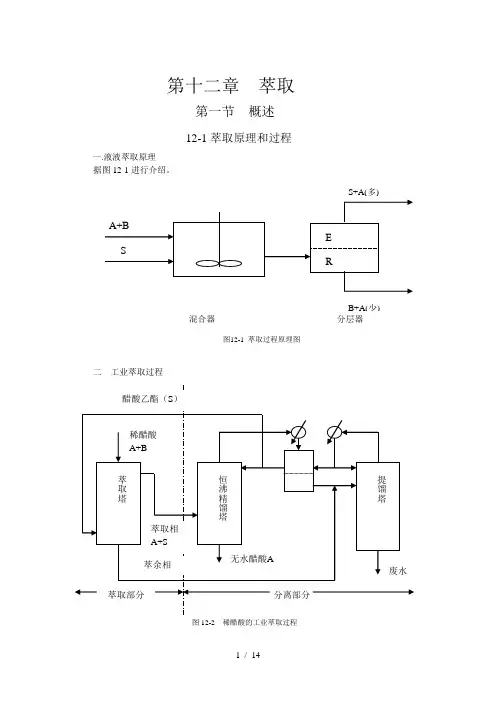
第十二章 萃取第一节 概述12-1萃取原理和过程一.液液萃取原理据图12-1进行介绍。
二 工业萃取过程图12-2 稀醋酸的工业萃取过程三萃取的工业应用1).溶质A的浓度很稀,特别是原溶剂B是易挥发组分时,利用精馏分离能耗太大;2).混合物相对挥发度小,或形成恒沸物,用一般精馏方法难以分离;3).混合物中含有热敏性物质。
四萃取剂的选择1)选择性;2)溶解性能;3)影响分层的因素:a.两者有较大的密度差。
b.两者有适宜的表面张力;4)萃取剂与溶质A容易分离;5)其它的一般工业要求。
12-2 两相接触方式一. 连续接触方式(微分接触)两相以这种方式接触的萃取设备有:喷洒萃取塔、转盘萃取塔、脉冲萃取塔等等。
二. 离散接触方式(级式接触)两相以这种方式接触的萃取设备有:混合沉降槽、筛板萃取塔等等。
第二节液-液相平衡液-液相平衡是萃取研究和计算的基础。
假如所选用的萃取剂与原料液完全不互溶,所得的萃取相和萃余相均为二组分混合物,则萃取操作原理和计算与吸收相似。
但一般情况下,萃取剂与原料液为部分互溶,所得的萃取相和萃余相均为三组分混合物,在讨论液-液相平衡时,为方便表示三组分物系的组成,适宜采用三角形相图。
12-3三角形相图一.三元物系组成表示方法●正三角形相图图12-3 正三角形相图图12-4直三角形相图如图12-3所示。
意义:三个顶点:三个纯组分三条边:连结顶点的二组分物系三角形区域:三组分物系某点组成:过组成点作某个顶点对应底边的平行线,两者的距离代表着该顶点组分的含量。
● 直三角形相图如图12-4所示。
其意义与正三角形相图相似。
二. 杠杆定律设在某原料料液中加入某种萃取剂,所得的混合物组成点为Z , 经过充分搅拌地萃取传质后,混合液引入分层器静置分层, 得到萃取相U 和萃余相V ,则萃取相U 和萃余相V 的组成和数量满足下列关系(12-3-1)上述关系相似于杠杆关系,故称为杠杆定律,其图解表示见图12-3和12-4。


高中化学萃取知识点_高中化学重点知识与物理相比,记忆在化学这一科中比重很大。
所要背的知识点也多,所以学化学要整的整理知识点。
下面是店铺为大家整理的高中化学萃取知识点,欢迎翻阅。
高中化学萃取知识点(一)1.溶质在两种互不相溶的溶剂中溶解度相差越大,萃取的效果就越好,溶质损失少,效率高.2.萃取剂不仅要溶质的溶解度大,而且沸点低.因为萃取的目的是为了蒸发提纯,而有的溶质易升华,所以用沸点较低的溶剂可减低蒸发温度,来减少蒸发时溶质的损失.3.两种溶剂不反应对于用四氯化碳萃取碘水中碘的实验,将碘水和四氯化碳加入分液漏斗中,关闭两活塞震荡,静置后可观察到上层为水层,颜色接近无色或略发黄,下层为四氯化碳,颜色为紫红色.打开下端活塞,将下层液体放出,当上层液体刚流过下端活塞时,关闭下端活塞,打开上端活塞,将上层液体从上口倒出.残留在下颈处的就不要了.然后蒸发碘的四氯化碳溶液,可得到纯净的碘单质.注意:1.若是苯、汽油等密度小于水的萃取剂,则水在下,萃取剂在上.2.等量的萃取剂,分次萃取效果优于一次萃取.高中化学萃取知识点(二)(1)将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡。
(2)振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡,同时要注意不时地打开活旋塞放气。
(3)将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出。
例如用四氯化碳萃取溴水里的溴。
高中化学萃取知识点(三)萃取操作实验萃剂原液互不溶,质溶程度不相同。
充分振荡再静置,下放上倒切分明。
解释:1、萃剂原液互不溶,质溶程度不相同:“萃剂”指萃取剂;“质”指溶质。
这两句的意思是说在萃取操作实验中,选萃取剂的原则是:萃取剂和溶液中的溶剂要互不相溶,溶质在萃取剂和原溶剂中的溶解度要不相同(在萃取剂中的溶解度要大于在原溶液中的溶解度)。


理解萃取的原理;相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂。
如abc三种物质,ab是极性物质,c是非极性物质,则ab之间溶解度大,ac或bc之间溶解度小。
(1)相似相溶原理是一个关于物质溶解性的经验规律。
例如水和乙醇可以无限制地互相溶解,乙醇和煤油只能有限地互溶。
因为水分子和乙醇分子都有一个—OH基,分别跟一个小的原子或原子团相连,而煤油则是由分子中含8个~16个碳原子组成的混合物,其烃基部分与乙醇的乙基相似,但与水毫无相似之处。
(2)结构的相似性并不是决定溶解度的唯一原因。
分子间作用力的类型和大小相近的物质,往往可以互溶;溶质和溶剂分子的偶极距相似性也是影响溶解度的因素之一萃取概述、基本原理化学化工萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作,利用相似相溶原理,萃取有两种方式:液-液萃取,用选定的溶剂分离液体混合物中某种组分,溶剂必须与被萃取的混合物液体不相溶,具有选择性的溶解能力,而且必须有好的热稳定性和化学稳定性,并有小的毒性和腐蚀性。
如用苯分离煤焦油中的酚;用有机溶剂分离石油馏分中的烯烃;用CCl4萃取水中的Br2.固-液萃取,也叫浸取,用溶剂分离固体混合物中的组分,如用水浸取甜菜中的糖类;用酒精浸取黄豆中的豆油以提高油产量;用水从中药中浸取有效成分以制取流浸膏叫“渗沥”或“浸沥”。
虽然萃取经常被用在化学试验中,但它的操作过程并不造成被萃取物质化学成分的改变(或说化学反应),所以萃取操作是一个物理过程。
萃取是有机化学实验室中用来提纯和纯化化合物的手段之一。
通过萃取,能从固体或液体混合物中提取出所需要的化合物。
这里介绍常用的液-液萃取。
基本原理利用化合物在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中。
高中化学试讲教案萃取
一、教学目标:
1. 了解萃取的基本概念和原理;
2. 掌握萃取的方法和步骤;
3. 能够应用萃取方法解决实际问题;
4. 提高学生的实验操作能力和实验设计能力。
二、教学内容:
1. 萃取的定义和原理;
2. 萃取的方法介绍;
3. 萃取实验的操作步骤;
4. 萃取实验的实验设计。
三、教学过程:
1. 导入(5分钟)
介绍萃取的基本概念和实验背景,引出本节课的主题。
2. 讲解(15分钟)
a. 萃取的定义和原理:介绍萃取是化学分离技术中常用的一种方法,利用两种互不相溶的溶液之间的分配系数不同,从而实现目标物质的分离。
b. 萃取的方法:介绍常见的萃取方法包括单级反复萃取、分液漏斗法等。
3. 演示实验(20分钟)
进行一次简单的萃取实验,让学生观察实验现象并记录实验数据。
4. 实验设计(10分钟)
要求学生设计一次萃取实验,包括实验步骤、材料准备和实验条件等。
5. 实验操作(20分钟)
学生进行自己设计的萃取实验,并记录实验结果。
6. 总结(10分钟)
总结本节课的教学内容,强调萃取方法的重要性和应用。
四、作业布置:
1. 完成萃取实验的实验报告;
2. 阅读相关教材,了解萃取在实际生产中的应用。
五、教学反思:
本节课通过理论讲解、实验演示和实验设计等环节,使学生全面了解了萃取的原理和方法,提高了他们的实验操作能力和实验设计能力。
同时,要求学生在课后完成实验报告和相关
阅读,以进一步巩固所学知识。