第二章-热力学第一定律
- 格式:doc
- 大小:191.00 KB
- 文档页数:8








第二章热力学第一定律Ⅰ学习指导一、基本思路热力学主要包括热力学第一定律和热力学第二定律。
本章热力学第一定律介绍封闭的热力学系统在状态变化时热力学能、热和功之间相互转化所遵循的规律。
首先介绍了热力学的基本概念,如系统和环境、状态函数、过程和途径、热力学平衡态、热和功等,得出了热力学第一定律的文字表述和数学表达式。
热力学能是热力学第一定律所引出的重要的状态函数,它是系统内部所具有的能量。
热和功是封闭系统在状态变化时与环境传递能量的两种方∆=+,将封闭系统变化过程式,都与过程有关,称为过程量。
通过热力学第一定律U Q W中热、功和热力学能改变联系了起来。
焓是由系统的热力学能、体积和压力组合得到的一个状态函数,在一定条件下,系统的焓变与过程的热相联系,焓及其有关公式可以看成是热力学第一定律的扩展。
通过Gay-Lussac-Joule实验,说明理想气体的热力学能和焓只是温度的函数;通过Joule-Thomson实验讨论了热力学第一定律对实际气体的应用。
热力学第一定律的具体应用就是围绕不同过程(理想气体简单状态变化、相变和化学变化)中热、功、热力学能变和焓变的计算展开。
准静态过程和可逆过程是热力学的重要概念;卡诺循环是热力学的特殊循环。
热化学是热力学第一定律对于化学反应系统的应用,据此可以计算反应的热效应,通常利用热化学数据(生成焓和燃烧焓)及Hess定律可直接求得298 K下反应的热效应,应用Kirchhoff定律可计算不同温度下反应的热效应。
本章还介绍了热力学第零定律,以热平衡现象为基础给出了温度的概念。
本章的主要内容及其逻辑关系如框图所示。
二、基本概念1.热力学第零定律如果两个系统分别和处于确定状态的第三个系统达到热平衡,则这两个系统彼此也将处于热平衡。
这个热平衡规律称为热力学第零定律。
此定律给出了温度的概念和比较温度的方法。
2.状态函数状态是系统的一切宏观性质(质量、温度、压力、密度和热力学能等)的综合表现。


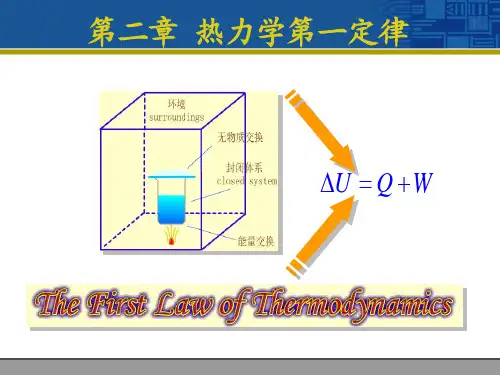
第二章二、热力学第一定律热力学第一定律是与能量守恒定律在同一时代建立的。
它阐述了与热现象有关的宏观过程中的能量关系,它是在热运动与机械运动相互转化的研究中提出来的。
我们已经在初中物理中学过,要使容器中的水温升高有两种办法,一方面可以直接对水加热,另一方面也可以对水做功。
这表明,改变物体内能的途径有两个:外界与物体进行热交换或外界对物体做功。
一个物体,如果没有从外界吸收热量,也没有向外界放出热量,外界对它做多少功,它的内能就增加多少。
如果用W表示外界对物体做的功,用U1和U2分别表示外界对它做功前与做功后的内能,那么,上述关系可以写为U2-U1=W一个物体,如果没有其他物体对它做功,也没有对其他物体做功,它从外界吸收多少热量,它的内能就增加多少。
如果用Q表示物体从外界吸收的热量,分别用U1和U2表示物体与外界进行热交换前后的内能,那么,这个关系可以表示为U2-U1=Q如果外界既向物体传热,又对物体做功,那么物体内能的增量就等于物体吸收的热量Q 与外界对物体所做功W的总和,即U2-U1=Q+W通常以ΔU表示内能的增量U2-U1,于是有ΔU=Q+W这表明:物体内能的增加等于物体从外界吸收的热量与外界对物体所做的功的总和。
这就是热力学第一定律(first law of thermodynamics)。
热力学第一定律是能量守恒定律在涉及热现象的宏观过程中的具体表述。
科学足迹一、古代热力技术应用事例古人很早就发现热可以用于产生动力,渐渐地开始利用这种动力。
下面列举其中的几例略展古代利用热力的风采。
希罗(Hero,约公元62-约公元150)是古希腊的一位工程师。
他研究过车轮、杠杆、滑轮、螺旋、劈等简单机械。
在他众多的发明中,最有名的当属“小涡轮”。
当时的人们把“小涡轮”用于孩子的玩具,或在寺庙中用于转动神像,以引起信徒们的惊奇。
“小涡轮”是利用蒸汽使空心圆球转动的装置。
空心圆球安装在架子上。
球上安装着两个弯管(见图2.2-1)。
第二章热力学第一定律基本公式功: δW = -P外dV热力学第一定律: dU =δQ + δW ΔU = Q + W焓的定义: H ≡ U + PV热容的定义: C=limΔT→0δQ/ ΔT等压热容的定义: C P =δQ P /dT =(∂H/∂T)P等容热容的定义: C V =δQ V /dT =(∂U/∂T)V任意体系的等压热容与等容热容之差: C P - C V = [P + (∂U/∂V)T] (∂V/∂T)P 理想气体的等压热容与等容热容之差: C P - C V = nR理想气体绝热可逆过程方程: γ = C P / C VPVγ-1 =常数T Vγ-1 =常数P1-γTγ=常数理想气体绝热功: W =C V(T1 – T2 ) W = P1V1 – P2V2 /γ-1热机效率: η = W/Q2可逆热机效率: η = T2 – T1 / T2冷冻系数: β= Q1′/W可逆制冷机冷冻系数: β = T1 / T2 – T1焦汤系数: μ = ( ∂T/ ∂P)H = - (∂H/∂P)/C P反应进度: ξ= n B – n B0 / νB化学反应的等压热效应与等容热效应的关系: Q P = Q V + ΔnRT当反应进度ξ= 1 mol 时Δr H m= Δr U m +ΣBνB RT化学反应等压热效应的几种计算方法:Δr H m⊖=ΣBνBΔf H m⊖(B)Δr H m⊖=ΣB (єB )反应物 - ΣB(єB )产物Δr H m⊖= -ΣBνBΔC H m⊖(B)反应热与温度的关系: Δr H m(T2) =Δr H m(T1) + ∫21T TΔr C P dT表 1-1 一些基本过程的W 、Q、△U 、△H 的运算过程W Q △U △H 理想气体自由膨胀0 0 0 0 理想气体等温可逆 -nRTLnV2/V1 -nRTLnV2/V10 0任意物质等容可逆理想气体0∫C V dT∫C V dTQ v∫C V dT△U + V△P∫C P dT任意物质等压可逆理想气体-P外△V-P外△V∫C P dT∫C p dTQ P - P△V∫C V dTQ P∫C P dT理想气体绝热过程C V(T2 – T1)1/γ-1(P2V2-P1V1) 0 ∫C V dT ∫C P dT理想气体多方可逆过程PVδ=常数n R/1-δ(T2-T1) △U + W ∫C V dT ∫C P dT 可逆相变(等温等压) -P外△V Q P Q P -W Q P化学反应(等温等压) -P外△VQ PQ P – WΔr H m=Δr U m+ΣBνB RTQ PΔr H m⊖=ΣBνBΔf H m⊖(B) 例题例1 0.02Kg 乙醇在其沸点时蒸发为气体。
第二章-热力学第一定律第二章热力学第一定律思考题1 设有一电炉丝浸于水中,接上电源,通过电流一段时间。
如果按下列几种情况作为系统,试问ΔU,Q,W为正为负还是为零?(1)以电炉丝为系统;(2)以电炉丝和水为系统;(3)以电炉丝、水、电源及其它一切有影响的部分为系统。
2 设有一装置如图所示,(1)将隔板抽去以后,以空气为系统时,ΔU,Q,W为正为负还是为零?(2)如右方小室亦有空气,不过压力较左方小,将隔板抽去以后,以所有空气为系统时,ΔU,Q,W为正为负还是为零?作业题1 (1)如果一系统从环境接受了160J的功,内能增加了200J,试问系统将吸收或是放出多少热?(2)一系统在膨胀过程中,对环境做了10 540J的功,同时吸收了27 110J的热,试问系统的内能变化为若干?[答案:(1) 吸收40J;(2) 16 570J]2 在一礼堂中有950人在开会,每个人平均每小时向周围散发出4.2xl05J的热量,如果以礼堂中的空气和椅子等为系统,则在开会时的开始20分钟内系统内能增加了多少?如果以礼堂中的空气、人和其它所有的东西为系统,则其ΔU=?[答案:1.3×l08J;0] 3一蓄电池其端电压为12V,在输出电流为10A下工作2小时,这时蓄电池的内能减少了1 265 000J,试求算此过程中蓄电池将吸收还是放出多少热?[答案:放热401000J]4 体积为4.10dm3的理想气体作定温膨胀,其压力从106Pa降低到105Pa,计算此过程所能作出的最大功为若干?[答案:9441J]5 在25℃下,将50gN2作定温可逆压缩,从105Pa压级到2×106Pa,试计算此过程的功。
如果被压缩了的气体反抗恒定外压105Pa作定温膨胀到原来的状态,问此膨胀过程的功又为若干?[答案:–1.33×104J;4.20×103J]6 计算1mol理想气体在下列四个过程中所作的体积功。
已知始态体积为25dm3终态体积为100dm3;始态及终态温度均为100℃。
(1)向真空膨胀;(2)在外压恒定为气体终态的压力下膨胀;(3)先在外压恒定为体积等于50dm3时气体的平衡压力下膨胀,当膨胀到50dm3(此时温度仍为100℃)以后,再在外压等于100 dm3时气体的平衡压力下膨胀;(4)定温可逆膨胀。
试比较这四个过程的功。
比较的结果说明了什么问题?[答案:0;2326J ;310l J ;4299J]习题10 试证明对遵守范德华方程的1mol 实际气体来说,其定温可逆膨胀所作的功可用下式求算。
(范德华方程为()V =m 2a p b RT V m ⎛⎫ ⎪+- ⎪⎝⎭)11,2 =ln +a ,1,2,1V b m W RT V b V V m m m ⎛⎫- ⎪-⎪-⎝⎭习题11 假设CO 2遵守范德华方程,试求算1mol CO 2在27℃时由10dm 3定温可逆压缩到1dm 3所作的功。
(所需范德华常数自己查表)。
[答案:—5 514J]习题12 1mol 液体水在100℃和标准压力下蒸发,试计算此过程的体积功。
(1)已知在100℃和标准压力下,水蒸气的比体积(体积除以质量)为 1 677cm 3·g -1,水的比体积为1.043cm 3·g -1。
(2)假设水的体积比之蒸气的体积可略去不计,蒸气作为理想气体。
比较两者所得的结果,说明(2)的省略是否合理。
[答案:3.057×103J ;3.101×103J]习题13 已知在0℃和标准压力下,冰的密度为0.917g ·cm -3,水的密度为1.000g ·cm -3。
试计算在0℃及标准压力下,1mol 冰熔化成水所需之功。
(要注意本题所需之功比之上题的涉及有蒸气的相变化的功是很小的)[答案:-0.165J]习题14 在373K 和标推压力下,水的蒸发热为4.067×104J·mol -1,1mol 液态水体积为18.08cm 3,蒸气则为30 200cm 3。
试计算在该条件下1mol 水蒸发成气的ΔU 和ΔH 。
[答案:3.761×104J ;4.067×104J]习题15 一理想气体在保持定压105Pa 下,从10dm 3膨胀到16dm 3,同时吸热1 255J ,计算此过程的ΔU 和ΔH 。
[答案:655J ;1 255J]习题16 假设N 2为理想气体。
在0℃和5×105Pa 下,用2dm 3N 2作定温膨胀到压力为105Pa 。
(1)如果是可逆膨胀;(2)如果膨胀是在外压恒定为105Pa 的条件下进行。
试计算此两过程的Q 、W 、ΔU 和ΔH 。
[答案:(1)1 609J ;0;(2)800 J ;0]习题17 试由0U V T ∂⎛⎫=⎪∂⎝⎭及0H V T ∂⎛⎫= ⎪∂⎝⎭证明理想气体的0U p T ⎛⎫∂= ⎪∂⎝⎭及0H p T⎛⎫∂= ⎪∂⎝⎭。
习题18 有3mol 双原子分子理想气体由25℃加热列150℃,试计算此过程的△U 和△H 。
[答案:7.79×103J ;1.09×104J]习题19 有1mol 单原子分子理想气体在0℃,105Pa 时经一变化过程,体积增大一倍,△H =2092J ,Q =1 674J 。
(1)试求算终态的温度、压力及此过程的△U 和W ;(2)如果该气体经定温和定容两步可逆过程到达上述终态,试计算Q 、W 、△U 和△H 。
[答案:(1)373.7K ,6.84×104 Pa ,1255J ,419J , (2)2828 J ,1573J ,1255J,2092J]习题20 已知300K 时NH 3的m U V T∂⎛⎫⎪∂⎝⎭=840 J ·m -3·mol -1, CV ,m=37.3J ·K -1·mol -1。
当1mol NH3气经一压缩过程其体积减少10㎝3而温度上升2度时,试计算此过程的△U 。
[答案:74.6J]习题21 试证明对任何物质来说()()12U V C C p p V V T p T H p C C V p V p T V T ⎡⎤∂∂⎛⎫⎛⎫-=+⎢⎥⎪ ⎪∂∂⎝⎭⎝⎭⎢⎥⎣⎦⎡⎤⎛⎫∂∂⎛⎫-=-⎢⎥ ⎪ ⎪∂∂⎝⎭⎝⎭⎢⎥⎣⎦习题22 计算1gN 2在常压下由600℃冷却到20℃时所放出的热,所需数据自己查找。
[答案:629J]习题23 试求算2mol100℃,4×104Pa 的水蒸气变成l00℃及标准压力的水时,此过程的△U 和△H 。
设水蒸气可视为理想气体,液体水的体积可忽略不计。
已知水的摩尔气化热为4 0670J ·mol -1。
[答案:—75 138J ;—81 340J]习题24 已知任何物质的2C C TV p V αβ-= 其中α为膨胀系数,β为压缩系数。
现已查得25℃时液体水的定容热容C v ,m=75.2J ·K -1·mol -1, α=2.1×10-4K -1, β=4.44×10-10Pa -1,而水的V m =18×10-6m 3·mol -1。
试计算液体水在25℃时的C p,m =?[答案:75.7J ·K -1·mol-1]习题25 一物质在一定范围内的平均定压摩尔热容可定义为(),21Q p C p m n T T =-其中n 为物质的量。
已知NH 3的2-1-13533.64 2.9310 2.1310J K mol ,2K K T T C p m ⎛⎫-- ⎪=+⨯+⨯ ⎪⎝⎭g g试求算NH 3在0~500℃之间的平均定压摩尔热容,C p m 。
[答案:41.4J ·K -1·mol-1]习题26 已知N 2和O 2的定压摩尔热容与温度的关系式分别为()()()-13N 27.87 4.2710J mol 2,K 135-1-1O 36.1620.84510 4.31010J K mol ,22K /K T Cp mT C p m T ⎛⎫-=+⨯ ⎪⎝⎭⎛⎫- ⎪=+⨯-⨯ ⎪⎝⎭g g g试求空气的,p m C 与温度的关系式应为如何?习题27 1molH 2在25℃、105 Pa 下,经绝热可逆过程压缩到体积为5dm 3,试求⑴终态温度T 2;⑵终态压力p 2;⑶过程的W ,△U 和△H 。
(H 2的C V ,m 可根据它是双原子的理想气体求算)[答案: 565K ;9.39×105 Pa ;5550J ;5550J ;7769J]习题28 25℃的空气从106 Pa 绝热可逆膨胀到105 Pa ,如果做了1.5×104J 的功,计算空气的物质的量。
(假设空气为理想气体,空气的热容数据可查表或作一近似计算)[答案:5.01mol]习题29 某理想气体的C p,m=35.90J·K-1·mol-1,⑴当2mol此气体在25℃,1.5×106 Pa时,作绝热可逆膨胀到最后压力为5×105 Pa;⑵当此气体在外压恒定为5×105 Pa时作绝热快速膨胀;试分别求算上述两过程终态的T和V及过程的W、△U和△H。
[答案:⑴231K;7.68dm3;-3697J;-3697J;-4811J;⑵252K;8.38 dm3;2538J;-2538J;-3303J]习题30 1mol某双原子分子理想气体发生可逆膨胀:(1)从2 dm3,106 Pa定温可逆膨胀到5×105 Pa;⑵从2 dm3,106 Pa绝热膨胀到5×105 Pa。
⑴试求算过程⑴和⑵的W,Q,△U和△H;⑵大致画出过程⑴和⑵在p—V图上的形状;⑶在p—V图上画出第三个过程将上述两过程的终态相连,试问这第三个过程有何特点(是定容还是定压)?[答案:⑴1386J;1386J;0;0;⑵919J;0;-919J;-1286J] 习题31 某高压容器所含的气体可能是N2或是Ar。
今在25℃时取出一些样品由5 dm3绝热可逆膨胀到6 dm3,发现温度下降了21℃,试判断容器中为何气体?[答案:N2] 在573K及0至6×10-6Pa的范围内,N2(气)的焦耳—汤姆逊系数可近似用下式表示μJ—T=[1.40×10-7–2.53×10-14(p/Pa)]K·Pa-1假设此式与温度无关。
N2(气)自6×10-6Pa作节流膨胀到2×10-6Pa,求温度变化。
[答案:ΔT=-0.16K]习题33 已知CO2的μJ—T=1.07×10-5K·Pa-1,C p,m=36.6J·K-1·mol-1,试求算50g CO2在25℃下由105Pa定温压缩到106Pa时的ΔH。