第三章 抗体
- 格式:ppt
- 大小:7.72 MB
- 文档页数:4





第三章免疫球蛋白分子—抗体第一节抗体的发展及其特征一、抗体的发现血清中存在一种能特异性中和外毒素的组分称为抗毒素,使细菌发生特异性凝集的组分称之为凝集素。
其后将其称为抗体(antibody,Ab),将能刺激机体产生抗体的物质称为抗原(antigen)。
二、抗体的理化性质40年代初期Tiselius和Kabat用肺炎球菌多糖免疫家兔,证实了抗体活性与血清丙种球蛋白组分相关。
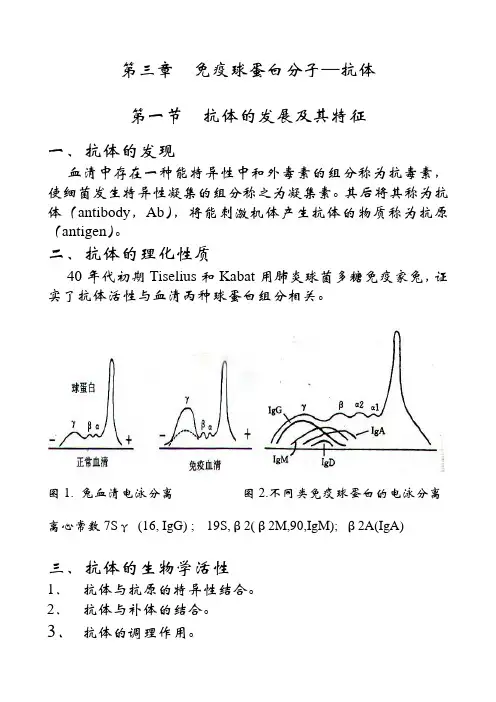
图1. 兔血清电泳分离图2.不同类免疫球蛋白的电泳分离离心常数7Sγ(16, IgG) ; 19S,β2(β2M,90,IgM); β2A(IgA)三、抗体的生物学活性1.抗体与抗原的特异性结合。
2.抗体与补体的结合。
3.抗体的调理作用。
第二节免疫球蛋白的分子结构与功能一、免疫球蛋白的基本结构Porter对血清IgG抗体的研究证明,Ig分子基本结构是由四个肽链组成的,二条较小的轻链和二条较的重链,轻链与重链是由二硫键连接形成,分为氨基端(N端),羧基端(C端)。
(一)轻链和重链1.轻链(light chain,L链)214氨基酸残基组成,通常不含碳水化合物,分子量为24KD,有两个由链内二硫键组成的环肽,可分为:Kappa(κ)与lambda(λ)2个亚型。
2.重链(heavy chain,H链)450-550氨基酸残基组成,分子量55或75KD,含糖数量不同,4-5个链内二硫键,可分为5类,μ、γ、α、δ、ε链,不同的H链与L链(κ或λ)组成完整的Ig分子。
分别称为:IgM,IgG,IgA,IgD和IgE。
(二)可变区和恒定区1.可变区(Variable region,V区)L链N端1/2处(V L)108-111个氨基酸残基,H链N端1/5-1/4处(V H)118个氨基酸残基,V区有一个肽环65-75个氨基酸残基。
高变区(hypervariable region, HVR)可变区骨架区(framework region, FR)V L的HVR在24-34,50-56,89-97氨基酸位置。

免疫球蛋白(仅掌握单选题、填空题及标※的名词解释和问答题即可,其余内容为了解内容)※名词解释:1.抗体(antibody)2.Fab(fragment antigen binding)3.Fc(fragment crytallizable)4.免疫球蛋白(Immunoglobulin Ig)5.超变区(hypervariable region,HVR)6.可变区(variable region,V区)7.单克隆抗体(Monoclonal antibody, mAb)8.ADCC(Antibody –dependent cell-mediatedcytotoxicity)9.调理作用(opsonization)10.J链(joining chain)11.分泌片(secretory piece)12.Ig功能区(Ig domain)13.CDR(complementary-determining region)问答题※1.简述抗体与免疫球蛋白的区别和联系。
※2.试述免疫球蛋白的主要生物学功能。
※3.简述免疫球蛋白的结构、功能区及其功能。
4.简述单克隆抗体技术的基本原理。
参考答案名词解释1.抗体(Antibody) :是B 细胞特异性识别Ag后,增殖分化成为浆细胞,所合成分泌的一类能与相应抗原特异性结合的、具有免疫功能的球蛋白。
2.Fab(Fragment antigen binding):即抗原结合片段,每个Fab段由一条完整的轻链和重链的VH和CH1功能区构成,可以与抗原表位发生特异性结合。
3.Fc片段(fragment crytallizable):即可结晶片段,相当于IgG的CH2和CH3功能区,无抗原结合活性,是抗体分子与效应分子和细胞相互作用的部位。
4. 免疫球蛋白(Immunoglobulin,Ig):是指具有抗体活性或化学结构与抗体相似的球蛋白。
可分为分泌型和膜型两类。
5.高变区(hypervariable region ,HVR):在Ig分子VL和VH内,某些区域的氨基酸组成、排列顺序与构型更易变化,这些区域为超变区。



第三章-抗体第三章抗体在我们的身体中,有一种神奇的物质,叫做抗体。
它就像是身体里的“小战士”,时刻准备着与入侵的“敌人”作战,保护我们的健康。
抗体,本质上是一种蛋白质,由我们身体的免疫系统产生。
当我们的身体遭遇外来的病原体,比如细菌、病毒、真菌等等,免疫系统就会被激活,启动一系列的防御机制,其中就包括产生抗体。
这些抗体具有高度的特异性,这意味着它们能够精准地识别并结合特定的病原体。
就好像每一把钥匙只能开一把特定的锁一样,每一种抗体也只能与特定的病原体或其产生的物质相结合。
这种特异性使得免疫系统能够有针对性地进行攻击,而不会误伤自身的正常细胞和组织。
抗体的产生是一个复杂而精妙的过程。
首先,当病原体进入体内后,免疫系统中的抗原提呈细胞会将病原体的特征“展示”给淋巴细胞。
淋巴细胞接收到这些信息后,会开始分化和增殖,形成能够产生抗体的浆细胞。
浆细胞会大量分泌抗体,释放到血液和组织液中,去寻找并结合病原体。
抗体与病原体结合的方式多种多样。
有的抗体可以直接中和病原体的毒性,使其失去致病能力;有的抗体能够标记病原体,让免疫系统中的其他细胞更容易识别和吞噬它们;还有的抗体可以激活补体系统,引发一系列的免疫反应,最终消灭病原体。
在我们的日常生活中,抗体发挥着至关重要的作用。
例如,当我们接种疫苗时,实际上就是让身体提前接触一些经过处理的病原体成分,刺激免疫系统产生抗体。
这样,当真正的病原体来袭时,身体已经有了“记忆”,能够迅速产生大量的抗体进行抵抗,从而避免生病。
另外,抗体还可以用于疾病的诊断和治疗。
通过检测血液中特定抗体的存在和水平,可以帮助医生判断一个人是否感染了某种疾病,以及感染的程度和阶段。
在治疗方面,人工制备的抗体药物已经成为了治疗许多疾病的重要手段,比如肿瘤、自身免疫性疾病等。
然而,抗体并非是万能的。
有时候,病原体可能会发生变异,导致原本有效的抗体无法识别它们。
这也是为什么一些疾病会出现反复感染或者难以治愈的情况。
第三章抗体与免疫球蛋白第一节抗体的发现及其特性一、发现:1890年德国学者Behrong和日本学者北里用白喉杆菌外毒素免疫动物,在其血清中发现一种能力和这种外毒素的组分称为抗毒素。
这是在血清中发现的第一种抗体。
二、抗体的理化性质1、抗体是球蛋白(Globulin)通过电泳证明抗体是两种球蛋白后又经电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体是r球蛋白,小部分是β球蛋白。
所以早期对抗体性质的研究证明抗体不是由均质性球蛋白(γ〃β)组成,是异均性的。
2、免疫球蛋白(lmmunoglabulin, Ig)为了准确描述抗体球蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋白。
从此r球蛋白则改称为IgG,BIM称为IgM,而B:A称为IgA,其后又发现IgE和IgE。
抗体主要存在于血清中,但也存在于体液和外分泌液中,所以含有抗体的血清称为免疫血清。
B细胞表面上也存在免疫球蛋白,称为膜表面免疫球蛋白Surface membrane Ig,SmIg。
第二节免疫球蛋白的结构一、Ig的基本结构1、是由四条链组成的糖蛋白2、重链(Heavy chain)轻链(light chain)3、可变区和恒定区①可变区(VariableV区)②恒定区(Constant region, C区)二、Ig功能区1、L链:VL,CL2、H链:3、铰链区:①富含脯氨酸,易发生伸展及一定程度的转动,便于与抗原决定簇发生互补,也易于与补体结合。
②对木瓜蛋白酶,胃蛋白酶敏感。
③ IgM,IgE缺乏铰链区。
4、T链和分泌成分① T链(Toining chain)存在于IgM和IgA中,通过二硫键与它们结合,IgM为五聚体,IgA为二聚体(分泌型)②分泌成分或分泌片(seeretory componant, secratory, piece)是分泌型IgA的一种辅助成分。
功能是抵抗外分泌液中蛋白水解酶的降解。
三、Ig水解片段(1)木瓜蛋白酶(Papain)水解片段①在二硫键上方切断,产生三个片段:2个Fab段(抗原结合段)Fragineut:fantigen binding)。