物质构成的奥秘专题复习1
- 格式:doc
- 大小:154.00 KB
- 文档页数:11

单元三物质构成的奥秘一、分子1. 分子(1)概念:。
(2)特征:①;(温度越高分子能量越,运动速度越 )②;(温度越高分子之间的间隔越,温度越低分子之间的间隔越;气态分子之间的间隔液态分子之间的间隔固态分子之间间隔)③;注:同种物质的分子性质;不同种物质的分子性质。
用分子原子观点解释下列现象和概念(1)花香四溢:(2)阳光下衣服晾干的快:(3)热胀冷缩:(4)温度计测量体温的原理:(5)纯净物:(6)混合物:(7)物理变化:(8)化学变化:二、原子1、概念:。
2、化学反应的实质:(氧化汞受热分解的化学式表达式:,该反应的化学反应实质是;氢气在氯气中燃烧的化学式表达式::,该反应的化学反应实质是.) 3、分子和原子的区别与联系(1)区别:(2)联系:4、原子的构成(1)原子结构示意图的认识(带电)原子(电)(带电)(2) = = =(3)原子的质量主要集中在 上(4)原子中质量最小的粒子是(5)相对原子质量是指其它原子与C 12原子质量的121比较所得的值。
所以相对原子质量只是一个比值①相对原子质量= ———————————— ②相对原子质量的单位是“一”,符号是“1”,忽略不写。
③相对原子质量≈ +注:等质量前提下,相对原子质量越小,所含原子越 。
5、元素(1)定义: *一种元素与另一种元素的本质区别:注意:*由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或红磷与白磷的混合物)不可能是化合物。
元素符号的意义:OFe2H4N 2(2)有关元素周期表a 、发现者:*元素周期表共有 个横行, 个纵行。
每一个横行就做一个 ,每一个纵行就做一个 (8.9.10三个纵行共同组成一个族。
每周期开头的是 元素,靠近尾部的是 元素,结尾的元素是 元素。
b 、分类c 、元素之最:地壳: 、 、 、 ( 、 、 、 )生物细胞: 、 、 、 ( 、 、 、 )金属元素: ( )空气: ( ),其次是 ( )海水: 、 、 、 ( 、 、 、 )宇宙: ( )元素:如Mg 、Al 元素:如N 、C 元素:如He 、Ne 。


初中化学物质构成的奥秘专题复习(精析)一、单选题1、如图是某元素原子的结构示意图。
下列说法不正确的是(C)A、图中x=34(x=2+8+18+6=34)B、该元素位于元素周期表第四周期(原子的电子层数四等于周期数四)C、该元素属于金属元素(该原子的最外层电子数是6,即大于4,属于非金属元素)D、该元素原子易得电子形成阴离子(该元素原子易得两个电子形成阴离子)2、下列化学用语书写正确的是(D)A、磷元素:Pt (P)B、钾离子:K2+(K+)C、高锰酸钾:K2MnO4(KMnO4)D、5个氮原子:5N二、填空题3、(1)、用化学用语填空:氢元素H;2个氢分子2H 2; (分子的个数就在化学式前加上相应的数字) 氢离子H +; (在表示该离子符号右上角,标出该离子所带的正负电荷数;数字在前,正负符号在后;带1个电荷时,1要省略)碳酸中氢元素的化合价H +12CO 3。
(化合价标在元素符号或原子团的正上方,正负号在前,数字在后)(2)、“老陈醋“是山西特产,其中含有3%-5%的醋酸,醋酸也称乙酸,化学式为CH 3COOH ,CH 3COOH 表示的意义有:①、醋酸;②、CH 3COOH 中碳元素的质量分数=40%。
(12×212×2+16×2+1×4×100%)4、化学用语可准确、简洁地表达化学信息.请用化学符号和数字填空.(1)、铝元素Al ;(2)、2个碳酸根离子2CO 32﹣。
(离子所带的正负电荷数,数字在前,正负符号在后;带1个电荷时,1要省略)(3)、铵根离子NH 4+;(4)、H 3PO 4中磷元素的化合价H 3P +5O 4.(在化学式中该元素的正上方用正负号和数字表示;正负号在前,数字在后)5、请用化学用语填空:(1)、3个铜原子3Cu ;(元素符号前加数字表示原子个数)(2)、高锰酸钾中的阳离子:K +; (3)、食盐的主要成分:NaCl ;(4)、标出氨气中氮元素的化合价: N -3H 3;6、写出符合下列要求的化学符号。
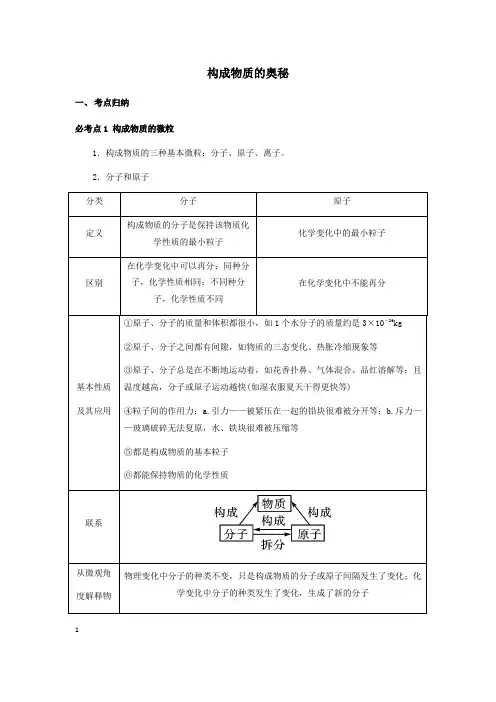
构成物质的奥秘一、考点归纳必考点1 构成物质的微粒1.构成物质的三种基本微粒:分子、原子、离子。
2.分子和原子123.离子(1)带电的原子或原子团叫做离子,带正电的原子叫做阳离子,带负电的原子叫做阴离子。
(2)离子符号周围的数字表示的意义(以Mg 为例)(3)原子和离子的区别(以Na 、S 为例)(4)常见的带电的原子团:OH -(氢氧根离子),SO 4 (硫酸根离子),CO 3 (碳酸根离子),NO -3 (硝酸根离子),HCO -3 (碳酸氢根离子),NH +4 (铵根离子)。
归纳总结(1)原子不能再分的前提是在化学变化中,事实上原子是由更小的微粒构成的。
(2)从分子和原子角度分析,化学变化的微观本质是分子分解成原子,原子重新组合成新的分子或直接构成新的物质。
(3)虽然分子由原子构成,但不同的原子大小差异较大,所以分子不一定比原子大,分子只是比构成该分子的原子大。
4.构成物质的微观粒子(1)物质由分子构成有:气态非金属单质(氧气、氢气、氮气等)、氧化物(二氧化碳、二氧化硫)和不溶性碱和盐(氢氧化镁、氢氧化铜、碳酸钙等);(2)物质由原子构成有:稀有气体(氦气、氖气等)、金属单质(镁条、铁丝、铜片等)和固态非金属(硫磺、碳等)。
(3)物质由离子构成有:可溶性碱和盐(氢氧化钠、氢氧化钾、氯化钠、碳酸钠等)和酸(硫酸、盐酸、硝酸等)。
必考点2 原子的结构1.原子的结构3特别提醒①虽然原子中的质子和核外电子都带电荷,但整个原子不带电,因为原子中质子数(核电荷数)=核外电子数。
②不是所有的原子都有中子(如有一种氢原子,原子核内只有一个质子,没有中子)。
③构成物质的基本微粒有三种:分子、原子、离子。
④一般来说,原子最外层电子数相同的元素,具有相似的化学性质,但并不绝对,如氦原子最外层有2个电子,但由于其核外只有一个电子层而具有相对稳定结构,镁、钙等原子的最外层也是2个电子,在化学反应中却易失去2个电子。

主题一物质构成的奥秘§专题一微粒构成物质一、分子1、定义:分子是构成物质的微粒。
2、分子有什么特性(1)“”:质量,体积。
(2)“”:分子在不断做无规则。
【注】温度越高,分子运动速度。
(3)“”:分子之间存在。
【注】物体的热胀冷缩、三态变化现象属于变化,就是物质分子的受热时增大,遇冷时缩小的缘故,分子本身。
3、分子的性质(1)由分子构成的物质,在物理变化中,分子本身,仍保持该物质的性质;在化学变化中,分子本身,生成新分子,新分子不再保持原物质的性质。
(2)分子是保持物质的一种微粒。
【注】分子只保持物质的性质,不能保持性质。
如:水、冰、水蒸气的性质相同,但不同。
(3)同种分子化学性质,构成;不同种分子化学性质,构成。
二、原子1、原子的性质:(1)原子是构成物质的另一种微粒。
原子构成,原子也可直接构成某些。
(如:、、。
)(2)在化学变化中,分子本身,原子本身,只是成新分子,新分子构成。
(3)因此,原子是化学变化中的。
2、原子的特性原子在不断地着;且原子的体积、质量非常;原子之间存在。
3、分子和原子的区别和联系(1)联系:①都是构成的微粒。
②分子原子(2)区别:在化学变化中分子,原子。
4、原子的构成(1)原子的内部结构(每个质子带一个单位)(电)原子(每个电子带一个单位)核电荷数:。
【注】①无中子。
②在原子中质子数中子数。
③原子序数 = = = 。
④在同一种原子中,其原子核里的质子数和核外电子数,所带的电量 且电性 ,相互 ,故整个原子 。
⑤ 决定了原子的种类;不同种类的原子, 不同。
【注】原子核居于原子中心,但比原子小得多,原子的体积决定于 ,原子的质量主要集中在 上,电子质量很 ,可以忽略。
(2)原子结构示意图①第一层最多排 个电子,第二层最多排 个电子,最外层电子数不超过 个电子。
每层最多排 个电子。
②稀有气体元素的最外层电子数等于 (氦元素核外电子只有一层是 )。
非常稳定,几乎不和任何物质反应,因此把最外层电子数是 的结构,(最外层只有一层时,电子是 ),称为相对 结构。


第三单元物质构成的奥秘课题1 分子与原子一、物质是由微观粒子(包括分子、原子、离子)构成的1.分子和原子是真实存在的。
2.分子的质量和体积都很小。
3.分子总是在不断运动着,且温度越高,分子的运动速率越快应用:可以解释蒸发、溶解、挥发、气味的传播等现象。
4.分子之间存在间隔,且分子间的间隔受热增大,遇冷减小应用:可以解释物质的热胀冷缩、三态变化、体积变化等现象。
注意:体积的变化是由于分子间的间隔大小发生变化而引起的,而不是分子本身的体积发生了变化。
5.相同物质的分子,其化学性质相同。
二、分子可以分为原子1.分子的概念:由分子构成的物质,分子是保持物质化学性质的最小粒子2.分子是由原子构成的,如:1个水分子由2个氢原子和1个氧原子构成;1个二氧化碳分子由1个碳原子和2个氧原子构成;一个氧分子由2个氧原子构成。
3.原子的概念:原子是化学变化中的最小粒子。
4.从微观角度看化学变化的实质:反应物的分子分裂为原子,原子再重新组合成新的分子。
5.分子和原子的联系与区别联系:分子和原子都是构成物质的微粒;分子可以分为原子,原子可以相互结合形成分子区别:在化学变化中,分子可分,原子不可分6.用分子的观点解释纯净物与混合物、物理变化与化学变化物理变化:构成物质的分子本身没有发生变化,改变的是分子之间的间隔;化学变化:构成物质的分子本身发生了变化,变成了其他物质的分子。
纯净物:由同种分子构成的物质,如水中只含有水分子;混合物:由不同种分子构成的物质,如空气中含有氧分子、氮分子、二氧化碳分子等。
课题2 原子的结构一、原子的构成原子核(+)质子(+):每个质子带一个单位正电荷原子中子(不带电)核外电子(—):每个电子带一个单位负电荷1.原子由质子、中子、电子三种微粒构成(普通的氢原子例外,它没有中子)2.原子整体不显电性,是因为质子所带的正电荷与电子所带的负电荷总数相等,电性相反。
核电荷数= 质子数= 核外电子数3.不同种类的原子,其质子数不同4.原子体积的大小主要由核外电子运动的空间范围决定5.因为电子的质量相对于质子和中子来说特别小,可忽略不计,所以原子的质量主要由质子数和中子数决定,原子的质量主要集中在原子核上二、相对原子质量1.定义:相对原子质量= 一个该原子的质量(kg)/一个碳12原子质量的1/12(kg)2.符号:Ar 单位:1 ,经常省略3.相对原子质量≈质子数+ 中子数4.C-12指的是含有6个质子和6个的中子碳原子,其中的12表示示这种碳原子的相对原子质量为12。


最新物质构成的奥秘专题复习一、物质构成的奥秘选择题1.下列是几种粒子的结构示意图,有关它们的叙述,你认为正确的是A.②表示的是阴离子C.③属于金属元素【答案】 DB.①②③④表示的是四种不同元素D.①③所表示的粒子化学性质相似【解析】A、② 质子数 =11,核外电子数 =10,质子数>核外电子数,为阳离子,错误; B、①②③④的核内质子数分别为:8、11、 16、 11,②④属于同种元素,①②③④表示的是三种不同元素,错误;C、由③ 粒子的结构示意图可知,核内的质子数是 16,属于硫元素,元素的名称带有“石”字旁,属于非金属元素,错误;D、①③最外层电子数均为6,化学性质相似,正确。
故选D。
点睛:明确粒子中核内质子数和核外电子数之间的关系是解题的关键。
的2.下列有关微粒的说法正确的是A.分子可以再分,而原子不能再分B.分子、原子、离子都可以构成物质C.原子失去电子变成阴离子D.分子大,原子小【答案】 B【解析】【详解】A、在化学反应中分子可以再分,原子不能再分,脱离化学变化,原子仍可再分为原子核和核外电子,错误;B、构成物质的基本微粒:分子、原子和离子,所以分子、原子、离子都可以构成物质,正确;C、失去电子带正电荷,属于阳离子,错误;D、有的分子比有的原子大,有的原子比有的分子大,所以分子和原子不能笼统的比较大小,错误。
故选 B。
3.2017 年 5 月我国发布了四种新元素的中文名称,右图是其中一种元素的信息,下列有关说法错误的是A.镆属于金属元素B.镆的原子序数115 表示其核内有115 个中子C.“ Mc表”示镆这种物质、镆元素、 1 个镆原子D.四种新元素的原子中质子数不同【答案】 B【解析】【分析】【详解】A.金属元素名称一般有“钅”字旁,镆带有“钅”字旁,属于金属元素,说法正确,不符合题意;B.质子数 =核电荷数 =原子序数解答,故镆原子的核内中子数不一定有115 个,说法错误,符合题意;C.“ Mc表”示镆这种物质、镆元素、 1 个镆原子,说法正确,不符合题意;D.不同元素的本质区别是质子数不同。


同头备课教案总第32节小组:学校:【回答】二氧化碳和一氧化碳的分子构成不同。
【练习】1. 下列各组物质中,都由离子构成的一组是( )A. NaCl、CuSO4B. CH4、HClC. Si、CO2D. Ar、Au2. 如图表示氢气和氧气发生的化学反应。
下列说法正确的是( )A. 分子是化学变化中的最小微粒B. 每个氢分子由2个氢原子构成C. 每个水分子是由2个氢分子和1个氧分子构成的D. 化学反应前后原子数和分子数均不会发生变化3. 用分子的知识解释下列现象,正确的是( )A.带火星的木条在氧气中能复燃,在空气中却不能,说明它们中的氧分子化学性质不同B. 缉毒犬能根据气味发现毒品,是由于分子不断运动C. 变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大D. 降温能使水结成冰,是因为在低温下水分子静止不动二、原子的结构和离子【提问】原子由什么构成?【回答】原子由居于中心的原子核和绕核运动的核外电子构成。
原子核又由质子和中子构成。
【提问】原子不显电性的原因是什么?【回答】电子带负电,质子带正电,中子不带电,且电子数等于质子数,所以正负电荷抵消。
【提问】为什么相对原子质量可以用质子数加中子数表示?【回答】原子的质量主要集中在原子核上,而电子和质子的相对质量约等于1,故相对原子质量约等于质子数+中子数。
【提问】请画出氯原子的结构示意图,并说各个部分代表的含义。
【提问】请画出钠原子的结构示意图,对比氯原子的结构示意图,说一说它们有什么不同。
【回答】氯原子为非金属元素的原子,最外层电子数一般大于4,容易得到电子达8电子稳定结构;钠原子为金属元素的原子,最外层电子数一般小于4,容易失去电子达8电子稳定结构。
【追问】因此元素原子的化学性质由什么决定?【回答】最外层电子数。
【补充】稀有气体的最外层电子数为8,氦为2,因此稀有气体的化学性质稳定。
【提问】氯原子得到电子、钠原子失去电子后变为什么?【回答】阴离子、阳离子。