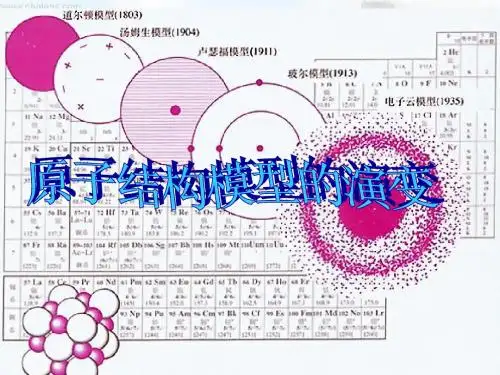
原子结构模型演变
- 格式:ppt
- 大小:839.50 KB
- 文档页数:35
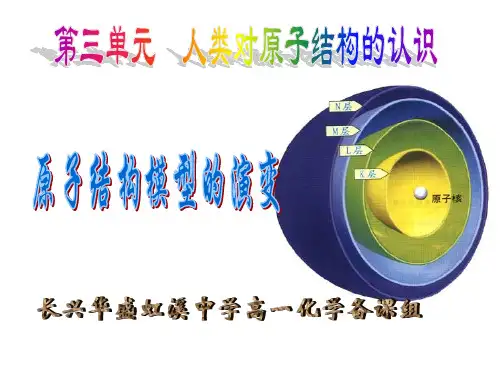


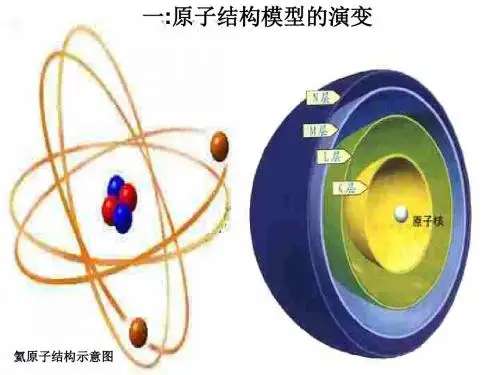
原子结构模型的演变
原子结构模型的演变经历了多个阶段,其中最重要的包括:
1. 原子不可分模型:古希腊的哲学家认为,物质是由不可分的粒子构成的。
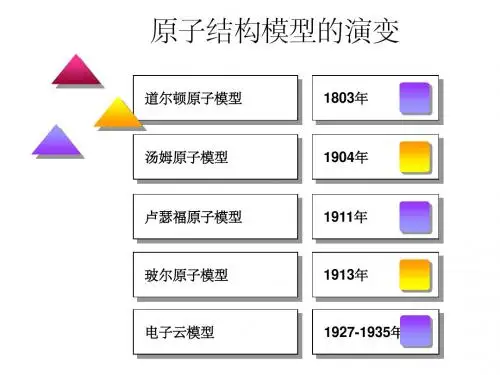
2. 道尔顿原子模型:约翰•道尔顿是第一个提出原子理论的科学家。
他认为,所有的物质都是由小球状的原子构成的,这些原子在化学反应中不会被分解或破坏。
3. 汤姆逊原子模型:汤姆逊用阴极射线管实验证明了原子是可分的,并发现了电子。
他把原子看作是带有正电的球体,电子散布在球体内部。
4. 卢瑟福原子模型:卢瑟福利用金箔反射性实验证明了原子的核心是带有正电的,并提出了原子的行星模型,即核心像太阳一样,电子绕核心旋转。
5. 波尔原子模型:尼尔斯•波尔用量子理论解释了原子的行为,并提出了原子壳层模型,即电子只能在固定的能级上旋转。
6. 原子云模型:薛定谔用波动理论解释了原子的行为,提出了原子云模型,即电子在很多不同的能级上旋转,并且存在于原子的三维空间中。



原子结构模型演变历程及其物理意义在我们生活中无处不在的原子是构成物质的基本单位,通过对原子结构的研究,我们可以更好地理解物质的性质和现象。
原子结构模型的演变历程是科学发展的一个重要方面,也是物理学的重要研究领域之一。
本文将通过回顾原子结构模型从古希腊时代开始的演变历程,探讨各个时期提出的模型的物理意义。
古希腊时代:原子的概念古希腊哲学家德谟克利特首次提出了“原子”这一概念,他认为物质由不可分割的微小粒子构成,这些粒子就是原子。
德谟克利特的原子观为后来的原子理论奠定了基础,虽然他未能提供实验证据,但这一概念的提出开启了原子结构研究的大门。
19世纪:化学元素周期律的发现随着化学元素周期律的发现,科学家们开始意识到原子不可能是最基本的粒子,反而是由更小的粒子构成。
著名的化学家门捷列夫提出了元素周期律,揭示了元素性质的周期变化规律,这启发了人们对原子内部结构的探索。
20世纪初:卢瑟福散射实验卢瑟福的著名散射实验揭示了原子的大部分质量和正电荷集中在原子核中心的事实。
这一发现推动了卢瑟福原子模型的提出,认为原子由一个小而密集的带正电的核和围绕核运动的电子组成,象征着原子模型的重大突破。
量子力学的发展:现代原子结构模型随着量子力学的发展,原子结构模型经历了量子力学的革新。
量子力学描述了微观粒子的运动和行为,诞生了现代原子结构模型,如薛定谔的波动力学模型和海森堡的矩阵力学模型,这些模型更准确地描述了原子内部结构和性质。
物理意义原子结构模型的演变历程在物理意义上具有重要意义。
通过对不同模型的逐步完善和修正,我们更深入地理解了原子的内部结构和性质,揭示了微观世界的奥秘。
原子结构模型的研究对于物质的性质、化学反应、材料科学等方面都具有重要的影响,为人类认识和利用自然界提供了重要的理论基础。
综上所述,原子结构模型演变历程是科学发展的重要组成部分,也是物理学研究的重要方向。
通过对原子结构模型历史的回顾和探讨,我们能更深入地理解物质世界的微观结构,为科学研究和应用提供了重要的理论支持和指导。

原子结构模型演变引言:原子是构成物质的基本单位,对于人类来说,了解原子结构的演变是科学发展的重要里程碑。
本文将从经典模型、波尔模型到量子力学模型,介绍原子结构模型的演变过程。
一、经典模型1. 托姆逊模型19世纪末,英国物理学家约瑟夫·约翰·托姆逊提出了托姆逊模型。
他认为原子是由带正电的球体中带负电的电子组成,这种模型可以解释电子在原子内的位置和运动。
然而,托姆逊模型无法解释原子的稳定性和光谱现象。
2. 鲁瑟福模型1909年,英国物理学家欧内斯特·鲁瑟福提出了鲁瑟福模型。
他的实验发现,原子中几乎所有的质量都集中在一个非常小的核心部分,而电子则围绕核心旋转。
这一模型解释了原子的稳定性和光谱现象,但无法解释电子在轨道上的运动方式。
二、波尔模型1. 波尔理论1913年,丹麦物理学家尼尔斯·波尔提出了波尔理论。
波尔根据鲁瑟福模型,结合了经典电磁理论和量子理论的思想,提出了电子只能在特定轨道上运动,且每个轨道对应一定能量。
这一模型解释了原子的光谱现象,并奠定了原子结构研究的基础。
2. 波尔模型的局限性尽管波尔模型在解释原子结构方面取得了重要成果,但它无法解释原子的精细结构和不同元素的光谱线。
此外,波尔模型也未能解释电子在轨道上的运动方式和原子中的电子云分布。
三、量子力学模型1. 波动力学1926年,奥地利物理学家埃尔温·薛定谔提出了波动力学理论。
该理论结合了波动性和粒子性的概念,通过波函数描述了电子在原子中的运动状态。
波动力学理论成功解释了原子的精细结构和光谱现象。
2. 玻恩-奥本海默近似1928年,德国物理学家玻恩和奥本海默提出了近似方法,称为玻恩-奥本海默近似。
该近似方法通过计算原子间的相互作用,预测了原子结合能和分子结构,为化学反应的研究提供了重要的理论基础。
3. 量子力学模型量子力学模型是目前最为完善的原子结构模型。
它通过数学方程描述了原子中电子的运动状态和能量。
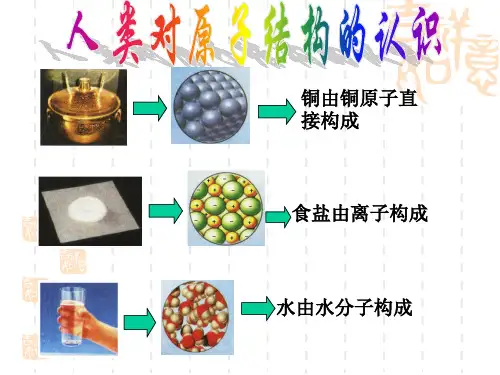
第一章 打开原子世界的大门预习:原子到底是什么东西;在科学家眼中,原子是怎样的;科学家是怎样探索原子结构的原子结构模型的演变经历了哪几个阶段;各阶段对原子结构的认识各有什么特点第一节 从葡萄干面包模型到原子结构的行星模型主线:从道尔顿原子论到卢瑟福行星原子模型——人们对原子结构的探索过程一、人类认识原子结构的主要历史阶段1.古典原子论——古代哲学家对物质结构的各种猜测我国战国时期的惠施认为:物质是无限可分的墨子认为:物质被分割是有条件的古希腊哲学家得谟克利特认为原子是构成万物的极小的最小的微粒,物质的分割只能到原子为止2.道尔顿原子说实验依据:古代原子学说没有实验依据,只是一种猜想,没有现代科学所必须的逻辑性和严密性 道尔顿原子结构学说的主要观点⑴化学元素均由不可再分的微粒构成⑵原子在一切化学变化中均保持其不可再分性⑶同一元素的原子在质量和性质上都相同不同元素的原子在质量和性质上都不同⑷不同元素化合时,这些元素按简单整数比结合成化合物从现代化学理论分析,道尔顿的原子学说是否合理?能否举出实例来证明(都不正确)科学家是怎样否定道尔顿的原子学说的呢3.X 射线和放射性现象的发现射线从哪里来?原子是否可以再分?德国物理学家伦琴发现X 射线(一种看不见的有巨大穿透能力的射线)法国物理学家贝克勒尔发现了铀的放射性英国物理学家卢瑟福发现铀能产生两种不同的射线:带正电荷的α射线(α粒子是+242He ),和带负电荷的β射线(β射线为电子流)。
同时还存在一种不带电荷的γ射线(γ射线是一种波长很短的电磁波)汤姆孙发现了电子电子带负电,单原子是电中性的,表明原子中存在带正电荷的微粒汤姆孙提出葡萄干面包模型原子中的正电荷均匀地分布在整个原子的球形体内,电子均匀地分布在这些正电荷之间,就像葡萄干面包一样合理之处:原子不是坚硬、实心的球体,是可以分割的不合理之处:原子的质量分布是均匀的,原子中的电荷分布也是均匀的4.用α粒子轰开原子世界的大门卢瑟福用α粒子轰击金箔——α粒子散射实验⑴α粒子散射实验的装置介绍放射源——放射性元素放出α粒子,α粒子是氦的核,带2e正电荷,质量是氢原子的4倍,具有较大的动能。
玻尔原子结构模型的发展过程
玻尔原子结构模型的发展经历了以下几个阶段:
1. 瑞利-里瓦尔德模型
19世纪末,瑞利和里瓦尔德提出了半经验的经典原子模型。
在这个模型中,原子被视为一个正电荷的球体,电子被认为是均匀地分布在球体的表面上。
2. 普朗克量子条件
1900年,普朗克提出了量子条件,他发现能量的辐射和吸收是离散的,而不是连续的。
他提出了一个简单的方程,使得他能够计算发射或吸收单元能量的最小值。
3. 瑞利-斯佩克特原子模型
1903年,瑞利和斯佩克特发明了一种新的模型,即原子被认为是一个带电荷的球体,电子围绕在球体周围。
但是该模型仍然不能解释其它性质,如光发射的频率和能量。
4. 玻尔原子结构模型
1913年,玻尔提出了一种新的原子结构模型,该模型包括以下假设:
- 原子由带正电荷的核心和固定轨道上的电子组成。
- 一个电子只能在一个确定的轨道上运动,每个轨道对应具有确定能量的电子。
- 电子可以在轨道之间跃迁,电子所吸收或发出的辐射的频率与跃迁前后的轨道上的能量差有关。
该模型成功地解释了氢原子的发射光谱,但是对于更复杂的原子结构,它并不适用。
5. 量子力学理论
20世纪20年代初,量子力学理论的出现使得科学家们能够更好地理解原子结构。
量子力学理论同时也引发了原子物理和化学的革命,开创了新的科学领域。
1—5—1原子结构模型的演变学习目标:了解构成物质的微粒;了解原子结构模型的演变;知道化合价的实质;学习重点:原子结构模型,化合价的实质学习难点:化合价的实质一.原子结构模型的演变1.构成物质的微粒2.原子结构模型的演变(1)道尔顿原子结构模型形状学说内容(2)汤姆生原子结构模型形状学说内容(3)卢瑟福原子结构模型形状学说内容(4)现代原子结构模型形状学说内容3.原子结构示意图4.1~18号元素原子结构示意图二.化合价1.定义2.化合价的实质(1)氧化镁形成过程(2)氯化钠形成过程(3)氧化铝形成过程结论:练习1.自从下列哪项发现或学说开始,化学才开始成为一门科学()A.阿伏加德罗提出原子——分子学说B.拉瓦锡确定空气的组成C.道尔顿提出近代原子学说D.汤姆逊发现电子2. 下列说法正确的是()A.原子是不可再分的粒子B.相对原子质量就是原子的实际质量C.分子是保持物质性质的最小粒子D.与元素化学性质关系密切的是原子的最外层电子数3.下列现象能证明分子在化学变化中可分的是()A. 100 mL水和100 mL酒精混合后总体积小于200 mLB.打开盛装浓盐酸瓶盖,浓盐酸逐渐减少C.气态氧在加压降温时变为淡蓝色的液态氧D.在1000℃时,甲烷可分解为石墨和氢气4.在1911年前后,物理学家卢瑟福把一束变速运动的α粒子(相对原子质量约为4的带2个单位正电荷的质子粒),射向一片极薄的金箔。
他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟能让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的。
但也有极少数的α粒子发生偏转,或被笔直地弹回。
根据以上实验现象能得出关于金箔中Au原子结构的一些结论。
试写出其中的三点:(1)______________________________________________________________ (2)______________________________________________________________ (3)______________________________________________________________。