无机及分析化学答案
- 格式:doc
- 大小:161.50 KB
- 文档页数:33

《无机及分析化学》作业答案第一章(P25)1—8 (1)26.44% (2) 6.14mol·Kg -1; (3) 5.42 mol·L -1; (4) x(NaCl)=0.0995, x(H 2O)=0.9005 1—9 ⊿t b =K b ·b B 相同则b B 相等,1.5g/(60g·mol -1×200g)=42.8g/(M x ×1000g)M x =342 g·mol -11—11 ⊿t f =K f ·b B =1.86℃·kg·mol -1×19g/(M x ×100×10-3Kg) M x =1606 g·mol -1 1—13 П=c B RT≈b B RT R=8.314kPa·L·mol -1·K -1 ≈8.314kPa·kg·mol -1·K -1(ρ≈1.0 kg·L -1稀溶液) ⊿t f ==0.56℃=K f ·b B =1.86℃·kg·mol -1×b BП=8.314kPa·kg ·mol -1·K -1×309.65K×0.56℃/1.86℃·kg·mol -1=775.09 kPa 1—14 过量AgNO 3过量 胶团结构式:[(AgI)m ·n Ag +·(n-x) NO 3-]x+·xNO 3- 正溶胶,负极移动 1—15 三硫化二砷溶胶胶团结构式:[ (As 2S 3) m ·nHS -·(n-x) H +]x-·x H +, 负溶胶, 聚沉能力:NaCl ﹤Mg Cl 2﹤AlCl 3,第二章(P57)2—17 ∆r H m θ=3∆f H m θ(N 2,g)+4∆f H m θ(H 2O,g)- ∆f H m θ(N 2O 4,g)- 2∆f H m θ(N 2H 4,l)=3×0+ 4×(-241.84kJ·mol -1)-(9.661kJ·mol -1)- 2×(50.63kJ·mol -1)= -1078.28 kJ·mol -11078.28×103 J=mgh=100kg×9.8×h h=1100m2—18 ∆r G m θ=∆f G m θ(C 6H 12O 6,s)+6∆f G m θ(O 2,g)- 6∆f G m θ(H 2O,l)- 6∆f G m θ(CO 2,g)=(-910.5kJ·mol -1)+6×0 -6×(-237.14kJ·mol -1)- 6×(-394.38kJ·mol -1)= 2878.62 kJ·mol -1 >0 即298K 及标态下不能自发进行第三章(P89)3—13题 解: 2SO 2(g) + O 2(g) 2SO 3(g)起始分压P 0(kPa) 0.4RT 1.0RT 0平衡分压P(kPa) 0.08RT 0.84RT 0.32 K θ={[p(SO 3)/p θ]2/{[p(SO 2)/p θ] 2[p(O 2)/p θ]}=0.286,其中p θ=100kPa ,Kc θ=19.053—14题 解: PCl 5(g) PCl 3(g) + Cl 2(g)起始分压P 0(kPa) 0.35RT 0 0平衡分压P(kPa) 0.10RT 0.25RT 0.25RT K θ={[p(PCl 3)/p θ][p(Cl 2)/p θ]/[p(PCl 5)/p θ]=27.18, 其中p θ=100kPa ,Kc θ=0.6253—15题 解:(1)理论计算∆r H m θ(T)≈∆r H m θ(298.15K)= ∑ ∆f H m θ(B,298.15K)=172.43 kJ ·mol -1,∆r S m θ(T)≈∆r S m θ(298.15K)= ∑ S m θ(B,298.15K)=182.23 J ·mol -1·K -1,∆r G m θ(298.15K )=∑ ∆f G m θ(B,298.15K)=119.78 kJ ·mol -1,∆r G m θ(1773K)=∆r H m θ(298.15K)-1773×∆r S m θ(298.15K)=-150.66 kJ ·mol -1,∆r G m θ(298.15K)与∆r G m θ(1773K)完全不同(2)实验值计算 lg(K 2θ/K 1θ)= ∆r H m θ/2.303R ×[(T 2-T 1)/ T 2 T 1]——范特霍夫公式 得∆r H m θ=96.65 kJ ·mol -1,∆r G m θ(T)=-RTln K θ=-2.303RTlg K θ,得∆r G m θ(1773K)=-112.8 kJ ·mol -1,∆r G m θ(1773K)=∆r H m θ-1773×∆r S m θ= -112.8 kJ ·mol -1,得∆r S m θ=0.1181 kJ ·mol -1·K -1=118.1 J ·mol -1·K -1,B νB νB ν可见理论计算值和实验计算值相差较大,如何计算看题意。

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。

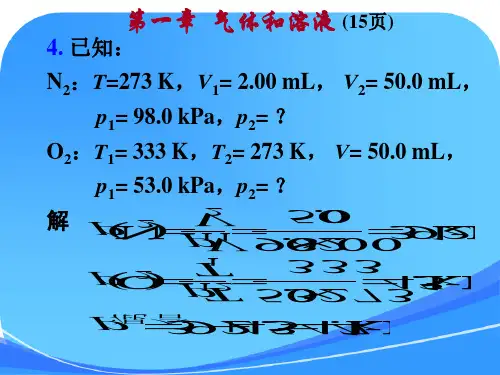
第一章 气体和溶液2. 解:根据理想气体状态方程:nRTV p =可得: RTpV M n ==m 则: mol /0.160.250L101.3kPa K 298K mol L kPa 315.8164.0-11g g pV mRT M ≈⨯⨯⋅⋅⋅⨯==-该的相对分子质量为16.04. 解:由题意可知,氮气为等温变化,氧气为等容变化 kPa 92.350.0mL2.00mL kPa 0.98211N 2=⨯==V V p p kPa 45.43333K 732kPa 0.53121O 2=⨯==K T T p p 根据道尔顿分压定律:kPa4.4792.345.4322O N ≈+=+=p p p 总7. 解: T =(273+15)K = 288K ; p 总 =100kPa ;V =1.20L 288K 时,p (H 2O)=1.71kPaM (Zn)=65.39则 p 氢气= (100-1.71)kPa = 98.29kPa mol 0493.0K288K mol L 8.315kPa L 20.18.29kPa 911-=⨯⋅⋅⋅⨯==-RT pV n 氢气根据: Zn(s) + 2HCl → ZnCl 2 + H 2(g)65.39g 1molm (Zn)=? 0.0493mol解得m (Zn)=3.22g则杂质的质量分数 w (杂质) = (3.45-3.22)/ 3.45 = 0.06714. 解:因溶液很稀,可设ρ ≈1 g·mL -1(1) 14113L mol 1054.1K293K mol L kPa 315.8kPa 10375-----⋅⨯=⋅⋅⋅⋅⨯=∏=RT c (2) mol g L L g cV m n m M /1069.6mol 1054.1010.50515.04143⨯=⋅⨯⨯⨯===--- 血红素的相对分子质量为41069.6⨯ (3) K1086.2kg mol 1054.1mol kg K 86.14141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T f f K1088.7kg mol 1054.1mol kg K 512.05141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T b b (4)由于沸点升高和凝固点下降的值太小,测量误差很大,所以这两种方法不适用。

无机及分析化学知到章节测试答案智慧树2023年最新齐鲁工业大学第一章测试1.无机及分析化学就是将无机化学和分析化学有机整合,集二者的基础性和实用性于一身的一门化学专业基础课程,是大学化学的基石和化学研究的起点。
参考答案:对2.测定常量组分的某样品中硫酸根的含量,可采用硫酸钡重量分析法。
参考答案:对3.从历史上看,无机化学是发展最早的一门化学分支学科,是化学研究的先驱。
参考答案:对4.以化学反应为基础的分析方法,称为:参考答案:化学分析法5.通常所说的四大化学是指?参考答案:物理化学;有机化学;无机化学;分析化学6.本课程包含化学的哪两个二级学科?参考答案:分析化学;无机化学7.下列哪些内容属于无机化学的研究对象?参考答案:电化学;配位化学;化学热力学;结构化学;化学动力学;元素化学第二章测试1.已知置信度为90%,n = 6 时,t =2.015,在一组平行测定中, 所得测定结果如下: 8.44, 8.32, 8.45, 8.52, 8.69, 8.38,下列内容正确的是参考答案:置信度为90%时平均值的置信区间8.47±0.11;标准偏差为0.132.已知n = 6 时,Q0.90 = 0. 56。
在一组平行测定中,所得测定结果如下:10.56,10.44,10.57,10.64,10.81,10.50,则参考答案:所有数据都是可靠值3.系统误差具有重现性,是可测误差参考答案:对4.带有偶然误差的测量数据,不能参加平均值的计算参考答案:错5.滴定分析中,指示剂确定的滴定终点与化学计量点不一致,由此产生的误差属于试剂误差。
参考答案:错6.系统误差主要影响分析测定中的准确度参考答案:对7.pM=-lg[Mn+]=3.00,金属离子浓度[Mn+]有效数字位数为3位参考答案:错8.对于同一组测定数据,置信度越小,置信区间越小。
参考答案:对9.用分析天平采用减量法称量试样,要使称量误差不大于0.1%,至少要称取试样参考答案:0.2g10.已知 pH=5.25,则[ H+ ]=5.62×10-6mol•L-1 。

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。

第二章 原子结构和元素周期律 习题解答1.简单说明四个量子数的物理意义和量子化条件。
2.定性画出s, p, d 所有等价轨道的角度分布图。
3.下列各组量子数哪些是不合理的?为什么?(1)2, 1, 0n l m ===; (2)2, 2, 1n l m ===-;(3) 3, 0, 0n l m ===; (4)3, 1, 1n l m ===+;(5)2, 0, 1n l m ===-;(6)2, 3, 2n l m ===+。
解 (2),(5),(6)组不合理。
因为量子数的取值时要求l < n ,m ≤ l 。
4.用合理的量子数表示(1)3d 能级;(2)2p z 原子轨道;(3)4s 1电子。
解 (1)3d 能级的量子数为:n = 3,l = 2。
(2)2p z 原子轨道的量子数为:n = 2,l = 1,m = 0。
(3)4s 1电子的量子数为:n = 4,l = 0,m = 0,m s =12+。
5.在下列各组量子数中,恰当填入尚缺的量子数。
(1) n =?,l =2,m =0,m s = +1/2; (2) n =2,l =?,m =-1,m s =-1/2; (3) n =4,l =2,m =0,m s = ?; (4) n =2,l =0,m =?,m s = +1/2。
解 (1)n ≥ 3正整数; (2)l = 1; (3)m s = +½(或-½); (4)m = 0。
6.下列轨道中哪些是等价轨道?x x x y z 2s, 3s, 3p , 4p , 2p , 2p , 2p 。
解 对氢原子: (n 相同)(x y z 2s, 2p , 2p , 2p );(x 3s, 3p 3s ,3p x )。
对多电子原子:(n 、l 相同)(x y z 2p , 2p , 2p )。
7.下列各元素原子的电子分布式各自违背了什么原理?请加以改正。

无机及分析化学智慧树知到课后章节答案2023年下长江师范学院长江师范学院第一章测试1.化学主要是在分子、原子或离子等层次上研究物质的组成,结构,性能,相互变化以及变化过程中能量关系的科学。
()A:错 B:对答案:对2.卢瑟福提出了量子化原子模型,揭示了原子内部的构造奥秘,认识了物质的无限可分性。
()A:对 B:错答案:错3.化学变化的特点是()A:反应前后质量守恒,且有新物质生成B:电荷守恒C:质量守恒D:能量守恒答案:反应前后质量守恒,且有新物质生成4.把分子中的原子重新组合,但原子不变的运动称为()A:物理运动B:核反应运动C:化学运动D:微观运动答案:化学运动5.被恩格斯称为化学之父的科学家是:()A:盖斯B:拉瓦锡C:道尔顿D:门捷列夫答案:道尔顿6.发现氧元素的科学家是()。
A:波义尔B:道尔顿C:拉瓦锡D:门捷列夫答案:拉瓦锡第二章测试1.稀溶液的依数性中起决定性的性质是溶液的蒸气压下降。
()A:对 B:错答案:对2.质量相同的N2和O2,在同温同压下,它们的体积比为7:8。
()A:错 B:对答案:错3.理想气体状态方程用于真实气体的条件是()A:高温、高压B:低温、低压C:高温、低压D:低温、高压答案:高温、低压4.由过量KBr溶液与AgNO3溶液混合得到的溶胶,其()A:溶胶是负溶胶B:反离子是NO3-C:电位离子是Ag+D:扩散层带负电答案:溶胶是负溶胶5.比较① 0.1 mol·L-1 Na2SO4溶液;② 0.1 mol·L-1 CH3COOH溶液;③ 0.1mol·L-1 C6H12O6溶液④ 0.1 mo l·L-1 NaCl溶液。
各水溶液的渗透压从大到小的顺序为:()A:①﹥③﹥④﹥②B:④﹥③﹥①﹥②C:①﹥④﹥②﹥③D:①﹥②﹥③﹥④答案:①﹥④﹥②﹥③6.68%HNO3(相对分子质量为63,密度ρ为1.40g.ml-1)水溶液,质量摩尔浓度为()。

1.根据下列酸碱的解离常数,选取适当的酸度是共轭碱来配置PH=4.50和PH=10.00的缓冲溶液,其共轭酸,碱的浓度比应是多少?HAC,NH3·H2O,H2C2O4 ,NaHCO3 ,H3PO4,NaAC,NaHPO4,C6H5NH2,NH4cl解:选择HAC和NaAC来配置PH=4.50的缓冲液,共轭酸碱的浓度比可由以下来计算检表得:K aΘ(HAC)=1.8×10-5 Kbθ(AC-)=Kw/ K aΘ=10-14/(1.85×10-5)=5.6×10-10由PH=14-Pk bθ+lg((C(AC-))/(C(HAC)))可得4.50=14-lg(5.6×10-10)+lg((C(AC-))/(C(HAC))) 解得:(C(AC-))/(C(HAC))=4/7=1.74选择NH3·H2O和NH4cl来配制PH=10.00的缓冲液,共轭酸碱的浓度比如下K bθ(NH3·H2O)=1.8×10-5PH=14- Kbθ(NH3·H2O)+lg(C(NH3·H2O)/C(NH4cl))10=14-lg(1.8×10-5)+ lg(C(NH3·H2O)/C(NH4cl))解得:C(NH3·H2O)/C(NH4cl)=5:12.欲配制250mlPH=5.00的缓冲液,问在125ml,1.0mol·L-1NaAC溶液中应加入多少毫升6.0 mol·L-1溶液?解:由题意得可设还应加入xml,6.0 mol·L-1的HAC溶液检表得KaΘ(HAC)=1.8×10-5PH=Pk aθ(HAC)+lg((C(AC-))/(C(HAC)))5=-lg(1.8×10-5)+ lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=1.82n(AC-)=0.125×1mol·L-1=0.125mol;n(HAC)=6x×10-3mol0.125/(0.125+x×10-3)/(6x×10-3/(0.125+x×10-3))=0.125/(6x×10-3)解得:x=11.6ml3.计算下列各溶液的PH:(3)20.0ml 0.10 mol·L-1NaOH和20.0ml 0.20 mol·L-1 NH4cl溶液混合解:由题意的检表可得Kb(NH3)θ= 1.8×10-5 ; K aθ(NH4+)=Kw/ Kb(NH3)θ=10-14/(1.8×10-5 )=5.56×10-10n(OH-)=0.002mol n(NH4+)=0.004molC(NH3·H2O)=0.002/(0.02+0.02)=0.05 mol·L-1 C(NH4+)=0.02/(0.02+0.02)=0.05 mol·L-1 PH=Pk aθ(NH4+)+lg(C(NH3·H2O)/C(NH4cl))=-lg(5.56×10-10)+0=9.26(5)20.0ml 0.10 mol·L-1Hcl和20.0ml0.20 mo l·L-1NaAC溶液混合混合前:n(H+)=0.002mol n(AC-)=0.0004mo l混合后:C(HAC)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1C(AC-)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1PH=Pkaθ(HAC)+lg((C(AC-))/(C(HAC)))检表得:Pk a θ(HAC)=1.8×10-5=-lg(1.8×10-5)+lg(0.05/0.05)=4.74(9)300.0ml 0.5mol·L-1 H3PO4与400.0ml1.00 mol·L-1NaOH的混合液n(H3PO4)=0.3×0.5=0.15mol C(OH-)=0.4×1mol=0.4molK aθ(HPO42-)=4.5×10-13混合后:n(Na3PO4)=0.1moln(Na2HPO4)=0.05mol则:n(Na3PO4)/ n(Na2HPO4)=2PH= K aθ(HPO42-)+lg2=-lg(4.5×10-13)+lg2=12.651.今有2.00L的0.5001.00 mol·L-1NH3(aq)和2.0L的0.500mol·L-1Hcl溶液,若配制PH=9.00的缓冲溶液,不允许再加水,最多能配制多少升缓冲溶液,其中C(NH3),C(NH4+)各为多少?解:由表可知: Kb(NH3)θ= 1.8×10-5则PH=14- K bθ(NH3·H2O)+ lg(C(NH3·H2O)/C(NH4cl))=9即:PH=14-4.74+ lg(C(NH3·H2O)/C(NH4cl))=9得lg(C(NH3·H2O)/C(NH4cl))=-0.26解得C(NH3·H2O)/C(NH4cl)=0.55设 xL NH3·H2O yL HCl则有 C(NH3·H2O )=n(NH3·H2O )/V总=0.5(x-y)/(x+y) mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y)mol·L-1即C(NH3·H2O)/ C(NH4+)=0.55解得x/y=1.55若要溶液最多,只需令x=2.00L,则y=1.3L此时 C(NH3·H2O )=0.5(x-y)/(x+y) mol·L-1=0.11 mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1 =0.2 mol·L-12.列表指出下列配合物的形成体、配体、配位原子和形成体的配位数;确定配离子和形成体的配位数;确定配离子和形成体的电荷数,并给出他们的命名。

《无机及分析化学》习题答案一、单选题(小四号宋体)1.下列四个量子数正确的组合正确的是( B )A: n=3, l=-3, m=0, ms=0; B: n=4, l=3, m=-1, ms=+1/2;C: n=2, l=0, m=-1, ms=-1/2; D: n=3, l=2, m=2, ms=+1/2;2.对钠,铝,磷,氯四种元素,随原子序数增加元素性质变化叙述正确的有( B )A: 第一电离能依次增加;B: 最高氧化值依次增大;C: 原子半径依次增大;D: 电负性依次增大;3.下列粒子的空间构型正确的有( C )A: SF4(平面四边形)B: [Fe(CN)6]3-(正八面体形)C: Ag(NH3)2+(角形)D: ClO4-(正四面体)4.下列分子中偶极矩不为零的是( B )A. CCl4B. NH3C. SF6D. BeCl25.选出核外电子排布正确的粒子( D )A: (Cu1+(Z=29)) [Ar]3d10;B: (Fe3+(Z=26)) [Ar]3d5;C: (Ba(Z=56)) 1s22s22p63s23p64s23d104p65s24d105p66s2;D: (Zr(Z=40)) [Ar]4d25s2;6.在具有下列价层电子组态的基态原子中,金属性最强的是( A )A. 4s1B. 3s23p5C. 4s24p4D. 2s22p17.邻苯二甲酸分子间存在的分子间力有( C )1.:色散力B:取向力C:诱导力D:氢键8.下列哪一组n、l、m量子数错误的是( B )1.. 3,2,-2 B. 3,0,1 C. 3,3,1 D. 5,4,-49.基态13Al原子最外层电子的四个量子数应是( A )A. 3,1,+1,12+ B. 4,1,0,12+C. 3,2,1,12+ D. 3,2,2,12+10.下列判断中正确的是( A )A CO2为非极性分子,而SO2为极性分子B.[Ag(NH3)2]+配离子中的中心离子Ag+采取的是SP2杂化方式C HI分子比HBr分子的共价成分多一些D O2+不具有顺磁性11.下列四个量子数组合正确的是( C )A. n=3, l=-3, m=0, ms=0B. n=4, l=3, m=-1, ms=+1/2C. n=2, l=0, m=-1, ms=-1/2D. n=3, l=2, m=2, ms=+1/212. 下列说法中错误的是 ( D )A. 只要n,l 相同,径向波函数R(r)就相同B. 波函数的角度分布图形与主量子数无关C. 只要l,m 相同,角度波函数Y(θ,φ)就相同D. s 轨道的角度分布波函数Ys(θ,φ)也与角度θ,φ有关13. 在电子云示意图中的小黑点 ( D )A. 表示电子B. 表示电子在该处出现C 其疏密表示电子出现的几率大小D 其疏密表示电子出现的几率密度大小14. 下列哪一组数值是原子序数19的元素的价电子的四个量子数(依次为n,l,m ,ms ) D) A. 1,0,0,+1/2 B. 2,1,0,+1/2C. 3,2,1,+1/2D. 4,0,0,+1/215. 原子核外电子排布主要应遵循 ( A )A. 统计规律B. 能量最低原理C. 泡利不相容原理D. 洪特规则16. 若将氮原子的电子排布式写成1s 22s 22px 22py 1,它违背 ( D) A.能量守恒原理 B.泡利不相容原理C.能量最低原理D.洪特规则17. 在l=3的亚层中,最多能容纳的电子数是 ( B )A. 2B. 6C. 10D. 1418. 某元素原子的外层电子构型为3d54s2,它的原子中未成对电子数为 ( A )A. 0B. 1C. 3D. 519. 原子序数为33的元素,其原子在n=4,l=1,m=0的轨道中的电子数为 ( D) A. 1 B. 2 C. 3 D. 4 E. 520. 下列函数均为状态函数的是 ( C )A. H ,G ,UB. U ,S ,QC. G ,W ,UD. G ,S ,W21. 下列反应中,r m H θ∆与产物的f m H θ∆相同的是 ( D )A. 2()2()2()22g g g H O H O +→B. 2()2()()12g g g NO O NO +→C. C C →))(金刚石(石墨D. 2()2()2()12g g g H O H O +→22. 下列结论正确的是 ( B )A. 当△H>0,△S<0时,反应自发进行B. 当△H<0,△S>0时,反应自发进行C.当△H<0,△S<0时,任何温度下均不自发进行D.当△H>0,△S>0时,任何温度下均不自发进行23.标定KMnO4溶液浓度时,应使用的基准物质是( D )A. K2Cr2O7B. Na2CO3C. Na2S2O3D. Na2C2O424.下列物质中,常用作基准物质来标定NaOH溶液浓度的是( B )A. H2CO3B. 邻苯二甲酸氢钾C. 苯酚D. H2C2O4 ·2H2O25.下列分子或离子中,键角最小的是( B )A. HgCl2B. H2OC. NH3D. PH326.下列说法正确的是( C )A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体;B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。

第1章 思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是( )A. 蔗糖(C 12H 22O 11)溶液B. 葡萄糖(C 6H 12O 6)溶液C. 丙三醇(C 3H 8O 3)溶液D. 尿素( (NH 2)2 CO )溶液解:选D 。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D 中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg -1下列水溶液中凝固点最低的是( )A. NaCl 溶液B. C 12H 22O 11溶液C. HAc 溶液D. H 2SO 4溶液解:选D 。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H 2SO 4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是( )A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
您的本次作业分数为:94分单选题1.HCl和H2O两分子间形成的分子间作用力有()。
• A 色散力• B 取向力• C 诱导力• D 以上三者全有.正确答案:D•单选题2.从精密度好就可以断定分析结果可靠的前提是()。
• A 随机误差小• B 系统误差小• C 平均偏差小• D 标准偏差小正确答案:B•单选题3.称取同样质量的两种难挥发的电解质A和B,分别溶解在1升水中,测得A溶液的凝固点比B溶液的凝固点低,则()。
• A B的分子量小于A的分子量• B A的分子量和B的分子量相同• C B的分子量大于A的分子量正确答案:C•单选题4.两成键原子的原子轨道沿核间连线以“肩并肩”方式重叠形成()。
• A σ键• B 离子键• C Π键• D 氢键正确答案:C•单选题5.在酸碱滴定中,选择指示剂可不必考虑的因素是()。
• A pH突跃范围• B 指示剂的变色范围• C 指示剂的颜色变化• D 指示剂的分子结构正确答案:D•单选题6.多电子原子中决定电子能量的量子数为()。
• A n• B n,l• C n,l,m• D n,l,m,si正确答案:B•单选题7.可以减少分析测试中随机误差的措施是()。
• A 增加平行测定次数• B 进行方法校正• C 进行空白试验• D 进行仪器校正正确答案:A•单选题8.溶胶发生电泳时,向某一方向定向移动的是()。
• A 胶核• B 吸附层• C 胶团• D 胶粒正确答案:D•单选题9.某金属与其离子溶液组成电极,若溶液中金属离子生成配合物后,其电极电势值()。
• A 变小• B 变大• C 不变• D 难以确定正确答案:A•单选题10.用EDTA 直接滴定有色金属离子,终点所呈现的颜色是()。
• A 指示剂-金属离子配合物的颜色• B 游离指示剂的颜色• C EDTA-金属离子配合物的颜色• D (B)和(C)的混合颜色正确答案:D•单选题11.19号元素K基态最外层电子的四个量子数为()。
第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
第一章1.无机及分析化学就是将无机化学和分析化学有机整合,集二者的基础性和实用性于一身的一门化学专业基础课程,是大学化学的基石和化学研究的起点。
答案:对2.用已知浓度的氯化钡溶液测定硫酸根的含量,可采用重量分析法。
答案:对3.从历史上看,无机化学是发展最早的一门化学分支学科,是化学研究的先驱。
答案:对4.以化学反应为基础的分析方法,称为:答案:化学分析法5.通常所说的四大化学是指?答案:物理化学;无机化学;分析化学;有机化学6.本课程包含化学的哪两个二级学科?答案:无机化学;分析化学7.下列哪些内容属于无机化学的研究对象?答案:化学动力学;电化学;配位化学;化学热力学;结构化学;元素化学第二章1.已知置信度为90%,n = 6 时,t =2.015,在一组平行测定中, 所得测定结果如下: 8.44, 8.32, 8.45, 8.52, 8.69, 8.38,下列内容正确的是答案:标准偏差为0.13;置信度为90%时平均值的置信区间8.47±0.112.已知n = 6 时,Q0.90 = 0. 56。
在一组平行测定中,所得测定结果如下:10.56,10.44,10.57,10.64,10.81,10.50,则答案:所有数据都是可靠值3.系统误差具有重现性,是可测误差答案:对4.由于偶然误差所得到数据,不能参加平均值的计算答案:错5.滴定分析中所选择的终点指示剂确定的终点和理论终点不一致,由此造成的误差主要是试剂误差。
答案:错6.系统误差主要影响分析测定中的准确度答案:对7.pM=-lg[Mn+]=3.00,金属离子浓度[Mn+]有效数字位数为3位答案:错8.对于同一组测定数据,置信度越小,置信区间越小。
答案:对9.用分析天平采用减量法称量试样,要使称量误差不大于0.1%,至少要称取试样答案:0.2g10.已知 pH=5.25,则[ H+ ]=5.62×10-6mol•L-1 。
第一章 物质的聚集状态一.选择题( D ) 1、今有0.4000mol ·L -1HCl 溶液1L ,欲将其配制成浓度为0.6000mol ·L -1溶液,需加入1.0000mol ·L -1HCl 多少毫升?A 、200.00mlB 、300.00mlC 、400.00mlD 、500.00ml( B ) 2、5.0 g 某聚合物溶于400 cm 3水中,20℃时的渗透压为100 Pa ,则该聚合物的分子量为A. 4.0 × 106B. 3.0 × 105C. 2.1 × 104D. 3.0 × 102( D ) 3、理想气体状态方程用于真实气体的条件是A. 低温、高压B. 高温、高压C. 低温、低压D. 高温、低压( D ) 4、下列稀溶液,渗透压最小的是A. 0.02 mol ⋅L -1NaCl ;B. 0.02mol ⋅L -1CaCl 2;C . 0.02 mol ⋅L -1HAc ;D. 0.02 mol ⋅L -1葡萄糖。
二.填空题:1、渗透现象所必备的条件是(1) ;(2) 。
半透膜,膜两边存在浓度差2、临床实践中,对患者输液的原则为 ,如常用的生理盐水浓度为 。
等渗溶液、0.9%(W/V) 或0.154 mol/L三.是非判断题(对的打“√ ”错的打“×”)( × )1、盐碱地中的植物不容易存活,甚至枯萎,这主要是土壤溶液的渗透压太小所引起的。
( × )2、可以将低温低压下的真实气体,看成理想气体来处理。
( × )3、在一定的温度下,将相同质量的葡萄糖和蔗糖溶于相同体积的水中,则两溶液的沸点升高和凝固点下降值相同。
四.简答题1、农田施化肥时,化肥的浓度不能过高。
答:化肥浓度过高时,就会造成土壤溶液的浓度大于作物根毛细胞液的浓度.根据渗透压原理,使根毛细胞液中的水分渗透到土壤溶液中去,这样根毛细胞不但吸收不到水分,反而还要失去水分,从而使植物萎蔫,即俗话说的“烧苗”。
1.根据下列酸碱的解离常数,选取适当的酸度是共轭碱来配置PH=4.50和PH=10.00的缓冲溶液,其共轭酸,碱的浓度比应是多少?HAC,NH3·H2O,H2C2O4 ,NaHCO3 ,H3PO4 ,NaAC,NaHPO4,C6H5NH2,NH4cl解:选择HAC和NaAC来配置PH=4.50的缓冲液,共轭酸碱的浓度比可由以下来计算检表得:K aΘ(HAC)=1.8×10-5K bθ(AC-)=Kw/ K aΘ=10-14/(1.85×10-5)=5.6×10-10由PH=14-Pk bθ+lg((C(AC-))/(C(HAC)))可得4.50=14-lg(5.6×10-10)+lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=4/7=1.74选择NH3·H2O和NH4cl来配制PH=10.00的缓冲液,共轭酸碱的浓度比如下K bθ(NH3·H2O)=1.8×10-5PH=14- K bθ(NH3·H2O)+lg(C(NH3·H2O)/C(NH4cl))10=14-lg(1.8×10-5)+ lg(C(NH3·H2O)/C(NH4cl))解得:C(NH3·H2O)/C(NH4cl)=5:12.欲配制250mlPH=5.00的缓冲液,问在125ml,1.0mol·L-1NaAC溶液中应加入多少毫升6.0 mol·L-1溶液?解:由题意得可设还应加入xml,6.0 mol·L-1的HAC溶液检表得K aΘ(HAC)=1.8×10-5PH=Pk aθ(HAC)+ lg((C(AC-))/(C(HAC)))5=-lg(1.8×10-5)+ lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=1.82n(AC-)=0.125×1mol·L-1=0.125mol;n(HAC)=6x×10-3mol0.125/(0.125+x×10-3)/(6x×10-3/(0.125+x×10-3))=0.125/(6x×10-3)解得:x=11.6ml3.计算下列各溶液的PH:(3)20.0ml 0.10 mol·L-1NaOH和20.0ml 0.20 mol·L-1 NH4cl 溶液混合解:由题意的检表可得K b(NH3)θ=1.8×10-5 ;K aθ(NH4+)=Kw/ K b(NH3)θ=10-14/(1.8×10-5 )=5.56×10-10n(OH-)=0.002mol n(NH4+)=0.004molC(NH3·H2O)=0.002/(0.02+0.02)=0.05 mol·L-1C(NH4+)=0.02/(0.02+0.02)=0.05 mol·L-1PH=Pk aθ(NH4+)+lg(C(NH3·H2O)/C(NH4cl))=-lg(5.56×10-10)+0=9.26(5)20.0ml 0.10 mol·L-1Hcl和20.0ml 0.20 mol·L-1NaAC溶液混合混合前:n(H+)=0.002mol n(AC-)=0.0004mol 混合后:C(HAC)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1 C(AC-)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1 PH=Pk aθ(HAC)+lg((C(AC-))/(C(HAC)))检表得:Pk aθ(HAC)=1.8×10-5=-lg(1.8×10-5)+lg(0.05/0.05)=4.74(9)300.0ml 0.5 mol·L-1H3PO4与400.0ml 1.00 mol·L-1 NaOH的混合液n(H3PO4)=0.3×0.5=0.15mol C(OH-)=0.4×1mol=0.4molK aθ(HPO42-)=4.5×10-13混合后:n(Na3PO4)=0.1moln(Na2HPO4)=0.05mol则:n(Na3PO4)/ n(Na2HPO4)=2PH= K aθ(HPO42-)+lg2=-lg(4.5×10-13)+lg2=12.651.今有2.00L的0.5001.00 mol·L-1NH3(aq)和2.0L的0.500mol·L-1 Hcl溶液,若配制PH=9.00的缓冲溶液,不允许再加水,最多能配制多少升缓冲溶液,其中C(NH3),C(NH4+)各为多少?解:由表可知:K b(NH3)θ=1.8×10-5则PH=14- K bθ(NH3·H2O)+ lg(C(NH3·H2O)/C(NH4cl))=9即:PH=14-4.74+ lg(C(NH3·H2O)/C(NH4cl))=9得lg(C(NH3·H2O)/C(NH4cl))=-0.26解得C(NH3·H2O)/C(NH4cl)=0.55设xL NH3·H2O yL HCl则有C(NH3·H2O )=n(NH3·H2O )/V总=0.5(x-y)/(x +y) mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1即C(NH3·H2O )/ C(NH4+)=0.55解得x/y=1.55若要溶液最多,只需令x=2.00L,则y=1.3L此时C(NH3·H2O )=0.5(x-y)/(x+y) mol·L-1=0.11 mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1=0.2 mol·L-12.列表指出下列配合物的形成体、配体、配位原子和形成体的配位数;确定配离子和形成体的配位数;确定配离子和形成体的电荷数,并给出他们的命名。
(1)[Crcl2(H2O)4]cl (3)K2[Co(Ncs)4] (5)[Ptcl2(NH3)2] (7)[Fe(edta)]-(9)Cr(Co)6 (11)[Mn(CN)5]3.计算下列取代反应的标准平衡常数(1)Ag(NH3)2+(aq)+2S2O32-(aq)=Ag(S2O3)22-(aq)+2NH3(aq)(2)Fe(C2O4)33-(aq)+6CN-(aq)=Fe(CN)63-(aq)+3C2O42-(aq) (3)Co(NCS)42-(aq)+4NH3(aq)=Co(NH3)42+(aq)+4NCS-(aq)解:(1)KѲ=C[Ag(S2O3)23-]C2(NH3)/(C[Ag(NH3)2+]C2(S2O32-)) KѲ=K fѲ[Ag(S2O3)23-]/ K fѲC[Ag(NH3)2+]=2.9×1013/(1.67×107)=1.7×10^6(2)KѲ=C([Fe(CN)63-])C3(C2O42-)/(C[Fe(C2O4)33-]C6(CN-)=K fѲ[Fe(CN)63-]/ KfѲ[Fe(C2O4)33-]=4.1×1052/(2.56×1032)=2.56×1032(3) KѲ=C[Co(NH3)42+]C4(NCS-)/(C[Co(NCS)42-]C4(NH3))= K fѲ[Co(NH3)42+]/ K fѲ[Co(NCS)42-]=1.16×105/(103)=1.16×10222.在500.0ml的0.01 mol·L-1 Hg(NO3)2溶液中,加入65.0gkI (s),生成[HgI4]2-。
计算溶液中的Hg2+,H股I2-,I-的浓度解:C(I-)=m/MV=65.0/(1669×0.5)=0.783 (mol·L-1 )查表得K fѲ[HgI42-]=5.66×1029,所以反应进行的很完全Hg2++4I- = [HgI4]2-起始浓度0.01 0.783 0反应后0 0.783-4×0.01 0.01反应完后HgI42-]开始解离,设[HgI42-]解离x mol·L-1后达到平衡HgI42-=Hg++4I-起始浓度0.01 0 0.743平衡0.01-x x 0743+4x1/K fѲ[HgI4]2-=C(Hg)C4(I-)/C([HgI4]2-)=x(0.743+4x)4/(0.01-x)=1/(5.66×1029)解得x=5.8×10-32C(I-)=0.743 C([HgI4]2-)=0.0123.Cr3+与EDTA的发应为Cr3+(aq)+H2Y2-(aq)=CrY-(aq)+2H+在PH=6.00的缓冲溶液中,最初浓度为0.0010 mol·L-1 Cr3+和0.050 mol·L-1 Na2H2Y反应。
计算平衡Cr3+的浓度Cr3+(aq)+ H2Y2-(aq)= CrY-(aq)+ 2H+(aq)起始浓度0.001 0.05 0 1×10-6平衡浓度x 0.05-0.001+x 0.001-x 1×10-6KѲ=C(CrY-)C2(H+)C(Y4-)C(HY3-)/(C(Cr3+)C(H2Y2-)C(Y4-)C(HY3-))=(0.001-x)( 1×10-6)^2/(x(0.049+x))解得x=5.01×10-2125.在25℃时,Ni(NH3)62+溶液中,C(Ni(NH3)62+)为0.1 mol·L-1 C(NH3)=1.0 mol·L-1加入乙二胺(en)后,使开始时C(en)=2.3 mol·L-1。
计算平衡时溶液中Ni(NH3)62+,NH3,Ni(en)32+的浓度解:Ni(NH3)62++ 3en = Ni(en)32+ + 6NH3起始浓度0.1 2.3 0 1平衡浓度x (2.3-0.1×3+3x)0.1-x 1+0.1×6-6xKѲ= K fѲ(Ni(en)22+)/ K fѲ(Ni(NH3)62+)=`C6(NH3)C(Ni(en)32+)/(C(Ni(NH3)62+)C3(en))=(1.6-6x)6(0.1-x)/(x(2+3x))3=2.1×1018/8.97×108x=9×10-11C(Ni(NH3)62+)=9×10-11 mol·L-1(NH3)=1.6 mol·L-1C(Ni (en)32+)=0.11.6 mol·L-13.在化学手册中查到下列各物质的溶解度。