SILAC定量蛋白质组学
- 格式:ppt
- 大小:1.70 MB
- 文档页数:56

在定量蛋白质组学的超酷世界中,有一个叫做SILAC(细胞文化中氨基酸的Stable Isotope Labeling)的游戏变化工具,它类似于研究蛋白质行为方式的秘密剂。
它通过潜入特殊,标签的氨基酸进入细胞的蛋白质组成,有点像卧底间谍。
在质谱学的帮助下,科学家们用普通的,无标签的间谍们来修正这些狡猾的间谍的数量,以便揭开蛋白质是如何变化的,作用有多快,甚至如何在蛋白质被制成后被修改的各种秘密。
这个技术被用来揭开从细胞如何相互交谈,如何决定自己长大后想要成为什么,甚至如何在疾病中无赖。
这就像解锁一个超级酷,蛋白质谜充满惊喜!
SILAC 定量蛋白质组学在研究细胞如何在小气泡中移动东西方面起到了超级的作用。
这个过程,叫做维辛运输,对于把蛋白质和脂质带到细胞中需要去的地方来说,是极为重要的。
使用SILAC,科学家可以测量蛋白质水平和周转量的变化,当它们与流体运输路径相混淆时。
这能帮助他们弄清楚这一切是如何运作的。
SILAC的研究发现了控制冰球交通的老板分子,展示了冰球的移动方式,并解释了蛋白质的微小变化会如何影响冰球的形成和与细胞其他部分的结合。
SILAC定量蛋白质组学的实施使我们在理解细胞内病毒运输的复杂过程方面取得了显著进展。
这种方法可以精确地测量蛋白质丰度和周转量的变化,从而发现以前未识别的调节器和车辆运输路径效应器。
SILAC在数量上评估遗传或药理学干预对车辆运输的影响的能力,在加深我们对这一基本细胞机制的了解方面发挥了关键作用。
随着定量
蛋白质组学领域继续取得进展,很明显,SILAC仍将是调查不同生物背景的蛋白质动力学和调控机制的不可或缺的技术。



SILAC(定量蛋白质组学)技术原理
作为蛋白质组学研究中一种强有力的工具,质谱在过去很长一段时间内只是用于定性研究,鉴定蛋白质和**后修饰。
于是,科学家们不断开发出定量蛋白质组学方法,来了解细胞、组织或生物体的整体蛋白质动力学。
早期的蛋白质研究致力于鉴定并了解单个蛋白或蛋白复合物的功能,这些年,仪器和技术的进步大大促进了蛋白质组学研究。
这种蛋白质组学的研究,与当今热门的基因组、转录组和代谢组等领域的研究一起,让我们更好地了解了整体的生物过程,以及它们如何应对不同刺激,或在**状态下如何改变。
若想了解一个人患病之后,基因表达水平发生了怎样的改变,DNA芯片是一个常见的选择。
然而DNA 芯片也许并没有说出全部,因为基因表达的差异并不直接对应着蛋白表达的差异。
为了更准确地比较两个样本的蛋白水平,科学家们通常使用双向电泳外加质谱,然而流程复杂,通量低,重复性也欠佳。
为什么不能定量?因为各次运行之间,水解后的肽段在理化性质上表现出很大差异,从而导致质谱响应的变化。
此外,质谱只能对样品中的一部分肽段进行分析。
定量蛋白质组学又分为相对定量和定量。
相对定量方法(如SILAC、ICAT、ICPL等)是用来比较样品之间的蛋白或肽段丰度;而在未标记的样品中加标有已知浓度的同位素标记的合成肽段,就实现了目标肽段的定量。
显然,定量比相对定量更为理想,因为不同样品的肽段值也可用于比较相对蛋白变化。
然而,相对定量却更为常用,因为每个目的蛋白的定量都需要昂贵的试剂,也需要花费大量的时间来开发分析。
在相对定量方法中,SILAC又是比较常用的一种。

非靶向蛋白组学定量技术: SILAC, iTRAQ, TMT定量蛋白组学的研究意义人类基因组完整图谱于2003年正式公布,这标志着生命科学的里程碑性事件——人类基因组计划的顺利完成,生命科学研究也进入了后基因组时代。
这一计划的初始目的是在基因层面研究人类疾病机制,设计基因药物,进行精准医疗。
但是时隔十多年年过去了,效果远没预期的理想。
其中主要原因可能是,我们现有的研究工作和背景知识不足以将庞杂的基因组数据直接同人类疾病联系起来。
而蛋白组学能更直观的将基因与疾病联系起来,逐渐成为研究热点之一。
定量蛋白组学是将某一基因组或者某一复杂体系表达的全部蛋白质进行鉴定和精准定量的学科,是蛋白组学研究的重要分支。
基于质谱的蛋白质定量20实际80年代中期出现了MALDI(基质辅助激光解吸附电离)和ESI(电喷雾电离)两种软电离方法,可以将蛋白质或者多肽离子化,从而引入质谱仪种进行定性和定量分析,从此生物质谱技术成为蛋白组学最重要的分析工具之一。
图1. 生物质谱仪器。
利用生物质谱技术,主要有两种蛋白组学研究策略:Top-down strategy:Top-down(自上而下法)通常的做法是,先利用二维凝胶电泳分离蛋白,再将完整蛋白直接离子化后引入质谱分析,借助生信分析工具和蛋白数据库进行数据比对,从而实现对蛋白的鉴定。
Bottom-up strategy:Bottom-up(自下而上法)通常的做法是,先将样品用酶进行处理,多维色谱分离后引入质谱分析,再借助生信分析工具和蛋白数据库进行数据比对,最后实现对蛋白的鉴定。
蛋白定量分为相对定量和绝对定量,由于电泳技术具有重复性差等缺点,而多维色谱能将样品酶解物稳定分离,因此蛋白的绝对定量多采用自下而上的方法。
虽然绝对定量似乎更为理想,但是绝对定量更为复杂和昂贵,而相对定量在很多时候就能满足科研需求,因此,相对定量更为常用。
利于质谱技术,可根据特定质谱峰的信号强度来确定蛋白质含量,主要的方法又分为非靶向定量蛋白组学(标记定量和非标记定量)和靶向定量蛋白组学。

定量蛋白质组学的方法有哪些?1 背景和意义从生命活动的直接执行者——蛋白质的角度研究生命现象和规律(特别是疾病防治和病理研究)已成为研究生命科学的主要手段。
而这些研究往往离不开对细胞、组织或器官中含有蛋白质种类和表达量的研究。
对处不同时期、不同条件下蛋白质表达水平变化的研究,识别功能模块和路径,监控疾病的生物标志物,这些研究都需要对蛋白质进行鉴定和定量。
生物质谱技术的出现和不断成熟为蛋白质差异表达分析提供了更可靠、动态范围更广的研究手段。
基于质谱技术,科学家们不断开发出新的定量蛋白质组学方法,来了解细胞、组织或生物体的整体蛋白质动力学。
2 方法学介绍目前较主流的定量蛋白质组学方法有5种,分别是Label-free、iTRAQ、SILAC、MRM(MRM HR)、和SW ATH。
简述如下:2.1 Label-freeLabel-free定量,即非标记的定量蛋白质组学,不需要对比较样本做特定标记处理,只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。
Label-free操作简单,可以做任意样本的总蛋白质差异定量,但对实验操作的稳定性、重复性要求较高,准确性也较标记定量差。
因此,Label-free技术适合于大样本量的定量比较,以及对无法用标记定量实现的实验设计。
2.2 iTRAQiTRAQ定量是目前定量蛋白质组学应用很广泛的技术,该技术的核心原理是多肽标记和定量,将多肽的含量转化为114、115、116和117同位素的含量(或113、114、115、116、117、118、119和121的8标记),从而简化了定量的复杂性,最终通过多肽定量值回归到蛋白的定量值,从而最终测定出不同样本之间蛋白质的差异。
iTRAQ定量不依赖样本,可检测出较低丰度蛋白,胞浆蛋白、膜蛋白、核蛋白、胞外蛋白等,且定量准确,可同时对8个样本进行分析,并可同时得出鉴定和定量的结果,特别适用于采用多种处理方式或来自多个处理时间的样本的差异蛋白分析。

silac定量蛋白质组学摘要:I.介绍- 蛋白质组学- silac 定量蛋白质组学技术II.silac 技术的基本原理- 稳定同位素标记- 细胞培养条件下的应用III.silac 技术的应用- 蛋白质定量- 蛋白质组差异分析IV.silac 技术的优缺点- 优点- 高精度- 高效率- 缺点- 成本较高- 技术复杂V.总结- silac 技术的意义- 展望未来正文:I.介绍蛋白质组学是研究细胞或组织中所有蛋白质组成、表达和功能的一门科学。
近年来,随着蛋白质组学技术的不断发展,越来越多的研究者开始关注于定量蛋白质组学。
其中,silac 定量蛋白质组学技术是一种广泛应用的方法。
II.silac 技术的基本原理Silac,全称为“稳定同位素标记氨基酸在细胞培养条件下的应用”,是一种基于稳定同位素标记技术的定量蛋白质组学分析方法。
在这种方法中,研究人员首先将细胞培养在含有稳定同位素标记氨基酸的培养基中。
这些标记氨基酸会参与到蛋白质的合成过程中,从而使得蛋白质中带有标记。
随后,研究人员通过质谱分析,对带有标记的蛋白质进行定量分析。
III.silac 技术的应用Silac 技术广泛应用于蛋白质定量、蛋白质组差异分析等领域。
通过这种技术,研究者可以在同一实验条件下,对不同样本中的蛋白质进行精确定量,从而揭示蛋白质表达的差异。
此外,silac 技术还可以应用于蛋白质翻译后修饰的研究,以及对蛋白质表达调控机制的探究。
IV.silac 技术的优缺点Silac 技术具有较高的精度和效率,可以在短时间内得到大量蛋白质的信息。
然而,这种技术的成本较高,且技术复杂,需要专门的设备和技术支持。
此外,silac 技术还存在一定的局限性,例如,某些特殊类型的蛋白质(如糖基化蛋白质)在silac 技术中难以定量。
V.总结总的来说,silac 技术为定量蛋白质组学提供了有力的工具。

蛋白质组学定量分析的方法蛋白质组学定量分析是对细胞或组织中的蛋白质进行定量分析的一种方法。
它是研究蛋白质组学的重要手段之一,可以揭示蛋白质的表达差异、功能变化以及相关的生物学过程和疾病机制。
目前,蛋白质组学定量分析的方法主要包括质谱定量法和定量免疫学方法。
质谱定量法是蛋白质组学定量分析的主要方法之一。
它基于质谱技术和同位素标记原理,使用质谱仪对样品中的蛋白质进行定量分析。
目前常用的质谱定量方法包括多重反应监测(MRM)、定量蛋白质鉴定(iTRAQ)和标记蛋白质鉴定(TMT)等。
多重反应监测(MRM)是一种常用的质谱定量分析方法。
它利用质谱仪中的三重四极杆(triple quadrupole)进行分析。
首先,确定待测蛋白质的肽段序列,然后合成同位素标记的肽段标准品作为内标。
接下来,使用质谱仪对待测蛋白质和内标进行质谱分析,测量待测蛋白质和内标的特定肽段的质荷比和峰面积。
最后,通过内标的峰面积和待测蛋白质的峰面积进行定量计算,得到待测蛋白质的表达量。
定量蛋白质鉴定(iTRAQ)是一种基于同位素标记的质谱定量方法。
在iTRAQ 实验中,待测组织或细胞培养基中的蛋白质经过胰蛋白酶消化后,将消化产物用不同的同位素标记。
这些标记反应产物有不同的质量,通过质谱分析可以得到有关各组分的数量比。
通过比较标记反应产物的相对丰度,可以定量分析待测蛋白质的表达差异。
标记蛋白质鉴定(TMT)是一种与iTRAQ类似的同位素标记质谱定量方法。
TMT 实验中,多个待测样品用不同的同位素标记,然后将这些样品混合在一起通过液相色谱-串联质谱(LC-MS/MS)进行分析。
通过质谱分析可以得到不同样品中蛋白质的相对表达量和差异表达蛋白质的鉴定。
定量免疫学方法也是蛋白质组学定量分析的重要方法之一。
相比于质谱定量法,定量免疫学方法具有高灵敏度、高特异性和高通量等优点。
常用的定量免疫学方法包括酶联免疫吸附实验(ELISA)、西方印迹(Western blotting)和流式细胞术(flow cytometry)等。


SILAC蛋白组
SILAC蛋白组或SILAC定量蛋白组学,是指利用SILAC技术对蛋白质组进行定量研究。
百泰派克生物科技提供基于SILAC标记的定量蛋白组分析服务。
SILAC
在基于质谱(MS)的定量蛋白质组学中,SILAC(Stable Isotope Labeling By Amino Acids In Cell Culture)是通过在细胞培养过程中加入稳定同位素标记的
氨基酸对样品进行标记后结合质谱检测,对样品进行蛋白质组学分析的方式是一种简单、可靠而又强大的方法。
SILAC通过正常代谢过程对细胞蛋白进行标记,在新
合成的蛋白质中加入非放射性的、稳定的含同位素的氨基酸。
SILAC提供了准确的
相对定量,不需要任何化学衍生或操作,即可实现蛋白质组学分析。
SILAC属于体
内标记技术,使样品更接近自然状态,其标记效率高达100%,且标记效果稳定,
适合于全细胞蛋白分析,以及膜蛋白的鉴定和定量,每个样本只需要几十微克的蛋白量。
SILAC蛋白组分析
SILAC定量蛋白组分析的实验流程是:在细胞培养基中加入轻、中或重型稳定同位
素标记的必需氨基酸赖氨酸(Lys)和精氨酸(Arg),在细胞生长过程中,新合成的蛋白质带上稳定同位素标签。
培养一段时间后,等量混合细胞培养物中各类型蛋白质,酶解后进行质谱分析。
由于质量差异,可以在质谱仪中区分带有不同稳定同位素组成的化学性质相同的肽对。
通过比较一级质谱图中不带标记和带同位素标记的质谱峰型的面积大小即可进行相对定量,同时二级谱图还可以对肽段进行序列测定从而进行蛋白鉴定。
SILAC蛋白组。
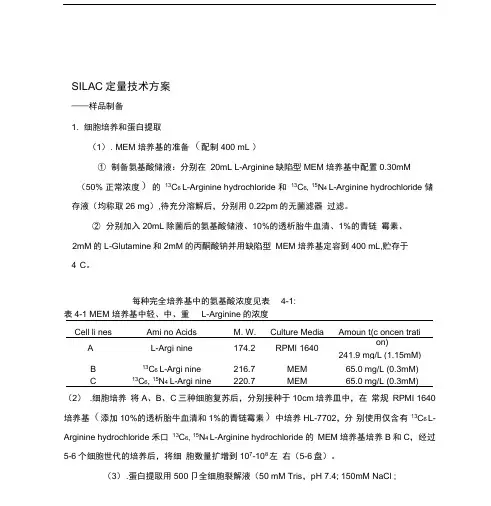
SILAC定量技术方案——样品制备1. 细胞培养和蛋白提取(1). MEM培养基的准备(配制400 mL )①制备氨基酸储液:分别在20mL L-Arginine缺陷型MEM培养基中配置0.30mM(50% 正常浓度)的13C6 L-Arginine hydrochloride 和13C6, 15N4 L-Arginine hydrochloride 储存液(均称取26 mg),待充分溶解后,分别用0.22pm的无菌滤器过滤。
②分别加入20mL除菌后的氨基酸储液、10%的透析胎牛血清、1%的青链霉素、2mM的L-Glutamine和2mM的丙酮酸钠并用缺陷型MEM培养基定容到400 mL,贮存于4°C。
每种完全培养基中的氨基酸浓度见表4-1:表4-1 MEM 培养基中轻、中、重L-Arginine的浓度(2).细胞培养将A、B、C三种细胞复苏后,分别接种于10cm培养皿中,在常规RPMI 1640培养基(添加10%的透析胎牛血清和1%的青链霉素)中培养HL-7702,分别使用仅含有13C6 L-Arginine hydrochloride 禾口13C6, 15N4 L-Arginine hydrochloride 的MEM培养基培养B和C,经过5-6个细胞世代的培养后,将细胞数量扩增到107-108左右(5-6盘)。
(3).蛋白提取用500卩全细胞裂解液(50 mM Tris,pH 7.4; 150mM NaCl ;1%Triton-100 ; 1mM AEBSF ; 20 卩1/ 卩g apro ;n20 p 1/ 卩g leupeptin)2. 蛋白质含量测定(1) . 采用改进的Bradford 法,将BSA 分别稀释为从0-1.40mg/ml 范围内若干浓度,待测样品稀释10 倍、20倍,各取20 丄加80 让0.12M HCl ,轻轻混匀。
(2) . 各管再加入3.5ml 过滤的稀释4 倍的dye reage nt 轻轻混匀,静置5min 后测A595 值。
SILAC(Stable Isotope Labeling by Amino acids in Cell culture)是一种定量蛋白质组学方法,利用稳定同位素标记氨基酸在细胞培养中进行蛋白质定量研究。
以下是SILAC定量蛋白质组学的基本原理和步骤:
1. 原理:
-SILAC利用稳定同位素标记前体氨基酸替代细胞培养基中的天然氨基酸。
-在不同条件下,分别使用含有正常氨基酸和稳定同位素标记的氨基酸的培养基培养细胞。
-标记的氨基酸会在细胞内代谢成稳定同位素标记的蛋白质。
2. 实验步骤:
-细胞培养:将细胞分成两组,一组在正常氨基酸培养基中培养,另一组在稳定同位素标记的氨基酸培养基中培养。
-细胞提取:收集培养的细胞,并提取蛋白质。
-混合和消化:将两组样品的蛋白质混合,并进行消化,一般使用胰蛋白酶将蛋白质消化成肽段。
-肽段分离:使用液相色谱等技术分离肽段。
-质谱分析:使用质谱仪进行肽段的定性和定量分析。
3. 数据分析:
-利用质谱数据分析软件对得到的质谱数据进行解析和比较。
-通过计算同位素标记和未标记肽段的峰面积比例或峰高比例,实现不同样品中蛋白质的定量比较。
-根据定量结果,进一步分析差异表达蛋白质在功能和通路上的富集和变化。
SILAC定量蛋白质组学方法具有高准确性和灵敏度,适用于研究细胞生物学、疾病研究和药物筛选等领域。
它可以提供关于差异表达蛋白质的定量信息,促进对蛋白质功能和分子机制的深入理解。
SILAC定量技术方案一样品制备1。
细胞培养和蛋白提取(1). MEM培养基的准备(配制400 mL)①制备氨基酸储液:分别在20mL L-Arginine缺陷型MEM培养基中配置0。
30mM(50%正常浓度)的13C6 L-Arginine hydrochloride和13C6,15N4 L—Arginine hydrochloride储存液(均称取26 mg),待充分溶解后,分别用0.22μm的无菌滤器过滤.②分别加入20mL除菌后的氨基酸储液、10%的透析胎牛血清、1%的青链霉素、2mM的L-Glutamine和2mM的丙酮酸钠并用缺陷型MEM培养基定容到400 mL,贮存于4°C。
每种完全培养基中的氨基酸浓度见表4-1:表4-1 MEM培养基中轻、中、重L-Arginine的浓度Cell lines Amino AcidsM.W。
Culture MediaAmount(concentration)A L-Arginine 174。
2 RPMI 1640 241。
9 mg/L (1.15mM)B 13C6 L—Arginine 216。
7 MEM 65.0 mg/L (0。
3mM)C 13C6,15N4 L—Arginine 220。
7 MEM 65.0mg/L(0.3mM)(2)。
细胞培养将A、B、C三种细胞复苏后,分别接种于10cm培养皿中,在常规RPMI 1640培养基(添加10%的透析胎牛血清和1%的青链霉素)中培养HL—7702,分别使用仅含有13C6 L-Arginine hydrochloride和13C6, 15N4 L-Arginine hydrochloride 的MEM培养基培养B和C,经过5-6个细胞世代的培养后,将细胞数量扩增到107—108左右(5—6盘)。
(3). 蛋白提取用500 μl全细胞裂解液(50 mM Tris,pH 7。
4;150mM NaCl;1%Triton-100;1mM AEBSF;20 μl/μg aprotinin;20μl/μg leupeptin)2。
silac定量蛋白质组学【原创版】目录1.SILAC 定量蛋白质组学技术简介2.SILAC 技术的标记方法3.SILAC 技术的应用优势4.SILAC 技术的局限性5.SILAC 技术的未来发展方向正文一、SILAC 定量蛋白质组学技术简介SILAC(Stable Isotope Labeling by Amino Acids in Cell Culture)定量蛋白质组学技术是一种用于蛋白质组学研究的稳定同位素标记技术。
该技术通过在细胞培养过程中使用标记氨基酸,实现对蛋白质的定量分析。
这种方法可以有效地区分不同蛋白质之间的差异,为研究蛋白质功能和调控机制提供有力手段。
二、SILAC 技术的标记方法最初,SILAC 技术使用的标记氨基酸是氚代甲硫氨酸和氘代甘氨酸。
随着技术的发展,现在常用的标记氨基酸有稳定性更好的同位素标记氨基酸,如 13C-赖氨酸、15N-赖氨酸等。
这些标记氨基酸在细胞培养过程中被蛋白质吸收,使得蛋白质中含有稳定同位素,从而实现蛋白质的定量分析。
三、SILAC 技术的应用优势1.高精度:SILAC 技术通过使用稳定同位素标记氨基酸,可以实现对蛋白质的精确定量,误差控制在 10% 以内。
2.高灵敏度:SILAC 技术具有较高的灵敏度,可以检测到低丰度蛋白质,为研究蛋白质功能提供更多信息。
3.可重复性:SILAC 技术在不同实验条件下具有较好的可重复性,可以为蛋白质组学研究提供可靠的数据支持。
4.广泛适用性:SILAC 技术可应用于不同类型的细胞和生物体系,为研究不同生物体系中蛋白质功能和调控机制提供有力手段。
四、SILAC 技术的局限性1.标记氨基酸的选择有限:目前常用的标记氨基酸有限,可能会影响某些特定蛋白质的定量分析。
2.实验操作较为复杂:SILAC 技术需要对细胞进行培养,并在培养过程中添加标记氨基酸,操作较为繁琐。
3.数据处理较为复杂:SILAC 技术需要对质谱数据进行同位素标记氨基酸的扣除,数据处理较为复杂。
一、SILAC概述SILAC即细胞培养条件下稳定同位素标记技术(Stable isotope labeling with amino acids in cell culture,SILAC),其基本原理是分别采用含有轻、中或重型同位素必需氨基酸的培养基培养细胞(用于SILAC的稳定同位素氨基酸主要有Lys和Arg),新合成的蛋白质即嵌合了同位素氨基酸,如此培养5-6代后,细胞的所有蛋白质均被同位素标记上。
经处理因素刺激后,等量混合各类型蛋白质,然后经SDS-PAGE分离和质谱分析,通过比较一级质谱图中同位素峰型的面积大小进行相对定量,同时二级谱图对肽段进行序列测定从而鉴定蛋白质。
由于SILAC标记技术是体内标记技术,几乎不影响细胞的功能,同时灵敏度高,因此其在蛋白质组学相关领域中得到了广泛的应用,如比较蛋白质组学,蛋白质与蛋白质相互作用,蛋白质与DNA相互作用,蛋白质与RNA相互作用等领域。
二、与体外标记技术相比,SILAC属于体内标记,具有以下技术优势1、高通量,可同时鉴定并定量数百至数千种蛋白质;2、定量精确,降低由于样品制备不同而造成的实验差异;3、线性定量范围广;4、灵敏度更高,蛋白质需要量明显减少;5、标记采用的是体内标记技术,更接近样品真实状态。
三、SILAC技术服务流程图1:SILAC技术服务流程。
1、标记:在缺乏Lys和Arg的培养基中添加同位素型Lys(D4或13C6 15N4)、Arg(13C6或13C6 15N4)等培养细胞,使蛋白质被标记成“中型”或“重型”;2、细胞处理,如药物处理;3、细胞裂解、提取蛋白质;4、等量混合对照组与处理组蛋白质、SDS-PAGE电泳分离、染色;5、割取蛋白质条带,胰蛋白酶消化,LC-MS/MS质谱分析。
四、SILAC技术服务内容1、细胞同位素标记;(本公司出售L、M和H型同位素Lys和Arg)2、样本制备与定量;3、SDS-PAGE分离;4、胰酶酶切后液相分离和质谱分析;5、数据库检索及蛋白质定量分析;6、差异蛋白的生物信息学分析7、实验报告提交。