日本TOSOH AIA东曹化学发光产品说明
- 格式:pdf
- 大小:2.75 MB
- 文档页数:56

保证全自动免疫发光分析仪正确使用。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【简介】(一) 仪器厂家介绍仪器的生产者:TOSOH HI-TEC,INC.(东曹株式会社)地址:日本国东京都港区芝3-8-2芝公园フアースト大楼邮政编码:105-8623电话:(03)5427-5181传真:(03)5427-5220山口県工厂地:山口県周南市福川南町1-37邮政编码:746-0042411-0932电话:(0834)62-1588传真:(0834)62-1377(二) 仪器使用环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V 50/60Hz。
(三) 仪器基本规格结构:仪器通过RS-232C将分析仪AIA-2000与控制计算机连接,通过控制器发出的指令进行测定的机构。
控制器通过RS-232C与控制主计算机连接,可以进行检查项目的接收、测定结果的发送等。
耗电量:AC100~240V、50/60Hz、700V A(电脑打印机除外)尺寸:1500(W)×907(D)×1260(H) mm重量:约400 kg操作人员部门主管质量负责人姓名****** ****** ****** 日期**年**月** 日保证全自动免疫发光分析仪测定结果的准确性。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【校准方法】(一) 仪器校准环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V、50/60Hz(二)操作步骤与要求1、样品堵塞检测功能的检验用主臂和混合臂进行检验。
2、液位检测功能的检验主臂混合臂温控功能的检验基质液分注功能的检验(Left・Right)取样量的检验(主臂)取样量检验(混合臂)检测器的校准(注:以后的检验,采用产品的传感部件(拾音器块)实施)(注:检测器的调试应完成)(三)记录与核对标准1.将测出的各项结果记录并计算。

化学发光法说明书化学发光法说明书一、引言化学发光法是一种常用的分析技术,它通过特定的化学反应产生发光现象,并利用测量发光强度来确定待测物质的浓度。
本说明书将介绍化学发光法的原理、实验步骤、仪器设备及应用领域。
二、原理化学发光法的原理基于化学反应产生发光的特性。
当特定的化学物质与待测物质发生反应时,会产生激发态的化学物种。
随后,激发态的化学物种会通过辐射或非辐射的方式回到基态,释放出能量并产生光。
通过测量发光强度,可以间接推测出待测物质的浓度。
三、实验步骤1. 准备样品:将待测物质制备成合适的浓度,并与特定的试剂混合。
2. 反应:在适当的条件下,使待测物质与试剂发生化学反应,产生发光。
3. 测量:利用发光仪器测量发光强度,并记录下来。
4. 构建标准曲线:根据已知浓度的标准样品的发光强度,绘制标准曲线。
5. 计算待测物质浓度:通过待测样品的发光强度,在标准曲线上找到对应的浓度值,并计算待测物质的浓度。
四、仪器设备化学发光法的实验需要使用特定的仪器设备,主要包括:1. 发光仪:用于测量样品的发光强度。
2. 标准样品:已知浓度的样品,用于构建标准曲线。
3. 试剂:与待测物质发生反应,产生发光的化学试剂。
4. 试管或微孔板:用于混合样品和试剂,进行反应。
五、应用领域化学发光法广泛应用于许多领域,包括:1. 生物医学研究:用于检测生物标志物、药物浓度等。
2. 环境监测:用于测定水中重金属、有机物等的浓度。
3. 食品安全:用于检测食品中的农药残留、添加剂等。
4. 公共安全:用于检测爆炸物、毒品等危险物质。
六、实验注意事项1. 实验操作要规范,遵守实验室安全规定。
2. 样品和试剂要保持干净和干燥,避免受到外界污染。
3. 仪器设备要正确校准,确保测量结果准确可靠。
4. 实验过程中要注意控制反应条件,如温度、pH值等。
5. 标准曲线的制备要精确可靠,避免误差产生。
七、总结化学发光法作为一种敏感、快速和准确的分析方法,在科学研究和实际应用中具有重要的地位。
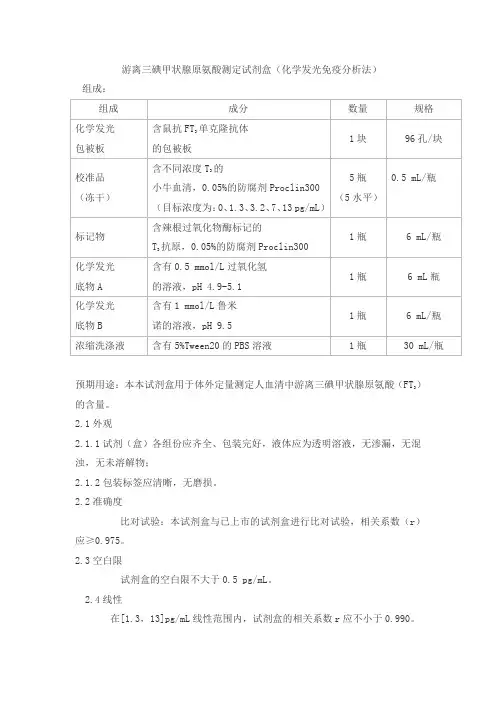
游离三碘甲状腺原氨酸测定试剂盒(化学发光免疫分析法)
组成:
)预期用途:本本试剂盒用于体外定量测定人血清中游离三碘甲状腺原氨酸(FT
3的含量。
2.1外观
2.1.1试剂(盒)各组份应齐全、包装完好,液体应为透明溶液,无渗漏,无混浊,无未溶解物;
2.1.2包装标签应清晰,无磨损。
2.2准确度
比对试验:本试剂盒与已上市的试剂盒进行比对试验,相关系数(r)应≥0.975。
2.3空白限
试剂盒的空白限不大于0.5 pg/mL。
2.4线性
在[1.3,13]pg/mL线性范围内,试剂盒的相关系数r应不小于0.990。
2.5重复性
测高、低浓度样本,批内变异系数(CV)应不大于15.0%。
2.6批间差
用三个批次产品测样本,批间变异系数(CV)应不大于20.0%。
2.7稳定性
2℃~8℃保存,有效期12个月。
取失效期的试剂盒检测其准确度、空白限、线性和重复性,应符合2.2~2.5的要求。
2.8 校准品溯源性
应根据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定,提供所用企业产品校准品来源、赋值过程以及测量不确定度等内容,校准品溯源至企业工作校准品,工作校准品与已上市产品比对赋值。

化学发光hcv试剂说明书化学发光HCV试剂说明书第一部分:产品介绍1.1 产品名称:化学发光HCV试剂1.2 产品编号:HCV1-20211.3 适用范围:本试剂适用于检测人类乙型肝炎病毒(HCV)感染的血清或血浆样本。
1.4 检测原理:本试剂采用化学发光技术,利用一种特定的发光底物和酶标抗体反应,产生发光信号,用于HCV抗体的检测。
1.5 环境要求:试剂应在2-8°C冷藏保存,避免暴露在光线直射下,避免反复冻融。
1.6 有效期:本试剂有效期为生产日期后12个月。
第二部分:试剂组成2.1 试剂盒配置本试剂盒包含以下试剂:- 试剂A:包含特定的抗原液,用于与待测样本中的HCV抗体结合。
- 试剂B:包含辣根过氧化物酶(HRP)偶联的检测抗体,用于与HCV抗体结合的复合物与底物发生反应产生发光。
- 洗涤缓冲液:用于洗涤微孔板中的非特定结合物。
- 底物液:一种特定的发光底物,在HRP反应催化下发光。
- 停止液:可用于停止发光反应。
2.2 试剂储存- 试剂A、试剂B、洗涤缓冲液:储存在2-8°C冷藏条件下。
- 底物液、停止液:室温储存。
第三部分:试剂使用步骤3.1 实验准备- 取出所需试剂并根据试剂使用说明预先配制。
- 预热微孔板洗涤器至37°C。
- 将未开封的试剂储存在2-8°C冷藏条件下。
3.2 样本处理- 取出待测样本,将样本离心10分钟以去除悬浮的颗粒物。
- 将样本稀释至适当浓度,根据试剂说明书中的建议稀释比例进行稀释。
3.3 试剂处理- 取出所需试剂和微孔板,按照试剂使用说明书中的建议加入试剂至微孔板孔中。
- 使用洗涤缓冲液进行洗涤,移除非特异结合物。
- 加入底物液进行发光反应,停止液可选用。
3.4 发光检测- 将微孔板放入合适的发光仪中,根据仪器说明书检测发光强度。
- 检测结果可根据试剂盒提供的标准曲线进行计算。
第四部分:结果解读4.1 阳性结果- 当待测样本中存在HCV抗体时,样本中的HCV抗体会与试剂中的抗原结合,形成抗原-抗体复合物。

保证全自动免疫发光分析仪正确使用。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【简介】(一) 仪器厂家介绍仪器的生产者:TOSOH HI-TEC,INC.(东曹株式会社)地址:日本国东京都港区芝3-8-2芝公园フアースト大楼邮政编码:105-8623电话:(03)5427-5181传真:(03)5427-5220山口県工厂地:山口県周南市福川南町1-37邮政编码:746-0042411-0932电话:(0834)62-1588传真:(0834)62-1377(二) 仪器使用环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V 50/60Hz。
(三) 仪器基本规格结构:仪器通过RS-232C将分析仪AIA-2000与控制计算机连接,通过控制器发出的指令进行测定的机构。
控制器通过RS-232C与控制主计算机连接,可以进行检查项目的接收、测定结果的发送等。
耗电量:AC100~240V、50/60Hz、700V A(电脑打印机除外)尺寸:1500(W)×907(D)×1260(H) mm重量:约400 kg操作人员部门主管质量负责人姓名****** ****** ****** 日期**年**月** 日保证全自动免疫发光分析仪测定结果的准确性。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【校准方法】(一) 仪器校准环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V、50/60Hz(二)操作步骤与要求1、样品堵塞检测功能的检验用主臂和混合臂进行检验。
2、液位检测功能的检验主臂混合臂温控功能的检验基质液分注功能的检验(Left・Right)取样量的检验(主臂)取样量检验(混合臂)检测器的校准(注:以后的检验,采用产品的传感部件(拾音器块)实施)(注:检测器的调试应完成)(三)记录与核对标准1.将测出的各项结果记录并计算。

保证全自动免疫发光分析仪正确使用。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【简介】(一) 仪器厂家介绍仪器的生产者:TOSOH HI-TEC,INC.(东曹株式会社)地址:日本国东京都港区芝3-8-2芝公园フアースト大楼邮政编码:105-8623电话:(03)5427-5181传真:(03)5427-5220山口県工厂地:山口県周南市福川南町1-37邮政编码:746-0042411-0932电话:(0834)62-1588传真:(0834)62-1377(二) 仪器使用环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V 50/60Hz。
(三) 仪器基本规格结构:控制、分析一体机。
耗电量:AC100~240V、50/60Hz250V A尺寸:400(W)×400(D)×520(H)mm重量:约29kg操作人员部门主管质量负责人姓名日期年月日保证全自动免疫发光分析仪测定结果的准确性。
【适用仪器范围】全自动免疫发光分析仪。
【该SOP变动程序】本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、质控主管、科主任。
【校准方法】(一) 仪器校准环境要求室温:15~30℃。
湿度:40%~80%。
电源电压:AC100~240V、50/60Hz(二)操作步骤与要求8)液面检测功能检查接着下面的清洗水吸引功能检查(三)记录与核对标准1.将测出的各项结果记录并计算。
2.检查精密度是否达到使用说明书上所示的精密度,如达到,继续下一步;否则,停止校准,与维修人员联系。
3.计算结果与校准标准进行比较。
4.书写和保存评价报告,交科室存档。
操作人员部门主管质量负责人姓名日期年月日用于AIA360全自动免疫发光分析仪的标准操作程序。

日本东曹(TOSOH)全自动化学发光免疫分析仪AIA360技术参数
AIA360外观图
主要技术参数:
(一)、仪器部分
处理能力36测试项目/小时
试剂位25个
样品位25个
同时最大测试量25个
同一样本可一次检测4个项目
条形码扫描功能
试剂识别功能
样本液面的探测功能
样品堵塞检测功能
全连续、随机处理功能
软件升级功能
外部数据的输出功能
(二)、试剂部分
全球唯一免疫冻干试剂,一次定标,三月有效,试剂有效期达一年;
试剂杯、样品杯、反应杯三杯合一,有效减少耗材量及使用成本;
TOP-TOP(杯口-杯底)检测方式,双波长检测,提高检测精确度;
20分钟出结果,反应链短,无交叉污染;
无试剂加样装置,故障率极低;
可测试项目:
肿瘤标志物:
⏹CEA AFP CA19-9 CA125 CA15-3 PAP TPSA FPSA
甲状腺激素:
⏹TSH T3 T4 FT3 FT4TU TPOAb TgAb TRAb
性腺激素:
⏹LH FSH E2 PROG TES PRL HCG βHCG
糖尿病:
⏹IRI C-peptide
心脏关联标志物:
⏹CKMB MYO cTnI
传染病:
⏹HBsAg HBsAb HBeAg HBcAb HBeAb
其它:
⏹Feritin B12 Folate β2MG HGH IgE CORT。


宁城县中蒙医院赤峰市精神病防治院检验科CLinLab.NCXZMYY(CFSJSBFZY)甲状腺刺激激素(TSH)标准操作程序编号:日期:版本:第页共页甲状腺刺激激素(TSH)标准操作程序编写者审核者批准者批准日期复审日期保管者赤峰市精神病防治院检验科CLinLab.NCXZMYY(CFSJSBFZY)甲状腺刺激激素(TSH)标准操作程序编号:日期:版本:第页共页1、变动程序:由操作者提出,并经科主任审核。
2、范围:测定人血清、血浆、体液中的甲状腺刺激激素TSH。
3、操作程序:使用仪器:日本东曹AIA-600II型全自动化学发光免疫分析仪生产厂商名称:日本东曹株式会社注册号:国食药监械(进)字2007第2400371号3.1、测定原理:检测中使用的是两种高亲合性抗TSH抗体,并采用一步EIA夹心法。
检测TSH浓度对判定视床下部-下垂体-甲状腺体系的机能是有效的。
一般来说,TSH浓度在甲状腺机能亢进的患者样本中较低,而在原发性甲状腺机能低下症的样本中较高。
另外,在二次性及三次性甲状腺机能低下症中TSH浓度都比较低,因此通过TRH试验查看TSH反应,可以鉴别上述疾病。
3.2、试剂:E-test(TOSOH)Ⅱ(TSH)免疫反应试剂3.3 操作步骤3.3.1、在试剂Cup中加入50微升缓冲液和100微升标准品或稀释后的样品溶液,在磁石磁珠振动器上搅拌,在37℃下使抗原抗体反应进行10分钟。
3.3.2、用洗脱液冲洗试剂Cup,除去其中游离的酶联标记抗体和样品成分(B·F分离)。
3.3.3、加入基质液后,在磁石磁珠振动器上搅拌同时用荧光检测器检测荧光物质的荧光强度,激发波长363nm,荧光吸收波长447nm,并计算出荧光物质的生成速度。
3.3.4、根据标准液检测绘制的荧光物质生成速度标准曲线,计算出样品中TSH的浓度。
3.3.5、如果检测结果超过100μIU/mL时,要用样品稀释液提高稀释倍数重新稀释,并按照(1-4)步骤检测。


化学发光仪(Alpha FluorChem Q)操作说明书一、仪器使用注意事项1.请勿频繁开关CCD,一天开关一次;2.样品分析之前,请先打开仪器和软件,必须等CCD的温度降至-20℃才可以进行样品成像操作;3.分析样品前,请在托盘上铺一张干净的保鲜膜;4.仪器使用完毕后,请清洁仪器的内部和外部;请用自来水冲洗样品托盘,切勿使用抹布、刷子和纸巾擦拭托盘;5.此台仪器不能用于照EB胶;6.如实填写仪器使用记录,爱护仪器。
二、化学发光成像操作步骤1.开机:依次打开电脑、插线板开关、仪器开关(在仪器后下方),软件;关机:依次关闭软件、仪器开关、插线板开关、电脑。
图1-12.打开电脑桌面上的FluorChem Q软件,单击Acquire按钮,仪器进入降温状态,待温度降至-20℃才可以进行使用(仪器温度降至-20℃且稳定30min后使用,效果会更好)。
3.准备样品:铺一张干净保鲜膜在托盘上,把western blotting膜放在托盘白色框内,加入试剂。
图1-24.打开仪器门,把托盘放入仪器内第1层;关闭仪器门,打开仪器上方小门(左推即开),调节光圈数至0.95。
图1-35.预览结果方法设置(也可以不预览结果,直接进行下面第6步操作):5.1 左键单击Live按钮5.2 Protocal:Chemi High-Med5.3 Display:选中Chemi Display和Show Saturati5.4 Speed/Resolution: Medium/HighNoise reduction: Level 25.5 单击Preview预览结果5.6 想采集预览图片信息,点击Acquire按钮开始采集图片信息图1-46.根据预览结果设定采集信号的方法:6.1 左键单击MovieMode按钮6.2 设定采集照片总数Total fr.,例如设为106.3 选中Stack Frames6.4 不选中Auto exposure,设定手动曝光时间Exposure,例如设为20s(根据信号强弱设定)6.5 按照图1-4选择其它选项6.6 左键单击Copy to En按钮6.7 点击Go按钮即开始采集图片信息图1-57.保存图片7.1点击要保存的照片,点击图标保存单张图片,点击图标保存所有图片照片最好以Tiff格式保存,方便发表文章用;7.2 或者点击要保存的照片,单击File,单击Save保存原始图片;7.3 或者点击要保存的照片,单击File,单击Save Modified保存图片(此方式保存的图片所有图片软件都能打开)。
AIA-600II错误信息及其处理在本装置中,发生某些异常时出现的信息大致可以分为3种。
1.故障信息在机构的动作上发生异常时显示出该信息,动作的一部分(或者全部)停止。
2.暂停信息在测定过程中,当难以继续进行测定时,或者继续测定时会处于危险的状态时显示出该信息,中断(暂停)测定。
3.旗标由于某种原因导致测定未能正常结束时,在测定结果上追加该信息,以说明其原因。
11-1附录A 错误信息及其处理1.故障信息的显示/打印输出在本装置中,当动作时发生机构上的错误/故障时,显示出画面8-1MECHANICAL ERROR !,显出表示故障内容的信息。
同时,相同信息被打印机打印出来,并通过电子蜂鸣器通知操作人员发生了故障。
图 11-1 MECHANICAL ERROR SCREEN图 11-1 故障信息(打印输出)实例请在确认画面中显示的信息后进行适当的处理。
在发生错误/故障,导致不能正常完成检查时,在测定值上也出现错误旗标,不能得出测定结果。
(参见图11-2)11-2附录A 错误信息及其处理在显示出故障画面时,可以通过按“F -1”(“INITIALIZE ”)键进行机构的初始化。
如果进行机构的初始化后错误的显示信息不再出现的话,可以重新开始测定。
图11-2 发生错误时的测定结果打印实例11-3附录A 错误信息及其处理2.故障信息一览EMERGENCY ERROR 重大错误ERROR 动作错误11-4附录A 错误信息及其处理3.暂停信息一览在执行测定动作的过程中,在难以继续进行测定时,或者继续测定的话会导致危险时,显示出暂停信息,测定中断(暂停)。
已经在温度调节器进行反应的检查项目继续进行。
另外,通过电子蜂鸣器通知操作人员发生了故障。
对显示出的内容进行处置,排除故障的原因后,按“ENTER“键,重新开始测定。
如果按“ENTER“键后仍然出现暂停信息,则表示未满足重新开始测定的条件。
11-5附录A 错误信息及其处理4.旗标一览根据需要,在测定结果上添加“旗标”。