铁钴镍
- 格式:ppt
- 大小:872.50 KB
- 文档页数:2
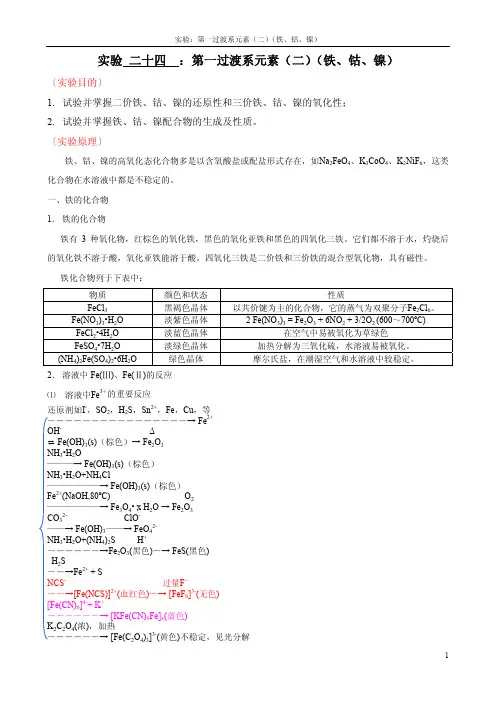
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。


实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2也能被空气中的氧气慢慢氧化。
最后成为红棕色的氢氧化铁。
Co(OH)22、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH),NiO(OH)与浓盐酸反应分别生成Co(II)3和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。

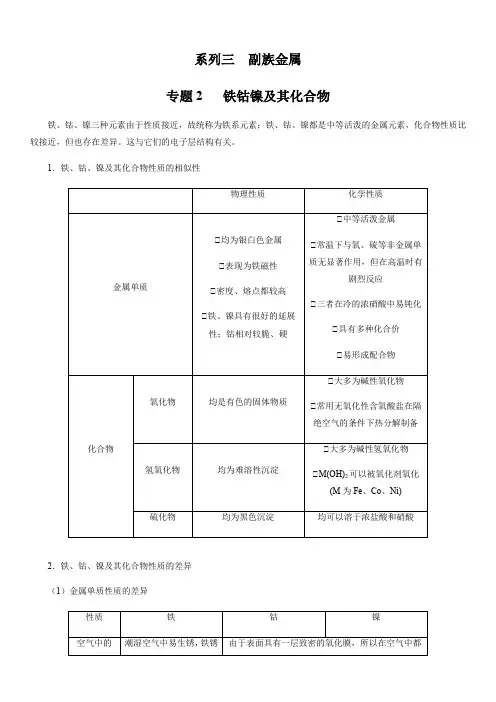
系列三副族金属专题2 铁钴镍及其化合物铁、钴、镍三种元素由于性质接近,故统称为铁系元素;铁、钴、镍都是中等活泼的金属元素,化合物性质比较接近,但也存在差异。
这与它们的电子层结构有关。
1.铁、钴、镍及其化合物性质的相似性2.铁、钴、镍及其化合物性质的差异(1)金属单质性质的差异(2)铁、钴、镍的氧化物和氢氧化物①铁、钴、镍氧化物和氢氧化物的基本性质注:①表示在碱性条件下不具有氧化性。
①比较与总结(1)在酸性溶液中,Fe2+、Co2+、Ni2+分别是铁、钴、镍离子的稳定状态。
高价态的铁(①)、钴(①)、镍(①)在酸性溶液中都有很强的氧化性,空气中的O2能将酸性溶液中的Fe2+氧化成Fe3+,但不能将Co2+、Ni2+氧化成Co3+和Ni3+。
(2)在碱性介质中,铁的最稳定价态是+3,而钴、镍的最稳定价态仍是+2,在碱性介质中,将低价态的Fe(①)、Co(①)、Ni(①)氧化成高价态比酸性介质中容易。
4.高铁盐的制备在酸性介质中,FeO 2-4(高铁酸根离子)是一种强氧化剂,一般氧化剂很难把Fe 3+氧化成FeO 2-4,但在强碱性介质中,Fe(①)却能被一些氧化剂(如NaClO)所氧化:2Fe(OH)3+3ClO -+4OH -===2FeO 2-4+3Cl -+5H 2O ,将Fe 2O 3、KNO 3和KOH 混合并加热共融,生成紫红色的高铁酸钾:Fe 2O 3+3KNO 3+4KOH=====① 2K 2FeO 4+3KNO 2+2H 2O 。
5. 检验Fe 2+和Fe 3+时的注意事项(1)检验Fe 2+时不能先加氯水后加KSCN 溶液,也不能将加KSCN 后的混合溶液加入到足量的新制氯水中(新制氯水可能氧化SCN -)。
(2)Fe 3+、Fe 2+、Cl -同时存在时不能用酸性KMnO 4溶液检验Fe 2+(Cl -能还原酸性KMnO 4,有干扰)。
(3)检验Fe 2+、Fe 3+的其他方法①检验Fe 2+最好、最灵敏的试剂是铁氰化钾K 3[Fe(CN)6]:3Fe 2++2[Fe(CN)6]3-===Fe 3[Fe(CN)6]2↓(蓝色)。

铁钴镍合金材料参数铁钴镍合金材料参数——为高性能应用而生引言:在现代科技发展迅猛的时代,材料科学作为一门重要学科,不断推动着各个领域的进步。
铁钴镍合金作为一类重要的功能材料,因其独特的物理和化学性质,在航空航天、汽车制造、电子设备等领域中得到了广泛应用。
本文将深入探讨铁钴镍合金的参数特征、性能优势以及发展前景,并回顾其应用历程,以帮助读者全面理解这一主题。
一、铁钴镍合金材料参数的简介1.1 化学成分铁钴镍合金是指以铁、钴和镍为基本元素的合金材料。
根据不同比例和添加元素的差异,可以获得不同类型的铁钴镍合金。
常见的铁钴镍合金包括Fe-Co-Ni、Fe-Co-Ni-Cu、Fe-Co-Ni-Mo等。
1.2 结构特点铁钴镍合金具有面心立方结构或体心立方结构,这使得它们在高温和低温环境中都能保持良好的稳定性。
由于其晶粒细小,具有优异的力学性能和耐腐蚀性能。
二、铁钴镍合金材料参数的性能优势2.1 优良的热稳定性铁钴镍合金具有出色的高温稳定性,可以在高温环境下长时间工作而不失效。
这使得它们在航空航天领域中得到广泛应用,如发动机涡轮盘、喷气发动机叶片等部件。
2.2 良好的机械性能铁钴镍合金拥有优秀的机械性能,高韧性和抗拉强度。
这使得它们在制造领域中应用广泛,如汽车发动机部件、工具和模具等。
2.3 良好的磁性能铁钴镍合金具有优良的磁性能,具有高磁导率和低磁滞损耗。
这使得它们在电子设备领域中得到广泛应用,如传感器、电感器和电机。
三、铁钴镍合金材料参数的应用前景铁钴镍合金由于其出色的性能,被广泛应用于许多领域,并具有广阔的前景。
3.1 新能源领域随着新能源汽车的兴起,铁钴镍合金作为电池材料备受关注。
其优异的导电性和循环稳定性,使之成为锂离子电池和燃料电池的理想选择。
3.2 航空航天领域铁钴镍合金在航空航天领域具有重要的地位。
其出色的高温稳定性和机械性能,使之成为制造航空发动机、航天器结构件以及高温陶瓷基复合材料的理想材料。

铁钴镍合金材料参数
(最新版)
目录
1.铁钴镍合金的概述
2.铁钴镍合金的主要参数
3.铁钴镍合金的应用领域
正文
铁钴镍合金是一种由铁、钴和镍元素组成的合金材料,因其具有优良的磁性能、耐腐蚀性和耐磨性,被广泛应用于磁性材料、电子元器件、磁力矫治器等领域。
一、铁钴镍合金的概述
铁钴镍合金,简称铁镍钴合金,是一种具有铁磁性的合金。
它的主要成分是铁、钴和镍,此外,还可能含有少量的碳、铬、钼等元素。
这种合金的磁性能可以通过调整其成分和制造工艺进行优化。
在磁性材料领域,铁钴镍合金是最常用的软磁合金之一。
二、铁钴镍合金的主要参数
铁钴镍合金的主要参数包括磁性、硬度、耐腐蚀性、电阻率等。
1.磁性:铁钴镍合金的磁性主要由其成分决定。
一般来说,镍含量越高,磁性越强。
通过改变镍、铁、钴的比例,可以调整合金的磁性能,使其满足不同的应用需求。
2.硬度:铁钴镍合金的硬度一般在 HRC50-60 之间,具有较好的耐磨性。
3.耐腐蚀性:铁钴镍合金在大气、淡水和海水中都有较好的耐腐蚀性,但在酸、碱等腐蚀性环境中的耐腐蚀性较差。
4.电阻率:铁钴镍合金的电阻率较低,一般在 10^-5 级别,因此,其导电性能较好。
三、铁钴镍合金的应用领域
铁钴镍合金因其优良的性能,被广泛应用于以下领域:
1.磁性材料:铁钴镍合金是常用的磁性材料,可以制作永磁体、磁性传感器、磁力矫治器等。
2.电子元器件:铁钴镍合金可以制作电子元器件,如磁芯、变压器、电感等。
3.医疗设备:铁钴镍合金具有良好的磁性能和耐腐蚀性,可以用于制作磁力矫治器等医疗设备。

铁钴镍合金材料参数摘要:1.铁钴镍合金简介2.铁钴镍合金的分类3.铁钴镍合金的性能与应用4.铁钴镍合金的发展趋势正文:铁钴镍合金是一种具有良好磁性能和耐腐蚀性的合金材料,广泛应用于各种工业领域。
本文将简要介绍铁钴镍合金的参数及其应用。
1.铁钴镍合金简介铁钴镍合金是由铁、钴和镍三种金属元素组成的合金。
由于其具有良好的磁性能、耐腐蚀性和高强度等特点,铁钴镍合金被广泛应用于磁性材料、永磁材料、硬质合金等领域。
2.铁钴镍合金的分类铁钴镍合金可以根据其成分和性能分为以下几类:(1) 铁钴合金:主要成分是铁和钴,具有良好的磁性能和硬度。
例如,磁性材料中的钐钴合金和钆钴合金。
(2) 铁镍合金:主要成分是铁和镍,具有较高的强度和耐腐蚀性。
例如,用于制造不锈钢和耐蚀合金的奥氏体和马氏体铁镍合金。
(3) 钴镍合金:主要成分是钴和镍,具有较高的耐热性和抗氧化性。
例如,用于制造高温耐磨零件的钨钴合金和钽钴合金。
3.铁钴镍合金的性能与应用铁钴镍合金具有以下优异性能:(1) 良好的磁性能:铁钴镍合金具有高矫顽力和高磁导率,广泛应用于磁性材料和永磁材料。
(2) 耐腐蚀性:铁钴镍合金具有较好的耐腐蚀性,可用于制造耐蚀合金和防腐设备。
(3) 高强度:铁钴镍合金具有高强度和硬度,可用于制造高强度零件和硬质合金。
(4) 耐高温性:铁钴镍合金具有较高的熔点和较好的抗氧化性,可用于制造高温耐磨零件。
铁钴镍合金广泛应用于以下领域:(1) 磁性材料:用于制造永磁体、磁卡、磁带等磁性产品。
(2) 永磁材料:用于制造永磁电机、永磁发电机、磁悬浮列车等设备。
(3) 硬质合金:用于制造切削工具、钻头、模具等耐磨零件。
(4) 不锈钢和耐蚀合金:用于制造化工设备、船舶、航空等领域的耐蚀零件。
(5) 高温耐磨零件:用于制造航空、航天、石油等领域的耐磨零件。
4.铁钴镍合金的发展趋势随着科技的不断发展,对铁钴镍合金的需求越来越大。
未来,铁钴镍合金的发展趋势主要表现在以下几个方面:(1) 开发新型铁钴镍合金:通过调整合金成分和优化制备工艺,开发具有更高性能的新型铁钴镍合金。

为什么只有铁,钴,镍三种元素具有磁性?展开全文在所有的八十种金属元素中,有四种金属在室温下具有铁磁性(磁性),它们分别是铁、钴、镍、钆(gá);此外,在超低温下,有五种金属是铁磁性的,它们分别是铽、镝、钬、铒和铥。
因此,并不是只有铁钴镍三种元素具有磁性,那为什么我们都认为只有铁钴镍三种元素具有磁性呢?居里温度:掌控磁性材料磁性有无的临界温度居里温度(Curie temperature,Tc),又称磁性转变点,是指磁性材料中自发磁化强度降到零时的温度,是铁磁性或亚铁磁性物质转变成顺磁性物质的临界点。
温度低于居里温度时,磁性材料有磁性,但一旦温度高于该物质的居里温度,该物质的磁性就会消失,成为顺磁性物质,不具有磁性。
不同磁性材料的居里温度不同,如铁的居里温度为786℃、钴的居里温度为1070℃、镍的居里温度为376℃、钆的居里温度为20℃。
由上可知:钆虽然也可以有磁性,但当温度高于20℃时,磁性就会消失。
在地球上,20℃是很常见的温度,甚至算是低温,因此要想保持钆的磁性需要对其严加看护,不然一不小心磁性就会消失,变成一块毫无吸引力的“废铜烂铁”。
此外,作为一种稀土材料,钆在地壳中的含量仅为0.000636%,储量少、开采难度大,注定其难以为众人所知,因此钆很少被列为磁性物质。
虽然在铁磁性材料中难以大放异彩,但在某些特殊领域,钆被寄于重任。
•钆有最高的热中子俘获面,可用作核反应堆的控制棒和中子吸收棒。
•由于一种材料在受到磁场作用成为磁性组织时放热,磁性消失是又会吸热,利用这一性质,用钆盐经磁化制冷可获得接近绝对零度的超低温。
世间金属八十种,为何偏偏只有铁钴镍钆之原子核外要有未成对的电子1907年,法国科学家外斯提出了铁磁性假说,较为系统地解释了铁磁现象出现的本质原因和规律,假说大致可分为两点:铁磁物质内部存在很强的“分子场”,在“分子场”的作用下,原子磁矩趋于同向平行排列,即自发磁化至饱和,称为自发磁化;铁磁体自发磁化分成若干个小区域,这些自发磁化至饱和的小区域被称为磁畴,由于各个磁畴的磁场方向各不相同,其磁性彼此相互抵消,所以物体对外不显磁性。

一、实验目的1. 了解铁、钴、镍三种金属的基本性质及其在化学反应中的表现。
2. 掌握铁、钴、镍化合物的制备方法及其性质。
3. 培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有丰富的化学性质。
本实验通过观察铁、钴、镍在不同条件下的反应,分析其化学性质。
三、实验材料与仪器1. 实验材料:- 铁(Fe)片- 钴(Co)片- 镍(Ni)片- 盐酸(HCl)- 硫酸(H2SO4)- 氢氧化钠(NaOH)- 氯化钠(NaCl)- 硫氰酸钾(KSCN)- 硫酸铜(CuSO4)- 氨水(NH3·H2O)- 碘化钾(KI)- 氯水(Cl2)2. 实验仪器:- 试管- 烧杯- 滴定管- 研钵- 电子天平- 酒精灯- 铁架台- 玻璃棒四、实验步骤1. 铁的性质实验:a. 将铁片放入盐酸中,观察铁片表面变化。
b. 将铁片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将铁片放入氨水中,观察溶液颜色变化。
2. 钴的性质实验:a. 将钴片放入盐酸中,观察钴片表面变化。
b. 将钴片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将钴片放入氨水中,观察溶液颜色变化。
3. 镍的性质实验:a. 将镍片放入盐酸中,观察镍片表面变化。
b. 将镍片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将镍片放入氨水中,观察溶液颜色变化。
4. 铁钴镍化合物的制备:a. 将铁、钴、镍分别与盐酸反应,观察反应现象。
b. 将铁、钴、镍的盐溶液与氢氧化钠反应,观察沉淀颜色。
c. 将铁、钴、镍的盐溶液与氯化钠反应,观察溶液颜色变化。
五、实验结果与分析1. 铁的性质实验:a. 铁片与盐酸反应产生气泡,溶液颜色由无色变为浅绿色。
b. 铁片与硫酸铜溶液反应,溶液颜色由蓝色变为浅绿色,铁片表面出现红色沉淀。
c. 铁片与氨水反应,溶液颜色由无色变为浅绿色。
2. 钴的性质实验:a. 钴片与盐酸反应产生气泡,溶液颜色由无色变为浅蓝色。

一、实验目的1. 了解铁钴镍合金的制备方法和特点;2. 掌握电解铁钴镍时的反应机理及控制技术;3. 熟悉常规化学分析方法的操作;4. 培养实验观察能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的化学性质。
在实验中,我们将通过电解法制备铁钴镍合金,并观察其物理和化学性质。
三、实验材料与仪器1. 实验材料:- 铁、钴、镍金属片- 硫酸- 硫酸铜- 氢氧化钠- 氯化钠- 碘化钾- 氢氧化铵- 氨水- 硫氰酸钾- 银氨溶液- 氢氧化钠溶液- 硫酸亚铁铵溶液2. 实验仪器:- 电解槽- 铂电极- 银电极- 滴定管- 烧杯- 烧瓶- 烧杯夹- 玻璃棒- 铁架台- 热水浴四、实验步骤1. 制备铁钴镍合金- 将铁、钴、镍金属片分别放入硫酸中,去除表面的氧化物。
- 将去除氧化物的金属片放入电解槽中,加入适量的硫酸铜溶液。
- 将铂电极和银电极分别插入电解槽中,连接电源。
- 开启电源,进行电解反应,直至金属片表面形成合金层。
- 关闭电源,取出金属片,用热水清洗。
2. 观察合金的性质- 将制备好的铁钴镍合金进行外观观察,记录其颜色、硬度等性质。
- 将合金进行导电性测试,记录其电阻值。
3. 分析合金成分- 将合金样品溶解于硫酸中,制备成溶液。
- 采用化学滴定法,分别测定铁、钴、镍的含量。
- 计算合金中各元素的摩尔比。
4. 研究合金的化学性质- 将合金样品溶解于氢氧化钠溶液中,观察其颜色变化。
- 将合金样品与碘化钾溶液反应,观察其颜色变化。
- 将合金样品与硫氰酸钾溶液反应,观察其颜色变化。
- 将合金样品与银氨溶液反应,观察其颜色变化。
五、实验结果与分析1. 铁钴镍合金的制备- 通过电解法制备的铁钴镍合金呈银灰色,硬度较高。
- 合金具有良好的导电性,电阻值为1.5×10^-4Ω·m。
2. 合金成分分析- 铁钴镍合金中,铁、钴、镍的摩尔比为2:1:1。
3. 合金的化学性质- 铁钴镍合金在氢氧化钠溶液中呈灰绿色,表明其具有一定的还原性。
一、实验目的1. 了解铁、钴、镍三种元素的基本性质。
2. 掌握铁、钴、镍的氧化还原性质。
3. 熟悉铁、钴、镍的配合物生成及鉴定方法。
4. 培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们在化学反应中表现出丰富的氧化还原性质。
实验过程中,我们将通过一系列反应来观察和分析铁、钴、镍的性质。
三、实验器材与试剂1. 器材:试管、烧杯、滴管、酒精灯、镊子、试管架、铁架台、滤纸等。
2. 试剂:铁粉、钴粉、镍粉、硫酸亚铁铵、硫酸铜、氯化钴、硫酸镍、氢氧化钠、氨水、盐酸、氯水等。
四、实验步骤1. 铁的氧化还原性质(1)取一小试管,加入少量硫酸亚铁铵溶液,观察溶液颜色。
(2)向溶液中加入少量铁粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
2. 钴的氧化还原性质(1)取一小试管,加入少量氯化钴溶液,观察溶液颜色。
(2)向溶液中加入少量钴粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
3. 镍的氧化还原性质(1)取一小试管,加入少量硫酸镍溶液,观察溶液颜色。
(2)向溶液中加入少量镍粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
4. 铁的配合物生成及鉴定(1)取一小试管,加入少量硫酸亚铁铵溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入过量氨水,观察溶液颜色变化及沉淀是否溶解。
5. 钴的配合物生成及鉴定(1)取一小试管,加入少量氯化钴溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入过量氨水,观察溶液颜色变化及沉淀是否溶解。
6. 镍的配合物生成及鉴定(1)取一小试管,加入少量硫酸镍溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
高考--常考元素--铁钴镍铁钴镍14.3.1 铁系元素概述铁在地壳中的含量为~5%,居第四位,次于铝。
在常用金属中,铁算得上最丰富、最重要和最廉价的了。
铁矿有赤铁矿Fe2O3 、磁铁矿Fe3O4、褐铁矿Fe2O3·3H2O、菱铁矿FeCO3、黄铁矿FeS2、钛铁矿FeTiO3和铬铁矿Fe(CrO2)2等,我国东北的鞍山、本溪、华北的包头、宣化、华中的大冶等地都有较好的铁矿。
钴相对地说是一种不常见的金属,地壳中的含量为0.0023%,但它分布很广,它通常和硫或砷结合,如辉钴矿CoAsS。
它还存在于维生素B12(一种钴(Ⅲ)的配合物)中。
镍比钴更丰富地存在于自然界,地壳中的含量为0.018%,它主要与砷、锑和硫结合为针镍矿、镍黄铁矿等,在陨石中含有铁镍合金。
铁、钴、镍主要用于制造合金。
铁有生铁、熟铁之分,生铁含碳在1.7﹪~4.5﹪之间,熟铁含碳在0.1﹪以下,而钢的含碳量介于二者之间。
如果在加入Cr、Ni、Mn、Ti等制成合金钢、不锈钢,可大大改善普通钢的性质。
铁Fe、钴Co、镍Ni位于周期表第四周期、第Ⅷ族,其物理性质和化学性质都比较相似,合称铁系元素。
铁系元素单质都是具有金属光泽的白色金属,铁、钴略带灰色,镍为银白色。
依Fe、Co、Ni 顺序,原子半径略有减小,密度增大。
它们的密度都比较大,熔点也比较高,熔点随原子序数的增加而降低,Fe、Co、Ni分别为1535℃、1495℃、1453℃。
这可能是因为3d轨道中成单电子数按Fe、Co、Ni的顺序依次减少(4、3、2),金属键依次减弱的缘故。
钴比较硬而脆,铁和镍却有很好的延展性。
它们都表现有铁磁性,其合金是很好的磁性材料。
由于第一过渡系列元素原子的电子填充过渡到第Ⅷ族时,3d电子已经超过5个,所以它们的价电子全部参加成键的可能性减少,因而铁系元素已经不再呈现出与族数相当的最高氧化态。
铁的常见氧化态是+2和+3,与强氧化剂作用,铁可以生成不稳定的+6氧化态的高铁酸盐;钴和镍的常见氧化态都是+2,与强氧化剂作用,钴可以生成不稳定的+3氧化态,而镍的+3氧化态更少见。
【考必备·清单】铁、钴、镍同属于元素周期表中的Ⅷ族,性质相近,故统称为铁系元素,其主要化合价为+2和+3价。
1.Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)性质差异(1)氧化物氧化铁与酸只发生复分解反应,而氧化钴与氧化镍在酸性溶液中显示出强氧化性:Co2O3+6HCl===2CoCl2+Cl2↑+3H2O、Ni2O3+6HCl===2NiCl2+Cl2↑+3H2O。
(2)氢氧化物铁的氢氧化物只与酸发生酸碱中和反应:Fe(OH)3+3H+===Fe3++3H2O。
镍、钴的氢氧化物与还原性酸发生氧化还原反应:2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O,2Ni(OH)3+6H++2Cl-===2Ni2++Cl2↑+6H2O。
(3)离子存在状态Fe3+在酸性溶液中可以稳定存在,而Co(Ⅲ)、Ni(Ⅲ)仅能够存在于固态物质或配合物中,在水溶液中会发生如下反应(镍同):4Co3++2H2O===4Co2++4H++O2↑。
2.Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)性质差异(1)氢氧化物还原性[Fe(OH)2>Co(OH)2>Ni(OH)2]①Fe(OH)2在空气中极易被氧化成Fe(OH)3;②Co(OH)2在空气中被O2氧化的速度较慢;可以被强氧化剂(H2O2)迅速氧化;③Ni(OH)2在空气中不易被氧化,只有在更强的氧化剂条件下才会氧化生成Ni(OH)3。
(2)与氨水反应①Fe(OH)2―→Fe(OH)3;②Co(OH)2―→[Co(NH3)6]2+;③Ni(OH)2―→[Ni(NH3)6]2+。
借此反应,可以使三种离子分离。
[名师点拨]①Co(OH)2可被氧气缓慢地氧化成棕褐色Co(OH)3,Ni(OH)2与氧气不反应,可采用较强的氧化剂将其氧化。
②Co(OH)3、Ni(OH)3在H2SO3溶液中被还原:2Co(OH)3+H2SO3+2H+===2Co2++SO2-4+5H2O,2Ni(OH)3+H2SO3+2H+===2Ni2++SO2-4+5H2O。
实验五:铁、钴、镍铁、钴、镍属于第八族元素,又称铁系元素。
氢氧化铁为红棕色固体,氢氧化亚铁为白色固体,但是氢氧化亚铁很容易被氧气氧化为氢氧化铁。
在Fe3+的溶液中滴加NH4SCN会得到Fe3+的血红色配合物,而在Fe2+的溶液中滴加NH4SCN不会有沉淀生成,也不会有颜色;在Co2+和Ni2+的溶液中滴加强碱,会生成粉红色氢氧化钴(II)和苹果绿色的氢氧化镍(II)沉淀,氢氧化钴(II)会被空气中的氧缓慢氧化为暗棕色的氧化物水合物Co2O3.xH2O。
氢氧化镍(II)需要在浓碱溶液中用较强的氧化剂(如次氯酸钠)才能氧化为黑色的NiO(OH)。
Co2O3和NiO(OH)会和水或酸根离子迅速发生氧化还原反应;在水溶液中Fe3+和Fe2+的水配合物的颜色分别为淡紫色和淡绿色的形式存在。
在Fe3+和Fe2+的溶液中分别滴加K4[Fe(CN)6]和K3[Fe(CN)6]溶液,都得到蓝色沉淀,它们是组成相同的普鲁士蓝和滕氏蓝,可以用来鉴定Fe3+和Fe2+的存在;由于Co3+在水溶液中不稳定,所以一般是将Co2+的盐溶在含有配合物的溶液中,用氧化剂将其氧化,从而得到Co3+的配合物;在含有Co2+的溶液中滴加NH4SCN溶液,会生成蓝色的[Co(NCS)4]2+,由此鉴定Co2+的存在;在含有Ni2+的溶液中逐滴滴加氨水,会得到蓝色Ni2+的配合物,在此基础上继续滴加丁二酮肟,得到鲜红色鳌合物沉淀,由此鉴定Ni2+的存在。
实验内容:1:Fe3+的氧化性、Fe2+的还原性及其离子鉴定(1)离子鉴定:分别用K4[Fe(CN)6]、K3[Fe(CN)6]、NH4SCN和0.25%邻菲罗啉来鉴定Fe3+和Fe2+。
(2)氧化还原特性;2:铁、钴、镍的氢氧化物,Co2+和Ni2+二价氢氧化物的制备与对比;3:钴、镍的配合物。
Co2+和Ni2+的鉴定反应。
注意事项:(1)此次实验是定性实验,颜色变化是实验的关键内容,颜色变化和离子的价态一一对应,仔细观察实验并在实验报告中反映、思考;药品:0.2M的FeCl3,2M的硫酸,铁粉,0.5M的NH4SCN,浓硝酸,0.1M的KMnO4,0.2M的Co(NO3)2,2M的NaOH,2M的HCl,0.2M的Ni(NO3)2,NH4Cl固体,6M的氨水,5%的H2O2,戊醇,饱和NH4SCN(溶解度:300C下,208克/100克水),0.2M的Ni(NO3)2,丁二酮肟(补加的药品)。
铁钴镍实验报告实验报告:铁、钴、镍的性质研究一、实验目的了解铁、钴、镍的基本物理和化学性质。
通过实验观察和分析,掌握铁、钴、镍在化学反应中的表现。
培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的电子构型和化学性质。
通过本实验,我们将观察这些元素在空气中的氧化反应、与酸的置换反应以及与某些盐溶液的置换反应等现象。
三、实验材料与设备实验材料:铁丝、钴丝、镍丝、稀盐酸、稀硫酸、氯化钠溶液、硫酸铜溶液等。
实验设备:试管、烧杯、镊子、酒精灯等。
四、实验步骤与观察记录观察铁、钴、镍丝的外观和颜色,并记录。
将铁丝、钴丝、镍丝分别放入试管中,加入稀盐酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入试管中,加入稀硫酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有氯化钠溶液的烧杯中,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有硫酸铜溶液的烧杯中,观察并记录反应现象。
用酒精灯加热铁丝、钴丝、镍丝至红热状态,然后迅速伸入盛有氧气的集气瓶中,观察并记录反应现象。
五、实验结果与分析铁丝、钴丝、镍丝的外观均为银白色金属光泽。
在空气中放置一段时间后,表面会逐渐氧化形成一层氧化物薄膜。
铁丝、钴丝、镍丝与稀盐酸反应均产生气泡,说明它们能与酸发生置换反应生成氢气。
反应方程式如下:Fe + 2HCl →FeCl2 + H2↑Co + 2HCl →CoCl2 + H2↑Ni + 2HCl →NiCl2 + H2↑铁丝、钴丝、镍丝与稀硫酸反应也产生气泡,同样说明它们能与酸发生置换反应生成氢气。
反应方程式与上述类似。
在氯化钠溶液中,铁丝、钴丝、镍丝均未发生明显反应,说明它们与氯化钠溶液不反应。
在硫酸铜溶液中,铁丝、钴丝、镍丝表面均出现红色物质析出,说明它们能与硫酸铜发生置换反应生成铜。
反应方程式如下:Fe + CuSO4 →FeSO4 + CuCo + CuSO4 →CoSO4 + CuNi + CuSO4 →NiSO4 + Cu当加热铁丝、钴丝、镍丝至红热状态后迅速伸入盛有氧气的集气瓶中时,观察到铁丝剧烈燃烧火星四射生成黑色固体四氧化三铁;钴丝和镍丝也发生燃烧但火星较少生成相应的氧化物。