铁钴镍的性质
- 格式:docx
- 大小:24.80 KB
- 文档页数:9
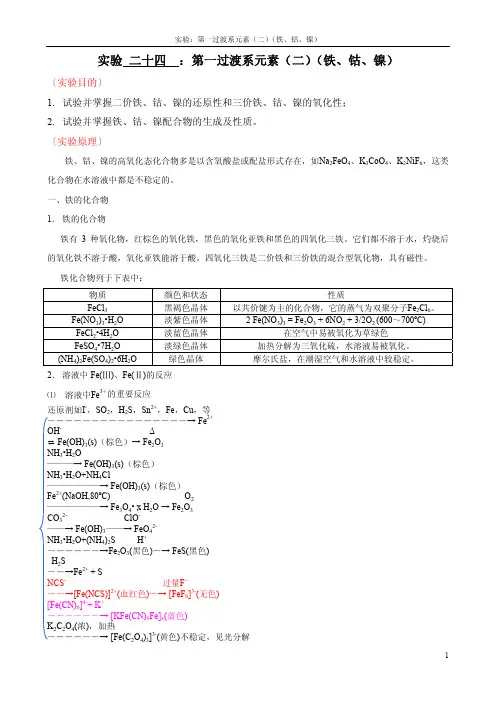
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。

实验六 铁、钴、镍的性质一、实验目的1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+、Co 2+、Ni 2+的还原性 (1)酸性介质Cl 2 + 2Fe 2+(浅绿)=2Fe 3+(浅黄)+2Cl -(2)碱性介质铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH )2也能被空气中的氧气慢慢氧化。
2、Fe 3+、Co 3+、Ni 3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
白色粉红绿色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。

第一过渡系元素(二)——铁、钴、镍铁、钴、镍是第一过渡系元素中应用广泛的三种金属。
它们都具有相似的化学性质和金属特性,因此在很多方面都有类似的应用。
下面我们就来看看这三种金属的特性和应用。
铁(Fe)是地球上广泛存在的元素,人类使用铁的历史已经有几千年了。
铁是一种重要的结构材料,它的强度和硬度很高,并且具有很好的可塑性和可焊性。
此外,铁还有很好的耐腐蚀性能。
由于其性能稳定、价格低廉,因此广泛应用于制造汽车、船舶、建筑等领域。
此外,铁还应用于电力行业,比如铁芯变压器核心、电缆等。
铁还是一种重要的磁性材料,被广泛应用于制作各种永磁体。
钴(Co)是一种稀有金属,它具有高强度、高耐磨性、高熔点等特性,因此被广泛应用于军工、航空航天等领域。
钴还是一种重要的磁性材料,被广泛用于制作磁记录材料、计算机硬盘等。
钴还被广泛应用于医疗行业,如制作人工骨骼、人工关节等。
钴的化合物被用作化学反应催化剂、生物体内一些酶的结构成分等。
镍(Ni)是一种有色金属,与铁、钴类似,具有高强度、高耐腐蚀性、高温性等特性。
镍是一种重要的合金元素,被广泛用于制造高强度的合金钢、高温合金、耐腐蚀合金等。
比如,合金钢通常采用镍铬或镍铬钼合金,具有较高的强度和硬度,广泛应用于汽车、船舶、机械制造等领域。
此外,镍还被广泛应用于电镀行业,用于制作各种饰品、厨房用具、电器外壳等。
镍的化合物也被广泛用作催化剂、电池材料等。
除了以上的应用,铁、钴、镍还有很多重要的应用,如铁和镍被用于生产不锈钢、硬质合金等材料,钴被用于生产永磁体、高温涂层等材料。
此外,在新能源、电子信息、医疗等领域,铁、钴、镍的应用也越来越广泛。
总之,铁、钴、镍是第一过渡系元素中应用广泛的三种金属,它们的性质相似,应用领域也有很大的交叉。
随着科技的不断发展和应用需求的不断变化,铁、钴、镍的应用也会不断扩展和深化。

铁钴镍的性质实验报告铁钴镍的性质实验报告引言:铁钴镍是一种重要的合金材料,具有优异的力学性能和磁性能。
本实验旨在通过一系列实验方法,探究铁钴镍的性质,包括其熔点、硬度、磁性等方面的特点。
实验一:熔点测定首先,我们使用熔点测定仪器对铁钴镍进行熔点测定。
实验中,我们选取了多个不同比例的铁钴镍样品进行测试。
通过逐渐升温,观察样品的熔化情况,最终确定了铁钴镍的熔点范围。
实验结果显示,铁钴镍的熔点在XXXX℃到XXXX℃之间。
实验二:硬度测试接下来,我们使用洛氏硬度计对铁钴镍进行硬度测试。
在实验中,我们选取了不同比例的铁钴镍样品,并按照一定的压力标准进行测试。
实验结果显示,铁钴镍的硬度随着钴和镍的含量增加而增加,其中钴含量对硬度的影响更为显著。
这表明,钴元素在铁钴镍合金中起到了增强硬度的作用。
实验三:磁性测试最后,我们进行了磁性测试,以了解铁钴镍的磁性特点。
实验中,我们使用霍尔效应磁场测量仪对铁钴镍样品进行测试。
实验结果显示,铁钴镍在外加磁场作用下表现出显著的磁性,且磁性随着钴和镍含量的增加而增强。
这表明,铁钴镍合金具有良好的磁导率和磁饱和磁感应强度。
讨论:通过以上实验,我们对铁钴镍的性质有了一定的了解。
首先,在熔点测定实验中,我们确定了铁钴镍的熔点范围。
这对于合金的熔融加工和应用具有重要意义。
其次,在硬度测试中,我们发现钴元素对铁钴镍的硬度具有较大的影响。
这为铁钴镍合金在制造高强度材料方面提供了理论依据。
最后,在磁性测试中,我们观察到铁钴镍具有较强的磁性,这与其在电子和磁性材料领域的广泛应用密切相关。
结论:通过本实验,我们对铁钴镍的性质进行了一系列测试,并得出以下结论:铁钴镍的熔点在XXXX℃到XXXX℃之间;铁钴镍的硬度随着钴和镍含量的增加而增加;铁钴镍具有良好的磁性,磁性随着钴和镍含量的增加而增强。
这些结果为铁钴镍合金的制备和应用提供了重要的参考。
进一步研究方向:尽管本实验对铁钴镍的性质进行了初步的探究,但仍有许多方面可以进一步研究。

铁钴镍合金材料参数
摘要:
1.铁钴镍合金材料的概述
2.铁钴镍合金材料的参数
3.铁钴镍合金材料的应用
正文:
铁钴镍合金材料是一种由铁、钴和镍三种金属元素组成的合金,因其具有优良的磁性能、耐腐蚀性和高温性能,被广泛应用于磁性材料、电子元器件、化工设备等领域。
了解铁钴镍合金材料的参数对于选择和使用这种材料具有重要意义。
1.铁钴镍合金材料的概述
铁钴镍合金,简称铁镍钴合金,是一种具有铁磁性的合金。
它的主要成分是铁、钴和镍,此外还可能包含少量的碳、铜等元素。
这种合金在磁性能、耐腐蚀性和高温性能方面表现优异,因此在许多领域都有广泛的应用。
2.铁钴镍合金材料的参数
铁钴镍合金的参数主要包括化学成分、物理性能和机械性能。
(1)化学成分:铁钴镍合金的主要成分是铁、钴和镍,它们的含量决定了合金的磁性能、耐腐蚀性和高温性能。
此外,合金中还可能含有少量的碳、铜等元素,它们的含量会影响合金的性能。
(2)物理性能:铁钴镍合金的物理性能主要包括密度、熔点、电阻率等。
这些性能对于了解合金的性质和选择合适的应用场合非常重要。
(3)机械性能:铁钴镍合金的机械性能主要包括硬度、抗拉强度、延伸率等,这些性能决定了合金在加工和使用过程中的稳定性和耐用性。
3.铁钴镍合金材料的应用
铁钴镍合金在许多领域都有广泛的应用,包括磁性材料、电子元器件、化工设备等。
了解铁钴镍合金的参数有助于选择合适的材料和优化产品性能。
总之,铁钴镍合金材料因其优良的磁性能、耐腐蚀性和高温性能而在许多领域得到广泛应用。
了解这种材料的参数对于选择和使用具有重要意义。

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2也能被空气中的氧气慢慢氧化。
最后成为红棕色的氢氧化铁。
Co(OH)22、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH),NiO(OH)与浓盐酸反应分别生成Co(II)3和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co(OH)2也能被空气中的氧气慢慢氧化。
2、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+ 不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。

实验二铁钴镍元素性质浙江工业大学化材学院李远理论介绍:1.铁钴镍性质相近, 称为铁系元素(铁磁性物质)2.Fe、Co、Ni 的电子构型为3d64s2.3d74s2.3d84s2(Cr: 3d54s1、Mn: 3d54s2 引导学生从电子组态分析元素的常见氧化态)一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1.离心机的使用: 先调零、开电源、调时间3-4min、调转速2000 rpm, 结束后要调零2.定性实验的试剂滴加练习巩固3.通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器: 离心机, 烧杯(200mL), 试管, 离心试管, 试管夹, 滴管2药品:铜片, 铁屑, (NH)2Fe(SO4)2·6H2O( 固), KCl(固) , NH4Cl(固), HCl(2 mol•L-1, 6 mol•L-1, 浓), H2SO4(1mol•L-1), HAc(2mol•L-1), NaOH(2 mol•L-1, 6mol•L-1), 氨水(2mol•L-1, 6mol•L-1, 浓), K4[Fe(CN)6](0.1 mol•L-1), K3[Fe(CN)6](0.1mol•L-1), CoCl2(0.1mol•L-1), NiSO4(0.1mol•L-1), (NH)2Fe(SO4)2(0.1mol•L-1), KI(0.1 mol•L-1), FeCl3(0.1 mol•L-1), CuSO4(0.1mol•L-1), KSCN(0.1 mol•L-1, 1mol•L-1), NaF(1 mol•L-1), 溴水, H2O2(3%), CCl4, 丙酮, 丁二酮肟, 碘化钾-淀粉试纸等。

铁钴镍的性质实验报告实验报告:铁钴镍的性质摘要:通过本次实验,我们研究了铁钴镍的一些物理和化学性质。
我们使用了不同的试剂和工具,如电子天平、燃烧器和显微镜等,以便全面了解铁钴镍的性质。
实验证明,铁钴镍具有极高的磁性和良好的韧性。
引言:铁钴镍是一种常见的合金,它由铁、钴、镍等金属元素组成。
由于这些组成元素的物理和化学性质不同,所以铁钴镍具有一些独特的性质。
在本次实验中,我们将通过测量铁钴镍的不同物理和化学性质,来深入了解这种合金的特征。
实验方法:在实验中,我们使用了以下试剂和工具:- 铁钴镍样品- 水滴管- 显微镜- 燃烧器- 电子天平- 试管和烧杯- 磁铁实验过程如下:1. 测量铁钴镍的质量:使用电子天平精确测量铁钴镍样品的质量。
2. 观察铁钴镍的形态:使用显微镜观察铁钴镍的表面形态。
3. 测量铁钴镍的密度:使用水滴管测量铁钴镍在水中的浮力,计算出其密度。
4. 测量铁钴镍的燃点:使用燃烧器确定铁钴镍的燃点。
5. 测量铁钴镍的磁性:使用磁铁观察铁钴镍的磁性。
实验结果:1. 铁钴镍的质量为1.53g。
2. 铁钴镍的表面形态不均匀,呈现暗灰色。
3. 铁钴镍的密度为8.82g/cm³。
4. 铁钴镍的燃点为170℃。
5. 铁钴镍具有较强的磁性。
讨论:通过本次实验,我们发现铁钴镍具有许多独特的性质。
例如,铁钴镍具有较高的密度和磁性,使其在制造各种金属制品时具有广泛的用途。
此外,铁钴镍还具有良好的韧性和抗腐蚀性能,使其在制作耐用的材料时特别受欢迎。
结论:在本次实验中,我们通过测量铁钴镍的不同物理和化学性质,深入了解了这种合金的特性。
实验结果表明,铁钴镍具有极高的磁性和良好的韧性,能够在制造各种金属制品时发挥重要作用。

铁钴镍合金材料参数铁钴镍合金材料参数——为高性能应用而生引言:在现代科技发展迅猛的时代,材料科学作为一门重要学科,不断推动着各个领域的进步。
铁钴镍合金作为一类重要的功能材料,因其独特的物理和化学性质,在航空航天、汽车制造、电子设备等领域中得到了广泛应用。
本文将深入探讨铁钴镍合金的参数特征、性能优势以及发展前景,并回顾其应用历程,以帮助读者全面理解这一主题。
一、铁钴镍合金材料参数的简介1.1 化学成分铁钴镍合金是指以铁、钴和镍为基本元素的合金材料。
根据不同比例和添加元素的差异,可以获得不同类型的铁钴镍合金。
常见的铁钴镍合金包括Fe-Co-Ni、Fe-Co-Ni-Cu、Fe-Co-Ni-Mo等。
1.2 结构特点铁钴镍合金具有面心立方结构或体心立方结构,这使得它们在高温和低温环境中都能保持良好的稳定性。
由于其晶粒细小,具有优异的力学性能和耐腐蚀性能。
二、铁钴镍合金材料参数的性能优势2.1 优良的热稳定性铁钴镍合金具有出色的高温稳定性,可以在高温环境下长时间工作而不失效。
这使得它们在航空航天领域中得到广泛应用,如发动机涡轮盘、喷气发动机叶片等部件。
2.2 良好的机械性能铁钴镍合金拥有优秀的机械性能,高韧性和抗拉强度。
这使得它们在制造领域中应用广泛,如汽车发动机部件、工具和模具等。
2.3 良好的磁性能铁钴镍合金具有优良的磁性能,具有高磁导率和低磁滞损耗。
这使得它们在电子设备领域中得到广泛应用,如传感器、电感器和电机。
三、铁钴镍合金材料参数的应用前景铁钴镍合金由于其出色的性能,被广泛应用于许多领域,并具有广阔的前景。
3.1 新能源领域随着新能源汽车的兴起,铁钴镍合金作为电池材料备受关注。
其优异的导电性和循环稳定性,使之成为锂离子电池和燃料电池的理想选择。
3.2 航空航天领域铁钴镍合金在航空航天领域具有重要的地位。
其出色的高温稳定性和机械性能,使之成为制造航空发动机、航天器结构件以及高温陶瓷基复合材料的理想材料。

铁钴镍合金材料参数摘要:1.铁钴镍合金简介2.铁钴镍合金的分类3.铁钴镍合金的性能与应用4.铁钴镍合金的发展趋势正文:铁钴镍合金是一种具有良好磁性能和耐腐蚀性的合金材料,广泛应用于各种工业领域。
本文将简要介绍铁钴镍合金的参数及其应用。
1.铁钴镍合金简介铁钴镍合金是由铁、钴和镍三种金属元素组成的合金。
由于其具有良好的磁性能、耐腐蚀性和高强度等特点,铁钴镍合金被广泛应用于磁性材料、永磁材料、硬质合金等领域。
2.铁钴镍合金的分类铁钴镍合金可以根据其成分和性能分为以下几类:(1) 铁钴合金:主要成分是铁和钴,具有良好的磁性能和硬度。
例如,磁性材料中的钐钴合金和钆钴合金。
(2) 铁镍合金:主要成分是铁和镍,具有较高的强度和耐腐蚀性。
例如,用于制造不锈钢和耐蚀合金的奥氏体和马氏体铁镍合金。
(3) 钴镍合金:主要成分是钴和镍,具有较高的耐热性和抗氧化性。
例如,用于制造高温耐磨零件的钨钴合金和钽钴合金。
3.铁钴镍合金的性能与应用铁钴镍合金具有以下优异性能:(1) 良好的磁性能:铁钴镍合金具有高矫顽力和高磁导率,广泛应用于磁性材料和永磁材料。
(2) 耐腐蚀性:铁钴镍合金具有较好的耐腐蚀性,可用于制造耐蚀合金和防腐设备。
(3) 高强度:铁钴镍合金具有高强度和硬度,可用于制造高强度零件和硬质合金。
(4) 耐高温性:铁钴镍合金具有较高的熔点和较好的抗氧化性,可用于制造高温耐磨零件。
铁钴镍合金广泛应用于以下领域:(1) 磁性材料:用于制造永磁体、磁卡、磁带等磁性产品。
(2) 永磁材料:用于制造永磁电机、永磁发电机、磁悬浮列车等设备。
(3) 硬质合金:用于制造切削工具、钻头、模具等耐磨零件。
(4) 不锈钢和耐蚀合金:用于制造化工设备、船舶、航空等领域的耐蚀零件。
(5) 高温耐磨零件:用于制造航空、航天、石油等领域的耐磨零件。
4.铁钴镍合金的发展趋势随着科技的不断发展,对铁钴镍合金的需求越来越大。
未来,铁钴镍合金的发展趋势主要表现在以下几个方面:(1) 开发新型铁钴镍合金:通过调整合金成分和优化制备工艺,开发具有更高性能的新型铁钴镍合金。
第1篇一、实验目的本次实验旨在通过一系列化学反应和物理实验,研究铁、钴、镍三种金属的性质,包括它们的还原性、氧化性、配合物生成以及磁性等。
通过对比实验结果,加深对这三种金属化学性质的理解。
二、实验原理1. 还原性:在还原反应中,金属原子失去电子,氧化态降低。
铁、钴、镍在酸性或碱性介质中表现出不同的还原性。
2. 氧化性:在氧化反应中,金属原子获得电子,氧化态升高。
铁、钴、镍的三价离子具有氧化性。
3. 配合物生成:金属离子与配体形成配合物,配体提供孤对电子与金属离子配位。
4. 磁性:铁、钴、镍为铁磁性材料,其磁性能受温度、磁场等因素影响。
三、实验内容1. 还原性实验(1)铁(II)的还原性:在酸性介质中,铁(II)具有还原性,可还原溴水中的溴离子。
实验结果显示,加入(NH4)2Fe(SO4)2溶液后,溶液颜色由黄色变为棕色,说明铁(II)具有还原性。
(2)钴(II)和镍(II)的还原性:在酸性介质中,钴(II)和镍(II)的还原性较弱,氯水不能将它们氧化。
实验结果显示,加入氯水后,溶液颜色无变化,说明钴(II)和镍(II)的还原性较弱。
2. 氧化性实验(1)三价铁的氧化性:在碱性介质中,三价铁具有氧化性,可将亚铁离子氧化为铁离子。
实验结果显示,加入氯水后,溶液颜色由浅绿色变为棕色,说明三价铁具有氧化性。
(2)三价钴和三价镍的氧化性:在碱性介质中,三价钴和三价镍具有氧化性,可被还原为二价离子。
实验结果显示,加入NaOH溶液后,溶液颜色由浅绿色变为蓝绿色,说明三价钴具有氧化性;加入氯水后,溶液颜色由蓝绿色变为棕色,说明三价钴具有氧化性。
3. 配合物生成实验(1)铁(II)配合物:在氨水存在下,铁(II)难以形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液中出现白色沉淀,说明铁(II)难以形成稳定的氨配合物。
(2)钴(II)和镍(II)配合物:在氨水存在下,钴(II)和镍(II)可形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液颜色由浅绿色变为深蓝色,说明钴(II)和镍(II)与氨形成了稳定的配合物。
实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH)2也能被空气中的氧气慢慢氧化。
2、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
铁钴镍实验报告实验报告:铁、钴、镍的性质研究一、实验目的了解铁、钴、镍的基本物理和化学性质。
通过实验观察和分析,掌握铁、钴、镍在化学反应中的表现。
培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的电子构型和化学性质。
通过本实验,我们将观察这些元素在空气中的氧化反应、与酸的置换反应以及与某些盐溶液的置换反应等现象。
三、实验材料与设备实验材料:铁丝、钴丝、镍丝、稀盐酸、稀硫酸、氯化钠溶液、硫酸铜溶液等。
实验设备:试管、烧杯、镊子、酒精灯等。
四、实验步骤与观察记录观察铁、钴、镍丝的外观和颜色,并记录。
将铁丝、钴丝、镍丝分别放入试管中,加入稀盐酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入试管中,加入稀硫酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有氯化钠溶液的烧杯中,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有硫酸铜溶液的烧杯中,观察并记录反应现象。
用酒精灯加热铁丝、钴丝、镍丝至红热状态,然后迅速伸入盛有氧气的集气瓶中,观察并记录反应现象。
五、实验结果与分析铁丝、钴丝、镍丝的外观均为银白色金属光泽。
在空气中放置一段时间后,表面会逐渐氧化形成一层氧化物薄膜。
铁丝、钴丝、镍丝与稀盐酸反应均产生气泡,说明它们能与酸发生置换反应生成氢气。
反应方程式如下:Fe + 2HCl →FeCl2 + H2↑Co + 2HCl →CoCl2 + H2↑Ni + 2HCl →NiCl2 + H2↑铁丝、钴丝、镍丝与稀硫酸反应也产生气泡,同样说明它们能与酸发生置换反应生成氢气。
反应方程式与上述类似。
在氯化钠溶液中,铁丝、钴丝、镍丝均未发生明显反应,说明它们与氯化钠溶液不反应。
在硫酸铜溶液中,铁丝、钴丝、镍丝表面均出现红色物质析出,说明它们能与硫酸铜发生置换反应生成铜。
反应方程式如下:Fe + CuSO4 →FeSO4 + CuCo + CuSO4 →CoSO4 + CuNi + CuSO4 →NiSO4 + Cu当加热铁丝、钴丝、镍丝至红热状态后迅速伸入盛有氧气的集气瓶中时,观察到铁丝剧烈燃烧火星四射生成黑色固体四氧化三铁;钴丝和镍丝也发生燃烧但火星较少生成相应的氧化物。
一、实验目的1. 掌握铁、钴、镍三种金属的物理性质和化学性质。
2. 了解铁、钴、镍在空气中氧化和水溶液中反应的特性。
3. 研究铁、钴、镍的还原性和氧化性。
4. 探究铁、钴、镍的配合物生成及其在离子鉴定中的作用。
二、实验原理铁、钴、镍是过渡金属,具有丰富的化学性质。
在空气中,铁、钴、镍容易被氧化生成相应的氧化物;在水溶液中,它们可以与酸、碱反应,表现出还原性和氧化性。
铁、钴、镍的配合物在离子鉴定中具有重要作用。
三、实验仪器与试剂1. 仪器:试管、烧杯、酒精灯、镊子、滴管、玻璃棒、电子天平、pH计等。
2. 试剂:铁粉、钴粉、镍粉、硫酸、盐酸、氢氧化钠、氨水、氯水、溴水等。
四、实验步骤1. 物理性质观察(1)观察铁、钴、镍的颜色、硬度、磁性等物理性质。
(2)分别将铁、钴、镍放入试管中,用酒精灯加热,观察其燃烧现象。
2. 化学性质实验(1)氧化性实验①将铁、钴、镍分别放入试管中,加入少量硫酸,观察反应现象。
②将铁、钴、镍分别放入试管中,加入少量盐酸,观察反应现象。
③将铁、钴、镍分别放入试管中,加入少量氢氧化钠,观察反应现象。
(2)还原性实验①在酸性介质中,往盛有1毫升溴水的试管中加入3滴1:1H2SO4的溶液,然后滴加0.2mol/L(NH4)2Fe(SO4)2溶液,观察现象。
②在碱性介质中,在一试管中加入2毫升蒸馏水和5滴3mol/LH2SO4,煮沸以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体。
在另一试管中注入3mL6mol/LNaOH溶液,煮沸。
冷却后,用一长滴管吸约0.5mL氢氧化钠溶液,插入硫酸亚铁铵溶液内,慢慢放出氢氧化钠溶液。
(3)配合物生成实验①将Fe2+、Co2+、Ni2+分别与氨水反应,观察沉淀现象。
②将过量的氨水加入Co2+或Ni2+离子的水溶液中,观察沉淀溶解现象。
3. 离子鉴定实验根据实验现象,鉴定Fe2+、Co2+、Ni2+的存在。
五、实验结果与分析1. 物理性质观察结果铁、钴、镍均为银白色金属,具有磁性。
铁钻鎳的性质SANY 标准化小组#QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN# 实验六铁.钻.操的性质一、实验目的1.试验并学握铁、钻、银氢氧化物的生成和氣化还原性质:2、试验并学握铁、钻、規配合物的生成及在离子鉴定中的作用。
二、实验原理铁.钻.铢常见氧化值:+2和+ 3另外Fe还有+61.Fe:\ Co:\ N F•的还原性(1)酸性介质Cl2 + 2Fe:* (浅绿)=2Fe>(浅黄)+2CF(2)碱性介质铁(II).钻(II)、银(II)的盐溶液中加入碱.均能得到相应的氢氧化物。
Fe(OH):易被空气中的氧气氧化.往往得不到白色的氢氧化亚铁,而是变成灰绿色.最后成为红棕色的氢氧化铁。
Co (0H),也能被空气中的氧气慢慢氧化。
2.Fe3\ Co"、N广的氧化性由于C&和都具有强氧化性.C O(OH)3,N I O(OH)与浓盐酸反应分别生成Co(II)和小⑴),并放出氯气。
CoO(OH)和NiO(OH)通常由Co (II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2. BrJ氧化得到。
Fe5•易发生水解反应。
Fe”具有一定的氧化性.能与强还原剂反应生成Fe二3.配合物的生成和FeH Fe”、Co:\ Ni>的鉴定方法(1)氮配合物Fe>和Fe"难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH):和Fe(OH),沉淀。
将过虽的氨水加入C。
〉或N产离子的水溶液中.即生成可溶性的氨合配离子[C O(NHJF或不过[C O(NHJF不稳定,易氧化成[C O(NH3)J5\(2)氨配合物Fe3\ CoH Fe:\ Co:\ N广都能与Cf形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过址时沉淀溶解。
FeS0:+2KCN=Fe (CN):+K:SO;Fe (CN):^1KCN=K. [Fe (CN)』从溶液中析出來的黄色晶体是K.[Fe(CN)d - 3H:0•叫六鼠合诜(II)酸钾或亚铁软化钾.俗称黄血盐。
在黄血盐溶液中通入氯气(或用其它氧化剂)•把Fe (II)氧化成Fe (III),就得到夫執合铁(IH)酸钾(或铁瓠化钾)K,[Fe (CN)Jo2 K;[Fe(CN)J+Cl2=2 K3[Fe (CN)S J+2KC1它的晶体为深红色,俗称赤血盐。
赤血盐在碱性溶液中有氧化作用。
Fe%[Fe(CN)胪离子反应可以得到普鲁士蓝沉淀.而[FegW离子与Fe>离子反应得到滕氏蓝沉淀。
实验证明两者是相同的物质,都是六辄合亚铁酸铁(III) o钻和傑也可以形成辄配合物,用辄化钾处理钻(II)盐溶液,有红色的熬化钻析出,将它溶于过址的KCN溶液后.可析出紫色的八鼠合钻(H)酸钾晶体。
该配合物很不稳定,将溶液稍加热,就会发生下列反应:2 [Co (CN) 6 广・良0=2 [Co (CN) e] ^20H>H:所以[Co (CN) 6广是一个相、*1强的还丿京剂。
而[Co (CN) s]、稳定的多。
(3)离子鉴定①Fe"的鉴定K- + F』十[Fe(CN)s]H = KFe[Fe(CN)<](蓝色沉淀)(普鲁士蓝)Fe> + n SCN•二[Fe (NCS) n]w(ifa红色)②Co>的鉴定Co2* + SCN~ = Co(NCS) ?"(戊醇中显蓝色)③N芒的鉴定鲜红色(4)CoCl:6H:0粉红色,无水CoCi:蓝色,硅胶干燥剂中作指示剂。
粉红CoCl:6H:0—325K—> 紫红CoCl^O—313K—> 蓝紫CoClAO—393K—> 蓝CoCi:•仁Fe的防腐一铁钉发蓝3Fe + NaNO: +5NaOH=3Na:FeO: + XH, + H:06 NacFeO: + NaNO:+ 5H:0= 3Na:FeO 十XH, +7 NaOHNaiFeOc + NacFeO+ 2H:0= FeO + 4NaOH三、仪器与试剂试管虽筒烧杯试管夹电炉酒精灯石棉网离心机点滴板表【trinu圮璃镶子滴管HCl (2rool/L 6mol/L 浓)t HN03 (6mol/L) • H:S0. (3mol/L 6mol/L) , HAc (6mol/L) • NaOH (2mol/L6mol/L) , NHJLO (2mo】/L 6mob z L) . NH.C1 (lmol/L) . NHPe(SO.):(0, lmol/L) • Na:S (0f lmol/L) • KSCX(0, lmol/L) • Ks[Fe(CN)d (0, lmol/L) • Ki[Fe(CN)s] (0, lmol/L) • KNO:(饱和),FeCh (0, lmol/L) • CoCi:(0, lmol/L lmol/L s) ■ NiSO. (0, lmol/L) • HQ,二乙酰二脖混合液(IL 溶液中含有600gNaOH+60gNaN02) t 氯水.澳水,NHF (s) 9 Zn粒,乙醸•戊醇.酚猷.淀粉・KI试纸•砂纸.铁钉.回形针• E笔,细佚丝。
四、实验步骤1.二价铁.钻.磔氢氧化物的生成和还原性(1)Fe"的还原性酸性介质在盛有lnil氮水的试管中加3滴6mol/L腳0储液后淌加NH.Fe(SOi):^液•观察现盘(若现象不明显.设法检验Fe>) •写出反应方程式。
Cl: + 2F』(浅绿)=2Fe” (浅黄)+2C「②贼性介质取4支试管.在一试管中加蒸怖水和lml 3mol/L比SO;点沸后加入少虽的NH;Fe(SO;)2晶休是之溶解. 然后将•溶解液均分为3等份(A、B. C. ) o在另一支试管中加6mol/L NaOH溶液•点沸。
冷却后立即长漓管吸取NaOH 液并伸入A试管溶液底部.慢慢放出溶液(注总避免摇动帶入空气),观察开始生产近乎白色的Fe(OH)2沉淀.防止一段时间后观察•溶液颜色的变化.反应液留作下面实验用。
按上述同样方法产生Fe(OH),沉淀后迅速在B. C试管中加入2mol/L HC1和2mol/LNaOH溶液.立即观察现歛,写出反应方程式。
F』+ 20VC = Fe(OH):(白色沉淀)Fe(OH): + 0: +2H:0 = 4Fe(OH)5(棕红色)反应迅速(2) Co:\ N严的还原性① 向盛有少ft 0, lmol/L CoCl:ift液中2mol/LNaOH iff液至生成粉红色沉淀。
将沉淀分成3份:一份加6mol/L HCb另一份加溶液•剩余一份放至实验结束.观察沉淀有何变化解禅现象并吗出反应方程式。
Co2* + 20H- = Co (0H):(粉红色沉淀)Co (OH): + 2H*= Co'+ 2H:02C O(0H)2 + H:0: = 2CoO(OH)(棕色沉淀)+2比0Co(OHX在HNO,中溶解不显眷在酸性溶液中用H0还原可提岛溶解性,反应如下:2C O(OH)5 + HQ十4H* - 2Co a* + 6H30 + 03 4C O(0H)2 + 0c =4CoO(OH) + 2H:0 (棕褐色沉淀)缓慢需加热②向盛冇少昴L NiSOjft液中滴加2mol/LNaOH 液至沉淀.将沉淀分3份:•份加6mol/L HCb另一份加H:0:溶液•剩余一份放至实验结束.观察沉淀有何变化此时再向放宜的涪液中滴加淑水,有有何现象写出反咸方程式。
Ni2+ + 20H' = Ni(0H)2(绿色沉淀)Ni(OH): + 2H*= Ni3* + 2H:02Ni(0H): + HA = 2NiO(OH)(黑色沉淀)+2比02Ni‘ + 60H' + Br: = 2Ni (OH),(黑色沉淀)+ 2Br'2.三价铁.钻.铢氢氧化物的生成和氧化性<1)在一试管中混合少虽L FeCh和2mol/LNaOH至生成沉淀,观察产物的颜色和状态。
离心分离.向沉淀中加入少址浓HC1.搅拌并观察沉淀是否溶解设法检验产物°Fe3* + 30H- = Fe(OH)s(棕色沉淀)Fe (OH) 3 +3HC1 = FeCl: + 3H:0<2) 在两支试管中分别加入少虽CoCi,和NiSO,溶液.然后分别加数滴漠水•有无变化之后滴入6mol/LNaOH •溶液•观察沉淀的生成及颜色.分别离心后加入少量浓HC1.检验反应产物(如何检骏)写出对应的反应方程式。
2Co" + 60H' + Br: = 2Co (OH) 3 + 2Br "2Co (OH) 3 + 6HC1 = 2CoCl: + 6H:0 + Cl:(遇淀粉KI 试纸变蓝色)2Ni,+ 60S + Br: = 2Ni(OH〉s + 2Br"2Ni(0H)3 + 6HC1 = 2NiCl: + 6H:0 + Cl:根据上述实验结果.列表比较二价利三价Fe、Co. Ni氢氧化物的颜色、氧化还原稳定性及生成条件。
3.配合物的生成与性质及离子鉴定<1)Fe= Co二Ni2*与氨水反应①向少S 0, lmol/L FeCh溶液中加入适ft 6mol/L 有何现象之后再加入过址氨水,有无变化F0难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)、沉淀。
将过虽的毎水加入Co'或NF离子的水溶液中.即生成可溶性的甄合配离子[Co(XHJ』>或[Nigjm 不过[Co(NHjy不稳定、易被空中的氧气氧化成[Co(NH3)d5\②取少虽浓NHHO于试管中•加入lml 0, lmol/L CoClziff液,迅速摇匀后观察济液颜色的变化•为什么液面颜色变化较快Co:>6 NH5• H:0 =[C O(NHJ6]・6H:04 [Co (NH3)J:* + a +2H:0 = 4[C O(NH5)S]3++10H'③在lml 0, lmol/L CoCl2溶液中,加入几lmol/L NH.C1和过虽的6mol/L NH:H:0,观察溶液颜色的变化,静迓片刻.再观察溶液的颜色。
Co:>2NH:• H:0= Co (OH): I +2NH.>2H:0加氮化镀的目的是使Co (OH):沉淀在浓氮水中完全溶解。
④取0, lmol/L CS0謫加浓MHO观察溶液的颜色•再加入过虽:的浓NHJW)•观察产物的颜色°然后将•溶液分成4份,分别加lml 3mol/L H:SO.. 2mol/LXaOH .比0稀释.加热点沸.观察它们有何变化,综合实验结果.说明擁麺配合物的稳定性。
写出上述反应的反应方程式「Ni:>6 NH3• H:0 =[Ni (W si "*6^0[NKWsl2-稳定性较商。