15年版微生物原始记录(3)资料
- 格式:doc
- 大小:58.50 KB
- 文档页数:4

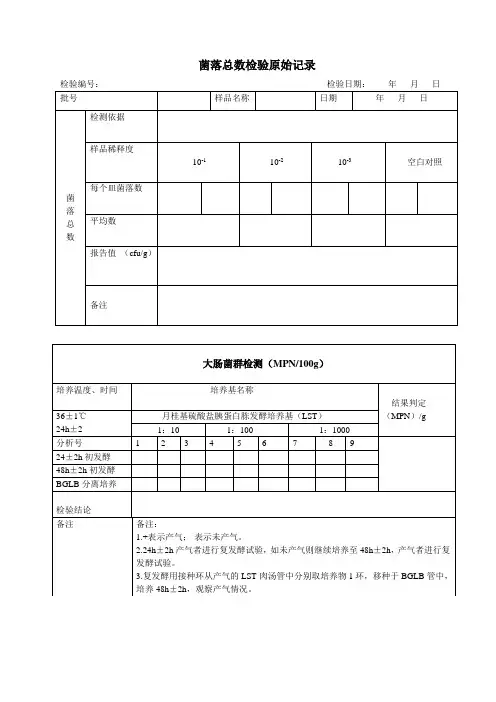


微生物检测原始记录菌落总数与大肠菌群检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:一、菌落总数cfu/ml(g) 培养基名称:培养温度:培养时间:年月日时--- 年月日时稀释倍数空白∕稀释液对照-1 10-2 10-3 10-4原液10平板1平板2平均值检测结果:二、大肠菌群MPN/100ml (g)培养基名称:培养温度:培养时间:年月日时--- 年月日时LST 发酵1ml × 3 0.1ml × 3 0.0 1ml × 3初发酵结果复发酵试验检测结果主检:年月日校核:年月日菌落总数和大肠菌群检测原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:检验依据GB4789.2-2010 GB4789.3-2010一、菌落总数cfu/ml(g) 培养基名称:培养温度:36±1℃培养时间:年月日时--- 年月日时样品数样1 样2 样3 样4 样5稀释倍数平板 1 平板 2 平板 1 平板 2 平板1 平板2 平板1 平板 2 平板1 平板2原液-110-210-310-410空白对照检验结果二、大肠菌群cfu/ml(g) 培养基名称:培养温度:36±1℃培养时间:年月日时--- 年月日时样1 样2 样3 样4 样5 样品数平板 1 平板 2 平板 1 平板 2 平板1 平板2 平板1 平板 2 平板1 平板2 稀释倍数原液-110-210-310-410空白对照验证试验检验结果主检:年月日校核:年月日XXXX检测有限公司水质微生物检验原始记录共页第页样品名称样品编号设备名称检验环境温度:湿度:检验依据一、菌落总数cfu/ml(g) 培养温度:36±1℃-1 10-2 10-3 10-4 10-5 稀释倍数原液10平板 1平板 2平均值检测结果:二、总大肠菌群MPN/100ml (g)培养温度:36±1℃培养时间:LST 培养基10ml ×1ml ×0.1ml ×0.01m l×发酵结果验伊红美蓝琼脂平板证试革兰氏染色乳糖复发酵验检测结果三、大肠埃希氏菌MPN/100ml (g)验自总大肠菌群乳糖发酵试样中的阳性管中取一滴转接伊红美蓝琼脂平板证种与EC 培养基中置44.5℃培养24 小时观察试验四、耐热大肠菌群MPN/100ml (g)将总大肠菌群多管发酵法初发酵或产气的管中验培养后的EC-MUG 管在暗处用用无菌金属接种环将试液接种到EC-MUG 管中波长366nm 功率为6W 的紫外光证置44.5℃培养24 小时观察灯照射试验主检:年月日校核:年月日乳酸菌与大肠菌群检测记录共页第页样品名称样品编号仪器设备名称检验环境温度:湿度:检验依据一、乳酸菌cfu/ml(g) 培养温度:36±1℃培养时间:稀释倍数原液10-3 10-4 10-5 10-6 10-7平板1平板2平均值检测结果:二、大肠菌群MPN/100ml (g)培养温度:培养时间:年月日时--- 年月日时LST 发酵1ml × 3 0.1ml × 3 0.0 1ml × 3发酵结果伊红美蓝琼脂平板验证试验革兰氏染色乳糖复发酵检测结果主检:年月日校核:年月日致病菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:致病菌培养温度:培养时间:年月日时 ---年月日时金黄色葡萄球菌25g 样品+225ml7.5% (定性检验)氯化钠肉汤,均质检验依据:将上述培养物,分别划线接种到涂片染色观察溶血血浆凝固酶试验Baird-Parker 和血平板实验现象检测结果前增菌增菌分离沙门氏菌将上述培养物, 25g样品检验依据:+225mlBPW ,均质分别取 1ml 转接种于 10mlTTB 与 10mlSC 内,进行前增菌再次将上述培养物,分别划线接种于 BS 琼脂平板 XLD 琼脂平板生化试验实验现象检测结果志贺氏菌检验依据:25g 样品+225ml GN 增菌液将上述培养物分别划线接种于HE 平板和 EMB 平板划线接种 TSI, 葡萄糖半固体生化试验实验现象检测结果25g 样品+225ml 生理溶血性链球菌盐水,吸取 5ml 接种于50ml 葡萄糖肉汤曾涂片染色观察溶血血浆凝固酶试验检验依据:菌,划线接种于血平板实验现象检测结果主检:年月日校核:年月日霉菌和酵母菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:培养基名称培养温度:28±1℃培养时间:年月日时--- 年月日时:观察培养培养温度观察时间观察结果第1 天第2 天第3 天第4 天第5 天观察结论:菌落计数:培养温度:28±1℃培养时间:年月日时--- 年月日时-1 稀释倍数空白∕稀释液对照原液10-210-310-410平板 1平板 2平均值检测结果主检:年月日校核:年月日商业无菌检验原始记录共页第页样品名称样品编号仪器名称检验环境温度:湿度:仪器编号检验依据1、保温试验:将完整试样一份置于36±1℃培养箱保温十天,每天观察胖听、泄漏现象。

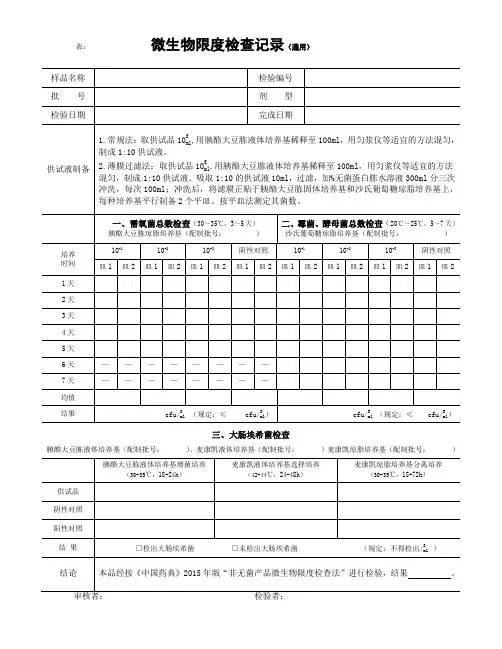
表:微生物限度检查记录(通用)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)三、控制菌检查(30-35℃)表:胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)(30℃~35℃)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)表:(含药材原粉的片剂)胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: )(30℃~35℃)胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: )五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )表:微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)表:微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)表:微生物限度检查记录(内包材)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)。

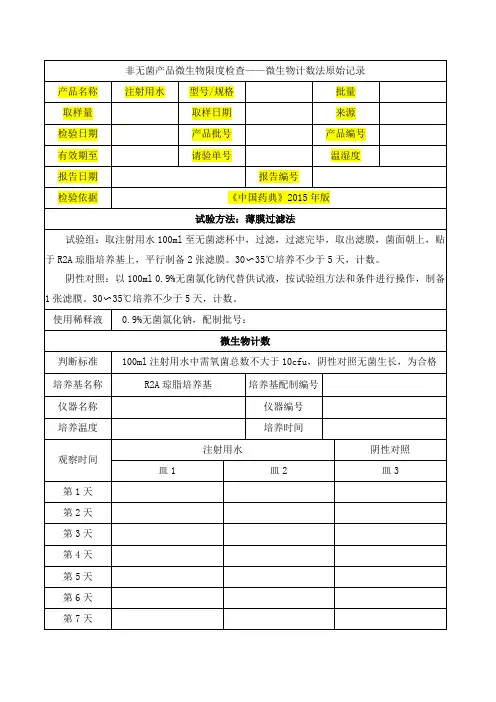
微生物限度检查记录(二)编号:SMP-09-00702-e-1检品名称:检品规格:检品批号:取样日期:检验日期:报告日期:检验依据:《中国药典》2015年版四部《非无菌产品微生物限度检查》仪器:隔水式恒温培养箱型号:编号:RHBC-ZK- 霉菌培养箱型号:编号:RHBC-ZK-恒温培养箱型号:编号:RHBC-ZK-1、需氧菌、霉菌和酵母菌供试品制备:取供试品 g,加稀释液 ml,用适宜的方法混匀,作为1:10供试品溶液。
取1:10供试品溶液1ml,加稀释液至10ml,得到1:100供试品溶液。
取1:100供试品溶液1ml,加稀释液至10ml.得到1:1000供试品溶液。
按薄膜过滤法进行检查。
(稀释液,冲洗液:0.9%无菌氯化钠-蛋白胨缓冲液)观察结果:需氧菌数30~35℃培养3~5天霉菌、酵母菌数20~25℃培养5~7天胰酪大豆胨琼脂培养基,批号:沙氏葡萄糖琼脂培养基,批号:取上述1:10的供试液10ml,接种至胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24小时。
取上述培养物1ml接种于100ml麦康凯液体培养基中,42~44℃培养24~48小时。
取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72小时。
观察结果:取供试品,用胰酪大豆胨液体培养基作为稀释剂制成1:10供试液,混匀,在20~25℃培养约2小时。
取上述预培养物10ml接种至100ml肠道菌液体培养基中,30~35℃培养24~48小时后,划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24小时。
取相当于0.1g、0.01g和0.001g(或0.1ml、0.01ml和0.001ml)的供试品的预培养物接种至 ml的肠道菌液体培养基中,30~35℃培养24~48小时。
取上述培养物分别划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24小时。
观察结果:取供试品10g或10ml,直接接种到200ml胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24小时。

菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
培养温度:28±1℃培养时间:年月日时 --- 年月日时:
菌落计数:
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
微生物检测原始记录 Prepared on 22 November 2020
X X X X检测有限公司菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页第页
XXXX检测有限公司水质微生物检验原始记录
共页第页
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司致病菌检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 --- 年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
【性状】㈠.外观性状1.检验结果:本品为。
2.标准规定:本品为白色至微黄色的结晶或结晶性粉末;有微臭。
本品在乙醇中略溶,在水或三氯甲烷中微溶,在乙醚中极微溶解。
3.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈡.熔点1.仪器:熔点仪型号、编号鼓风干燥箱型号、编号2.操作:取供试品适量,研细,置105℃干燥,然后分取供试品粉末适量,置熔点测定用毛细管中,借助长短适宜的洁净玻璃管,垂直放在实验台面上,将毛细管自上口放入使自由落下,反复数次,使粉末紧密集结在毛细管的熔封端直至装入供试品的高度为3mm。
俟熔点仪温度上升至149℃时,将装有供试品的毛细管浸入传温液中部;继续加热,调节升温速率为每分钟上升1.0~1.5℃,记录供试品在初熔至全熔时的温度,重复测定3 次,取其平均值,即得。
3.检验结果:①℃~℃②℃~℃③℃~℃(极差≤0.5℃)平均值= ℃~℃4.标准规定:熔点为159℃~163℃。
5.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈢.吸收系数1仪器:电子天平型号、编号紫外-可见分光光度计型号、编号2.试剂:盐酸溶液(9→1000)配制批号3.操作:取本品,精密称取约16.3mg,置50ml量瓶中,加盐酸溶液(9→1000)溶解并稀释至刻度,摇匀,精密量取2ml,置50ml量瓶中,加盐酸溶液(9→1000)稀释至刻度,摇匀制成每1ml中约含13μg的溶液,照紫外-可见分光光度法,在277nm的波长处测定吸收度,吸收系数(E%11cm)为365~389。
AV4.计算公式及结果:E%11cm =----------100WW = g A = V(稀释倍数)=E%1= =1cm)为365~389。
5.标准规定:吸收系数(E%11cm6.结论:□符合规定□不符合规定检验人/日期:复核人/日期:【鉴别】㈠ .1.仪器:电子天平型号、编号2.试剂:氢氧化钠试液配制批号稀盐酸配制批号3.操作及结果:取本品 mg(约10mg),加氢氧化钠试液2ml,微温,即得溶液(应为紫红色);滴加稀盐酸使酸性后即变成(应为黄色),再滴加过量氢氧化钠试液则变成(应为橙红色)。
15年版微生物原始记
录(3)
四川诺迪康威光制药有限公司
微生物限度检验原始记录(3)
:选择方法
(1)平皿法:取本品于 mlPH7.0无菌氯化钠—蛋白胨缓冲液中,溶解或稀释,制成1:10供试液备用。
取1:10供试液1 ml 于1个无菌平皿中,按平皿法测定其菌数。
每稀释剂每种培养基至少制备2个平皿。
(2)培养基稀释法:取本品于 mlPH7.0无菌氯化钠—蛋白胨缓冲液中,溶解或稀释,制成1:10供试液备用。
取1:10供试液1 ml于()个无菌平皿中,按平皿法测定其菌数。
(3)薄膜过滤法:取本品于 ml PH7.0无菌氯化钠—蛋白胨缓冲液中,混匀,过滤,冲洗后取出滤膜,菌面朝上贴于培养基平板上培养。
沉降菌落数:超净工作台:左中右,空白对照生物安全柜:左中右,空白对照
2
大肠埃希菌检查:结束培养时间:月日时菌株编号:CMCC(B)44102
耐胆盐革兰阴性菌检查:结束培养时间:月日时菌株编号:CMCC(B)44102
沙门菌检查:结束培养时间:月日时菌株编号:CMCC(B)50094
铜绿假单胞菌检查:结束培养时间:月日时菌株编号:CMCC(B)10104
金黄色葡萄球菌检查:结束培养时间:月日菌株编号:CMCC(B)26003
活螨:未检出()检出()
结论:本品所检项,结果符合规定()不符合规定()。
检验者:复核者:。