盐的化学性质优质课件
- 格式:ppt
- 大小:2.58 MB
- 文档页数:10


初中常见盐的化学性质引言:在我们的日常生活中,盐是一个非常常见的物质。
无论是在烹饪、食物调味还是在实验室中进行化学实验,盐都扮演着重要的角色。
本文将探讨在初中化学课程中常见的盐的化学性质。
了解这些性质不仅有助于我们理解化学实验和现象,还有助于应用到我们的日常生活中。
一、盐的定义盐是由阳离子和阴离子通过离子键结合而成的化合物。
在化学中,阳离子可以是金属离子或氢离子,而阴离子则可以是非金属离子或氧化物离子。
盐可以具有各种不同的化学性质,取决于阳离子和阴离子的组合。
二、酸碱中和反应盐在酸碱中和反应中扮演着重要的角色。
在酸碱中和反应中,酸和碱通过反应产生一个盐和水。
这是由于酸中的氢离子和碱中的氢氧根离子结合形成水,而阳离子和阴离子结合形成盐。
例如,盐酸和氢氧化钠反应产生氯化钠和水的化学方程式如下:HCl + NaOH → NaCl + H₂O这种中和反应是实验室制备盐的常见方法之一。
三、盐的溶解性盐的溶解性也是其重要的化学性质之一。
溶解性取决于盐的化学成分和溶剂的性质。
在一般情况下,大多数盐在水中可溶解。
但也有一些盐具有较低的溶解度,例如银氯化物和铁(III)氰化物等。
溶解性是化学实验中经常遇到的一个重要概念,因为它可以影响到反应的进行和结果的观察。
四、热稳定性盐的热稳定性指的是在加热条件下盐的稳定性。
某些盐在加热下会发生分解,释放出相应的气体。
例如,氯化铵在加热时会发生分解产生氨气和盐酸气体的反应:NH₄Cl → NH₃ + HCl这种热分解的反应在化学实验中经常遇到。
五、化学反应和性质应用盐不仅在实验室中发挥作用,它们还有很多实际应用。
一些盐具有除湿的性质,因为它们可以吸收水分。
氯化钙是最常见的除湿剂之一。
盐也可以在烹饪过程中用作调味料,例如氯化钠(普通盐)。
此外,一些盐还具有草酸铵(NH₄C₂O₄)和硝酸银(AgNO₃)等具有一些特殊反应性的盐。
结论:初中化学课程中,我们学习和了解了许多常见盐的化学性质。







盐的性质•盐的定义:盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。
根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盆分为硫酸盐、碳酸盐,硝酸盐等。
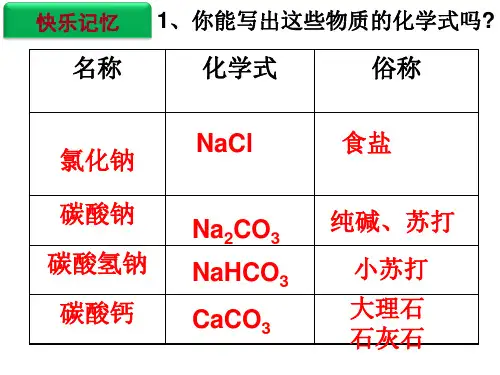
生活中常见的盐有:氯化钠(NaCl),碳酸钠(Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。
•盐的物理性质:(1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。
但是有些盐有颜色,其水溶液也有颜色。
例如:胆矾(CuSO4·5H2O)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。
(2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫酸盐除钡银钙(含SO42-的盐中,Ag2SO4, CaSO4微溶,BaSO3难溶)都易溶;氯化物中银不溶(含Cl-的盐中,AgCl 不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,Na2CO3、(NH4)2CO3、K2CO3易溶,Na2CO3微溶,其余难溶〕。
盐的化学性质:(1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO4==FeSO4+Cu规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(K, Ca,Na除外)。
应用:判断或验证金属活动性顺序和反应发生的先后顺序。
(2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO3==AgCl↓+HNO3。
规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。
盐是碳酸盐时可不溶,若是其他盐,则要求可溶。
应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。
(3)盐+碱→另一种盐+另一种碱(复分解反应)规律:反应物都可溶,若反应物中盐不为按盐,生成物其中之一为沉淀或水。