重磅 Keytruda获批治疗纵膈大B细胞淋巴瘤!
- 格式:doc
- 大小:13.24 KB
- 文档页数:2

最新:奥布替尼治疗B细胞淋巴瘤中国专家推荐临床应用指导原则(全文版)摘要Bruton酪氨酸激酶(BTK)抑制剂作为小分子靶向药物,目前已经被批准用于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤和华氏巨球蛋白血症等的治疗。
奥布替尼是首创新药,于2020年12月25日获批上市,其在临床实践中的应用数据尚待完善。
为了进一步规范奥布替尼在B细胞淋巴瘤中的临床应用,专家组成员结合BTK抑制剂的应用现状及已经公布的奥布替尼相关研究数据,制定了该临床应用指导原则,供临床医生参考使用。
以伊布替尼为代表的Bruton酪氨酸激酶(BTK )抑制剂为B细胞淋巴瘤的治疗带来了突破性进展,但现有BTK抑制剂存在脱靶效应导致的安全性差、靶点抑制不稳定、不完全等临床未解决的问题。
我国首创了新型BTK 抑制剂奥布替尼,其分子结构进一步优化,具有更小的空间夹角、更少的较链区H键结合位点,去除了手性中心,提高了激酶选择性,对BTK以外的靶点作用极低,临床研究中未发生3级及以上心房颤动,3级及以上出血和腹泻等因脱靶效应导致的不良反应发生率低,耐受性好,由不良反应导致的停药患者比例仅为4.7%~7∙5%[1]0奥布替尼通过固体分散体制剂技术,提高了药物的溶解性,保障药物在150 mg∕次、1次/d的治疗剂量下,对患者外周血单核细胞(PBMC) BTK靶点24 h内接近100%持续抑制,BTK靶点占有率个体差异小,有效地避免了因靶点占有率个体差异导致的部分患者疗效不佳现象。
与其他已上市BTK抑制剂相比,奥布替尼治疗复发难治慢性淋巴细胞白血病(CLL )/小淋巴细胞淋巴瘤(SLL )时,缓解得更早,效果更佳[中位随访25.6个月,患者总有效率(ORR )达93.8% ,完全缓解(CR )/伴骨髓恢复不完全的完全缓解(CRi)率达21.3%][2];奥布替尼治疗复发难治套细胞淋巴瘤(MCL )的缓解效果亦较佳[中位随访23.2个月,患者ORR达87.9% , CR/不确定的完全缓解(CRU)率达37.3%][3]o1奥布替尼简介1.1 奥布替尼药物结构作为新型不可逆共价结合的BTK抑制剂,奥布替尼在第一代BTK抑制剂基础上进行了结构优化,其具有更小的空间夹角,三维结构与BTK活性中心更匹配,提高了BTK的激酶抑制性和选择性;其采用单环母核,减少了皎链区H键结合位点,降低与其他激酶结合的可能,去除手性中心,减少空间构象(图」),从而避免与其他激酶的相互结合,提高了激酶选择性。

美国FDA批准默沙东PD-1抑制剂KEYTRUDA用于完全切
除后淋巴结转移的黑色素瘤患者
药品资讯网
【期刊名称】《临床合理用药杂志》
【年(卷),期】2019(0)5
【摘要】近日,默沙东宣布,美国FDA基于EORTC1325/KEYNOTE-054的试验结果,批准了其PD-1抑制剂KEYTRUDA用于完全切除后淋巴结转移的黑色素瘤患者。
此项与欧洲癌症研究与治疗组织(EORTC)合作进行的关键性临床3期试验是一项
多中心、随机、双盲、安慰剂对照试验,用于完全切除的ⅢA期(> 1 mm淋巴结转移)、ⅢB或ⅢC黑色素瘤患者。
患者须接受淋巴结清除术,视病情在治疗前13周
内进行放射治疗。
【总页数】1页(P103-103)
【作者】药品资讯网
【作者单位】不详
【正文语种】中文
【中图分类】R979.1
【相关文献】
1.美国FDA批准默沙东Keytruda(可瑞达):用于Ⅱ B/Ⅱ C/Ⅲ期黑色素瘤术后辅助
治疗2.FDA批准默沙东重磅抗PD-1疗法Keytruda治疗晚期/转移性非小细胞肺
癌3.欧盟批准默沙东PD-1免疫疗法Keytruda用于晚期黑色素瘤成人患者4.默沙
东PD-1免疫疗法Keytruda获FDA受理其补充生物制品许可5.FDA批准默沙东PD-1肿瘤免疫疗法Keytruda用于治疗肝细胞癌患者
因版权原因,仅展示原文概要,查看原文内容请购买。

原发纵隔大B细胞淋巴瘤诊断与治疗中国专家共识(2024年版)原发纵隔大B细胞淋巴瘤(primary mediastinal large B cell lymphoma, PMBL)是一种起源于纵隔的成熟侵袭性大B细胞淋巴瘤,影像学上多为纵隔巨大肿物,而淋巴结和骨髓受累少见。
因PMBL具有独特的临床、病理及分子学特征,2001年WHO造血与淋巴组织肿瘤分类将其明确归类为大B细胞淋巴瘤的一个独立亚型并保留至今。
近年来,对PMBL发病机制的认识及治疗均有不同程度的更新,特别是新药治疗领域取得了较大进展。
为提高我国临床医师对PMBL的诊断及治疗水平,中华医学会血液病学分会淋巴细胞疾病学组和中国临床肿瘤学会(CSCO)淋巴瘤专家委员会组织相关专家组根据国际上相关指南及循证医学研究结果,讨论并制定本共识。
一、概述根据中国淋巴瘤病理研究协作组发布的数据,我国PMBL的患者占B细胞非霍奇金淋巴瘤比例约为3.74%,占大B细胞淋巴瘤比例约为6.94%,与西方国家类似。
基于美国国家癌症研究所SEER数据库分析表明,PMBL发病率有逐年增加的趋势,女性居多,男女比例为1∶2,诊断时中位年龄约为35岁。
初诊患者病灶多局限于胸腔内,远处累及相对少见。
国内一项回顾性研究显示,我国PMBL患者5年无进展生存(PFS)率及总生存(OS)率分别为69%和75%,略低于欧美国家。
二、临床表现临床症状和体征多与快速增长的纵隔肿块相关,肿块可局部浸润至锁骨上淋巴结,也可通过胸腔延伸至肺、胸壁、心包和胸膜间隙等部位。
患者发病初期常无明显症状,当肿块增大致气管、食管、肺等组织器官受压时,可表现出相应的临床症状,如刺激性干咳、吞咽不适及胸闷气促等不适;当压迫上腔静脉时,可出现上腔静脉综合征,表现为颈面部、胸背部及上肢水肿。
B症状包括发热、盗汗和体重减轻较为常见,胸腔积液和心包积液发生率约为30%。
胸腔外部位累及在初诊时非常罕见,但在复发时常见。
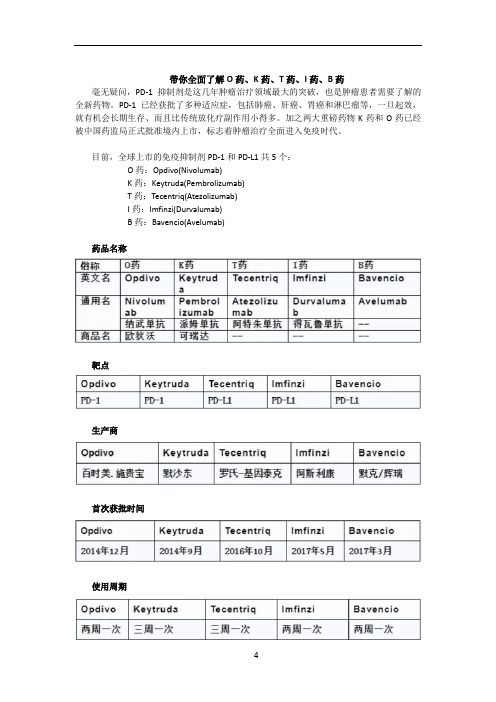
带你全面了解O药、K药、T药、I药、B药毫无疑问,PD-1抑制剂是这几年肿瘤治疗领域最大的突破,也是肿瘤患者需要了解的全新药物。
PD-1已经获批了多种适应症,包括肺癌、肝癌、胃癌和淋巴瘤等,一旦起效,就有机会长期生存、而且比传统放化疗副作用小得多。
加之两大重磅药物K药和O药已经被中国药监局正式批准境内上市,标志着肿瘤治疗全面进入免疫时代。
目前,全球上市的免疫抑制剂PD-1和PD-L1共5个:O药:Opdivo(Nivolumab)K药:Keytruda(Pembrolizumab)T药:Tecentriq(Atezolizumab)I药:Imfinzi(Durvalumab)B药:Bavencio(Avelumab)药品名称靶点生产商首次获批时间使用周期剂型规格使用剂量适应症国内上市情况价格关于PD-1的几大问题1.疗效如何?在绝大多数、未经挑选的实体瘤中,单独使用PD-1抑制剂的有效率只有10%-30%左右。
唯一的例外,是经典型霍奇金淋巴瘤,有效率突破60%以上。
究其受到追捧的原因是:PD-1抑制剂疗效的持久性。
由于免疫系统具有记忆功能,因此一旦PD-1抑制剂起效,其中部分病友实现临床治愈,也就是说五年、十年不复发、不进展、长期生存,尤其是较早的恶性黑色瘤、肾癌以及非小细胞肺癌。
2.如何预测疗效?1)PD-L1表达:PD-L1表达越高,有效率越高。
PD-L1表达,在肺腺癌、恶性黑色瘤等肿瘤中,格外有用。
PD-L1表达超过50%的晚期非小细胞肺癌,可以直接首选单独的PD-1抗体K药治疗,有效率在40%上下。
2)MSI检测:MSI-H的消化道肿瘤,有效率可以达到50%左右。
MSI检测特别适合消化道肿瘤、子宫内膜癌等患者。
3)肿瘤基因突变负荷(TMB)检测:一般认为,TMB大于20个突变/Mb,就是TMB 高。
TMB高的患者,接受PD-1抑制剂治疗的有效率高、生存期长。
4)肿瘤浸润淋巴细胞(TIL)检测:浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。

2.1FDA批准的PD-L1表达检测相关信息参见:/CompanionDiagnostics.2.2⿊⾊素瘤推荐剂量:推荐剂量的KEYTRUDA为2mg / kg30分钟内静脉滴注给药,每3周为⼀个周期,直到疾病进展或不可接受的毒性。
2.3 ⾮⼩细胞肺癌、头颈部肿瘤及成⼈经典霍奇⾦淋巴瘤推荐剂量:推荐剂量的KEYTRUDA为200 mg,30分钟静脉滴注:每3周为1周期,直到疾病进展或出现不可接受的毒性,若病情持续未进展则使⽤⾄24个⽉。
注:⾮⼩细胞肺癌中,当与化疗联合使⽤时,必须在化疗前给予KEYTRUDA。
2.4⼉童经典霍奇⾦淋巴瘤推荐剂量:推荐剂量的KEYTRUDA为2 mg/kg,最多200mg,30分钟静脉滴注,每3周为1周期,直到疾病进展或出现不可接受的毒性,若病情持续未进展则使⽤⾄24个⽉。
2.6剂量调整(1)如果存在以下任何⼀项情况,都禁⽌继续使⽤KEYTRUDA:a.2级肺炎b.2级或3级结肠炎c.3级或4级内分泌病d.cHL患者4级⾎液毒性e.2级肾炎f.天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)⾼于正常值上限的3-5倍,或总胆红素⾼于正常值上限的1.5-3倍。
g.任何其他严重或三级治疗相关的不良反应注:不良反应恢复⾄1级时可再次应⽤KEYTRUDA。
(2)出现以下任何⼀种情况需永久停药:a.任何致命性不良反应(不包括⽤激素控制的内分泌病替代疗法或cHL患者的⾎液毒性)b.3-4级肺炎或复发的严重2级肺炎c.3级或4级肾炎d.AST或ALT⼤于正常值上限的5倍或总胆红素⼤于正常值上限的3倍e.对于初始时AST或ALT2级升⾼治疗的肝转移患者,AST或ALT相对于基线增加⼤于或等于50%且持续⾄少1周f.3级或4级输液相关反应g.⽆法在12周内将⽪质类固醇剂量减少⾄10mg或更少的泼尼松(或与10mg泼尼松相当剂量的⽪质醇药物)h.持续的2级或3级不良反应(不包括⽤激素控制的内分泌病替代疗法),在最后⼀次⽤药后的12周内未恢复到1级i.任何严重或三级治疗相关的不良反应反复发⽣2.7注射⽤KEYTRUDA(冻⼲粉)溶解的给药准备与存放(1)沿着⼩瓶壁注⼊2.3ml的注射⽤⽆菌⽤⽔(所得浓度为25mg / mL),勿直接注射于冻⼲粉末上,缓慢旋转⼩瓶,⽓泡清除最多5分钟,不要摇动⼩瓶。

K药获批晚期肝癌二线适应症,一文回顾其前世今生+ + + + + + + + + + +2022年10月9日,帕博利珠单抗在国内获批用于晚期肝癌的二线治疗。
帕博利珠单抗(Keytruda)是一种人源化单克隆IgG4 kappa抗PD1抗体,由默沙东公司研发。
中国国家药品监督管理局(NMPA)批准单药用于既往接受过索拉非尼或含奥沙利铂化疗的肝细胞癌(HCC)患者。
本次获批是基于KEYNOTE-394的研究结果。
借此机会,回顾一下帕博利珠单抗在肝癌领域所进行的大型临床试验。
KEYNOTE-224:为二线获批打下基础,一线治疗初尝试2018年11月,FDA根据KEYNOTE-224的研究发现,加速批准帕博利珠单抗用于治疗先前接受过索拉非尼的HCC患者。
在2022年ESMO世界胃肠癌大会上,KEYNOTE-224试验更新了队列1的最新数据,帕博利珠单抗单药治疗继续显示出持久的抗肿瘤活性。
发表的研究结果表明,队列1(n=104)的患者在中位随访59.1个月时到达了13.2个月的中位OS(95%CI,9.7-15.3)。
24个月和36个月的OS率分别为30.8%和20.2%。
此外,帕博利珠单抗的中位PFS为4.9个月(95%CI,3.5-7.0),12个月和24个月的PFS率分别为28.3%和12.5%。
队列2旨在评估帕博利珠单抗在未经系统治疗的晚期肝癌中的疗效和安全性。
研究共纳入51例患者,接受帕博利珠单抗(200mg,IV Q3W)治疗。
研究结果显示,ORR为16%,均为部分缓解(PR);DCR是57%;中位DOR未达到,70%的患者的持续缓解时间≥12个月。
中位TTP为4个月,12个月TTP率为31%;中位PFS为4个月,12个月PFS率为24%,18个月PFS率为16%;中位OS为17个月,12个月OS率为58%,18个月OS率为46%。
KEYNOTE-240:证实K药活性,但结果未能达到双终点3期KEYNOTE-240试验结果为阳性数据,但该研究未能达到其OS和PFS的共同主要终点。
龙源期刊网
中国原研抗癌药获美国FDA突破性疗法认定
作者:
来源:《保健与生活》2019年第06期
1月15日,美国FDA授予中国原研新药Zanubrutinib突破性疗法认定,这一认定将有助
于加快Zanubrutinib的研發和审评过程,也代表着FDA对这一在研药物的肯定。
Zanubrutinib是一种布鲁顿酪氨酸激酶(BTK)抑制剂,用于治疗复治的成年套细胞淋巴瘤(MCL)患者。
Zanubrutinib临床试验的数据表明其与现有治疗方法相比可以显著提高治疗效果。
Zanubrutinib临床试验是由北京大学肿瘤医院作为牵头单位,朱军教授担任主要研究者。
这也是我国原研新药从中国制造到中国创造的一大跨越。
(许艳双刘卫平来源:新华网)。
默克瞄准肿瘤新药,爱必妥®再添适应症,全国数百家医院可⽤作者:雷公来源:健识局(jianshiju01)全⽂3677字,阅读需10分钟德国默克公司旗下西妥昔单抗注射液(商品名:爱必妥®)获批的新适应症近期已在全国同步上市。
健识局获悉,此次爱必妥®所获批的适应症是:与铂类和氟尿嘧啶化疗联合,⽤于⼀线治疗复发和/或转移性头颈部鳞癌。
这也是继爱必妥®获批⼀线治疗RAS基因野⽣型转移性结直肠癌后,再添⼜⼀临床适应症。
按照默克中国⽣物业务董事总经理罗杰仁的设想,预计在5 年之后,实现改变4000万中国患者⽣命的⽬标。
他告诉健识局,中国是默克全球的战略市场之⼀,公司希望能够帮助中国更多的患者延长⽣存时间,改善⽣活质量。
此番爱必妥®的获批,不仅填补了中国头颈部鳞癌领域靶向治疗的空⽩,更为关键的是,默克已吹响了全⾯进军肿瘤领域的号⾓。
5⽉29⽇,默克公司在美国临床肿瘤学会年会(ASCO)上公布了多款肿瘤创新产品的临床试验阶段性成果,例如⼝服MET抑制剂Tepotinib的VISION研究以及新⼀代PD-L1抑制剂Avelumab的JAVELIN Bladder 100研究,结果均取得了重⼤突破性的进展。
随着中国医药市场药品审评审批不断加速,默克将扩⼤现有肿瘤治疗药物的可及性,以及⼀系列丰富的在研创新产品管线,以应对癌症的挑战,满⾜未被满⾜的治疗需求。
罗杰仁认为,中国的医药政策环境、监管环境和商业环境的发展变化将为医药企业的发展释放巨⼤潜⼒。
在未来10年甚⾄更长时间,中国医疗⾏业的“创新驱动发展”战略将会持续。
爱必妥®新添适应症国内已覆盖200-300家医院据相关数据显⽰,2020年全球头颈部肿瘤(包含⿐咽癌)患者⼈数预计将达到83.3万例。
在中国,头颈部肿瘤的发病率和死亡率均排名第七位,其中90%以上的病理类型为鳞癌。
相对于其他⾼发癌症类型,头颈肿瘤在中国的知晓率并不是很⾼。
黑色素瘤患者福音:新药Keytruda获FDA批准在美上市来源:美国食品药品监督管理局(FDA)网站翻译:盛诺一家美国东部时间2014年9月4日(北京时间9月5日),Keytruda(Pembrolizumab)通过了美国食品药品监督管理局(以下简称FDA)的加速审批,用于治疗其他药物无效的晚期或不能手术的黑色素瘤。
在美国,约有5%的新发癌症是黑色素瘤,这种癌细胞来源于产生黑色素、决定皮肤颜色的皮肤细胞。
根据美国国家癌症研究所(NCI)的预测,今年美国将有76100人被诊断患有黑色素瘤,其中将有9710人死于该疾病。
Keytruda是第一个获得上市批准的可以阻碍PD-1的药物,PD-1是一种细胞信号通路,它能抑制身体的免疫系统攻击黑色素瘤细胞。
Keytruda需要在Ipilimumab(易普利姆玛/伊匹单抗)治疗(一种免疫疗法)后使用。
对于表达BRAFV600基因突变的黑色素瘤患者,Keytruda也需要在Ipilimumab(易普利姆玛/伊匹单抗)和一种BRAF抑制剂治疗后使用,BRAF抑制剂是一种阻断BRAF 基因突变效应的疗法。
“Keytruda是自2011年以来FDA批准的第六个黑色素瘤新药,这是黑色素瘤研究领域的一大进步”,FDA的药物评估和研究中心下属的血液学和肿瘤学办公室主任Richard Pazdur, M.D.说,“这些药物大多具有不同的作用机理,这为黑色素瘤患者带来了更多新的治疗选择。
”FDA之前批准的五个黑色素瘤药物分别是:Ipilimumab(易普利姆玛/伊匹单抗)(2011)、聚乙二醇干扰素α-2b(2011)、Vemurafenib(维罗非尼)(2011)、Dabrafenib(达拉菲尼)(2013)、Trametinib(曲美替尼)(2013)。
申办方提供的临床前证据表明,相比现有药物Keytruda可能实质性地提高治疗效果,基于此FDA授予了Keytruda突破性疗法认定。
复发难治的弥漫性大B细胞淋巴瘤,有新招吗?R-CHOP 21天黄金方案地位稳固不论国内外,弥漫性大B细胞淋巴瘤(DLBCL)都是非霍奇金淋巴瘤(NHL)中发病率最高的恶性肿瘤,约占NHL的30%-40%。
经过几十年的发展,DLBCL的治疗已取得了很大进步。
化疗治愈DLBCL的报告可以追溯到上世纪70年代,其后出现了多种治疗方案,并依次被定义为第一、二、三代。
期间研究者对这些方案做了很多比较,发现第一代方案CHOP(CTX,ADM,VCR,PDN)的疗效始终优于其他方案,最终还是将它作为DLBCL的首选方案。
到90年代末,美罗华(R,CD20单抗)的出现极大地改变了DLBCL治疗和预后,多项研究在比较了R-CHOP和CHOP 方案之后将前者作为了DLBCL治疗的新标准。
此后一段时间,人们逐渐研究了R-CHOP 14天与R-CHOP 21天方案的差异,也进行了R-CHOP与R-CHOEP方案或高剂量ACVBP方案的比较,最终R-CHOP 21天方案在治疗选择中“胜出”,占统治性地位。
复发难治如何解决,还是个难题即使应用了上述已被公认的方案,仍有1/3的DLBCL患者最终难以避免进入复发、难治的困境,这成为该领域非常棘手的问题。
通常我们会提到使用二线解救治疗方案,但常见的DHAP、ICE、ESHAP等二线治疗方案的疗效无显著差异,且接受治疗的患者的完全缓解率仅25%~35%,绝大多数患者依然面临复发。
早先,在无标准化二线解救治疗方案的情况下,研究发现大剂量解救化疗联合自体造血干细胞移植能使53%的患者实现5年存活,而单纯化疗组仅32%。
这使得自体造血干细胞移植的地位得到了某种肯定。
但仍然有问题,因为到美罗华一线治疗的年代,对于最短时间内复发比如治疗12个月复发的患者或之前用过美罗华的复发患者,再行自体造血干细胞移植的疗效是大打折扣的。
至此,自体造血干细胞移植对一线R-CHOP方案失败的复发难治性DLBCL患者的治疗被打上了一个大大的问号。
重磅Keytruda获批治疗纵膈大B细胞淋巴瘤!
癌友交流吧提供大众易感基因检测和专业临床肿瘤用
药基因检测服务、乙肝、丙肝、肿瘤靶向药物、PD1免疫治疗药物、免疫细胞、辅助抗癌产品。
专家咨询服务、产品使用指南及相关信息,真诚服务广大病友及一切所需要的人!【导读】近日,FDA批准了PD-1免疫疗法Keytruda又一适应症,用于治疗纵膈大B细胞淋巴瘤(PMBCL,一种非霍奇金淋巴瘤)。
这是此类病征的首款PD-1免疫疗法,也是该药在恶性血癌领域的第二个适应症。
此次获批是Keytruda 在本周内的第二次获批,再次为人们带来了惊喜!药品名:Pembrolizumab商品名:Keytruda中文名:派姆单抗生产商:MSD性状:注射剂剂量:100mg/4ml、50mg/Vial冻干粉适应症:适用于淋巴瘤、宫颈癌、膀胱癌、胃癌、头颈鳞癌、非小细胞肺癌、经典霍奇金淋巴瘤、黑色素瘤等。
此次默沙东(MSD)宣布:FDA已经批准其重磅免疫疗法Keytruda 上市,治疗纵膈大B细胞淋巴瘤(PMBCL,一种非霍奇金淋巴瘤)。
值得一提的是,这是首个治疗这一疾病的抗PD-1疗法,也是Keytruda在恶性血液癌症领域的第二个适应症。
PMBCL是一种侵袭性弥漫性大B细胞淋巴瘤,占所有非霍奇金淋巴瘤的约2%至4%,这种疾病主要影响青年人,女性
患者比例约为男性患者的1.7-2倍。
Keytruda是一种已被批准用于多种癌症的免疫疗法,可治疗黑色素瘤、非小细胞肺癌、以及头颈部鳞状细胞癌等。
它可以选择性阻断PD-1与其配体PD-L1和PD-L2结合,激活淋巴T细胞杀死癌细胞。
默沙东正在对Keytruda进行750项不同的临床试验。
此次PMBCL适应症的获批,是基于多中心、开放标签、单臂临床研究KEYNOTE-170的试验数据。
患者每三周接受一次200 mg固定剂量的Keytruda单药治疗,直至病情进展或毒性变得不可接受。
主要终点是总体缓解率(ORR),关键次要终点包括缓解持续时间(DOR)、药物安全性和耐受性。
试验结果显示,Keytruda治疗组的ORR为45%(24例,95% CI:32-60),完全缓解率(CRR)为11%,部分缓解率(PRR)为34%。
在24例参加随访的患者中,中位DOR 尚未达到(范围:1.1-19.2+月),实现客观缓解(完全或部分)的中位时间为2.8个月(范围:2.1-8.5月)。