最新中考化学-物质的检验
- 格式:pdf
- 大小:217.75 KB
- 文档页数:11

2020年中考化学知识点之物质的检验
物质的检验
(1) 酸(H+)检验。
方法1:将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变红,则证明H+存在。
方法2:用干燥清洁的玻璃棒蘸取未知液滴在蓝色石蕊试纸上,如果蓝色试纸变红,则证明H+的存在。
方法3:用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH小于7,则证明H+的存在。
(2) 碱(OH-)的检验。
方法1:将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变蓝,则证明OH-的存在。
方法2:用干燥清洁的玻璃棒蘸取未知液滴在红色石蕊试
纸上,如果红色石蕊试纸变蓝,则证明OH-的存在。
方法3:将无色的酚酞试液滴入盛有少量待测液的试管中,振荡,如果酚酞试液变红,则证明OH-的存在。
方法4:用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH-的存在。
(3)CO32- 或HCO3-的检验。
将少量的盐酸或硝酸倒入盛有少量待测物的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑,则证明原待测物中CO32-或HCO3-的存在。
(4)铵盐(NH4+):
用浓NaOH溶液(微热)产生使湿润的红色石蕊试纸变蓝的气体。

中考化学专题----物质的检验、鉴别和除杂一、检验A.向某无色溶液中滴入石蕊试液,呈红色,证明该溶液是酸溶液B.向某无色溶液中滴入硝酸银溶液,产生白色沉淀,证明该溶液是盐酸C.白色固体与熟石灰混合加热,产生使湿润的红色石蕊试纸变蓝的气体,证明该固体是铵盐D.固体粉末加入稀盐酸,产生气泡,证明该粉末中有碳酸盐、二、鉴别1、为鉴别空气、氧气、二氧化碳三瓶气体,可选用的方法是()A.将水倒入三瓶气体中 B.将澄清石灰水倒入三瓶气体中C.将紫色石蕊试液滴入三瓶气体中 D.将燃着的木条分别伸入三瓶气体中2、现有氢气、甲烷、二氧化碳三种气体,如果用最简单的方法将它们鉴别出来,除用一盒火柴外,你至少还需要下列试剂中的()A. 浓硫酸B. 蒸馏水C. 酚酞试液D. 澄清的石灰水3、如果要鉴别CO、H2、CH4三种气体,最好的方法是()A. 闻气味B. 检验是否能让澄清的石灰水变浑浊C. 燃烧看火焰的颜色D.燃烧后检验其生成物4、鉴别三个集气瓶中的无色气体分别是氢气、氧气和二氧化碳,最简单的方法是()A. 分别测定密度B. 分别加入澄清石灰水C. 分别试验气体的溶解性D. 将燃着的木条分别放在集气瓶口5、下列物质在空气中燃烧,其生成物既能使石蕊试液变红又能使无水硫酸铜变蓝的是()A、一氧化碳B、木炭C、氢气D、甲烷6、下列各组物质,只用组内溶液相互混合的方法就能鉴别的是( )A.KOH、Na2SO4、CuSO4、MgCl2B.K2CO3、Ba(NO3)2、Na2SO4、HClC.Na2SO4、BaCl2、KNO3、NaCl D.Na2NO3、AgNO3、KNO3、NaCl7、下列各组固体物质用水和组内物质就能鉴别的是( )A.食盐、纯碱、小苏打 B.碳酸氢铵、氧化钙、硫酸钾C.葡萄糖、淀粉、加碘盐 D.硝酸铵、烧碱、食盐8、不另选试剂,仅利用组内物质之间的相互反应,就能将它们鉴别出来的是:A.FeCl3 NaOH HCl H2SO4B.HCl KNO3Na2CO3Na2SO4C.AgNO3 HCl NaCl HNO3D.BaCl2Na2SO4Na2CO3HCl9、只用一种试剂就能鉴别硝酸钡、碳酸钠、硫酸钾三种溶液,该试剂是()A、硝酸钾溶液B、稀硫酸C、氢氧化钠溶液D、硫酸钠溶液10、下列各组中的物质,能在溶液中大量共存的是()A. KNO3NaCl NaOHB. KOH Na2CO3 HClC. KNO3NaOH FeCl3D. AgNO3BaCl2HNO311、用水作试剂,不可能区分开来的一组物质是()A.生石灰、食盐、烧碱B.汽油、酒精、浓硫酸C.无水硫酸铜、碳酸钙、碳酸钠D.氯化钾、硝酸钠、硫酸钾12、某中学化学兴趣小组四名学生,对某厂排放的污水进行检测,先取废液观察,呈无色、均一、透明状,然后用PH试纸测得污水的PH=1。

专题13常见物质的检验、鉴别与除杂知识01物质的检验1.物质检验的一般依据(1)任何具有明显实验现象差异的物理性质、化学性质都可作为物质检验的依据。
(2)举例:颜色的变化、是否有气体产生、能否溶解、有无沉淀产生、有无吸热或放热等。
2.物质检验的一般步骤观察物理性质→取少量样品→加入某种试剂→加热、振荡等→观察实验现象→得出结论。
3.常见气体的检验气体方法现象原理O2将带火星的木条伸入集气瓶内木条复燃氧气具有助燃性CO 点燃气体,在火焰上方罩一个内壁涂有澄清石灰水的烧杯澄清石灰水变浑浊2CO+O2点燃CO2Ca(OH)2+CO2=CaCO3↓+H2OCO2通入澄清石灰水澄清石灰水变浑浊Ca(OH)2+CO2=CaCO3↓+H2OH2点燃气体,在火焰上方罩一个干燥、冷的烧杯氢气安静燃烧,产生淡蓝色火焰,烧杯内壁有水雾2H2+O2点燃2H2ONH3(1)闻气味(2)将湿润的红色石蕊试纸放在盛放氨气的容器口(1)有氨味;(2)试纸变蓝NH3+H2O=NH3·H2OH2O通过无水硫酸铜白色粉末变蓝5H2O+CuSO4=CuSO4·5H2OCH4点燃气体,在火焰上方罩一个干燥、冷的烧杯,反应一段时间后,迅速倒转烧杯,倒入少量澄清石灰水产生蓝色火焰;烧杯内壁有水雾;石灰水变浑浊CH4+2O2点燃CO2+2H2OCa(OH)2+CO2=CaCO3↓+H2OHCl (1)用蘸浓氨水的玻璃棒靠近(2)将气体通入硝酸银溶液,并加稀硝酸(1)有白烟产生(2)有白色沉淀产生,且沉淀不溶于稀硝酸(1)HCl+NH3=NH4Cl(2)HCl+AgNO3=AgCl↓+HNO34.常见离子的检验离子检验方法现象Cl -滴加硝酸银溶液和稀硝酸产生白色沉淀(AgCl ),且沉淀不消失23CO -、3HCO-滴加稀盐酸,将产生的气体通入澄清石灰水有气泡(CO 2)产生,产生的气体能使澄清石灰水变浑浊24SO -滴加硝酸钡溶液和稀硝酸产生白色沉淀(BaSO 4),且沉淀不消失4NH+加入氢氧化钠溶液,用湿润的红色石蕊试纸检验产生的气体有刺激性气味的气体(NH 3)产生,试纸变蓝Ag +滴加稀盐酸和稀硝酸产生白色沉淀(AgCl ),且沉淀不消失Cu 2+滴加氢氧化钠溶液产生蓝色沉淀[Cu(OH)2]Ba 2+滴加稀硫酸和稀硝酸产生白色沉淀(BaSO 4),且沉淀不消失Fe 3+滴加氢氧化钠溶液产生红褐色沉淀[Fe(OH)3]OH-①滴加紫色石蕊溶液②滴加无色酚酞溶液①溶液变蓝②溶液变红H +①滴加紫色石蕊溶液②加入锌等活泼金属①溶液变红②有气泡(H 2)产生能量增大,运动的速率加大,故设计方案合理;D、利用混在食盐中的泥沙不能溶于水的特点,可先把粗盐放入水中溶解,使食盐与泥沙进行初步分离;再经过过滤除去溶液中不溶的泥沙;故设计方案不合理。

初中化学物质的检验
(一)、离子的检验.
1、H+:滴加紫色石蕊试液/加入锌粒
2、OH-:酚酞试液/硫酸铜溶液
3、碳酸根离子:稀盐酸和澄清的石灰水
4、氯离子:硝酸银溶液和稀硝酸,假设产生白色沉淀,那么是氯离子
5、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
6、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
7、铜离子:滴加氢氧化钠溶液,假设产生蓝色沉淀那么是铜离子
8、铁离子:滴加氢氧化钠溶液,假设产生红褐色沉淀那么是铁离子
(二) 、气体的检验
1、氧气:带火星的木条放入瓶中,假设木条复燃,那么是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,假设不变浑浊,那么是氢气.
3、二氧化碳:通入澄清的石灰水,假设变浑浊那么是二氧化
碳.
4、氨气:湿润的紫红色石蕊试纸,假设试纸变蓝,那么是氨气.
5、水蒸气:通过无水硫酸铜,假设白色固体变蓝,那么含水蒸气.。

物质的检验酸液(H+):只能用紫色石蕊试液碱液(OH-):紫色石蕊试液和无色酚酞均可。
盐酸和Cl-:用AgNO3溶液和稀HNO3 硫酸和SO42-:用BaCl2溶液和稀HNO3 区别Cl-和SO42-:只能用BaCl2溶液不能用AgNO3溶液CO32-:用盐酸和石灰水铵盐(NH4+):用浓NaOH溶液(微热)产生使湿润的红色石蕊试纸变蓝的气体。
物质的俗名或主要成分、化学式:氢氯酸(俗名为盐酸)HCl 氯酸HClO3 氢硫酸H2S 硫酸H2SO4 硝酸HNO3 磷酸H3PO4 氧化钙CaO (生石灰)氢氧化钙Ca(OH)2 (熟石灰消石灰)Ca(OH)2水溶液俗名石灰水石灰石的主要成分是:CaCO3 磷酸氢二钠Na2HPO4 氢氧化钠NaOH(火碱、烧碱、苛性钠) 氯化钠NaCl(食盐) 粗盐中含有MgCl2、CaCl2杂质而易潮解尿素CO(NH2)2工业盐中含有亚硝酸钠NaNO2 亚硫酸钠Na2SO3 碳酸钠Na2CO3(纯碱)(水溶液呈碱性,但不是碱)纯碱晶体Na2CO3·10H2O 波尔多液CuSO4和Ca(OH)2 硫酸铜晶体CuSO4·5H2O (蓝矾、胆矾)磷酸二氢钙Ca(H2PO4)2 碳酸氢钠NaHCO3 硫酸氢钠NaHSO4 氨水NH3·H2O(属于碱类)过磷酸钙是混合物有关物质的颜色:Fe(OH)3红褐色沉淀Fe2O3红(棕)色Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液(即Fe3+的溶液)黄色FeSO4 、FeCl2 、Fe(NO3)2、(即Fe2+)浅绿色Fe块状是白色的,粉末状是黑色,不纯的是黑色Cu(OH)2蓝色沉淀CuO黑色CuCl2、Cu(NO3)2、CuSO4溶液(即Cu2+的溶液)蓝色无水CuSO4是白色CuSO4·5H2O是蓝色Cu(紫)红色BaSO4、AgCl是不溶于HNO3的白色沉淀CaCO3 BaCO3是溶于HNO3 的白色沉淀KClO3白色KCl白色KMnO4紫黑色MnO2黑色Cu2(OH)2CO3绿色。
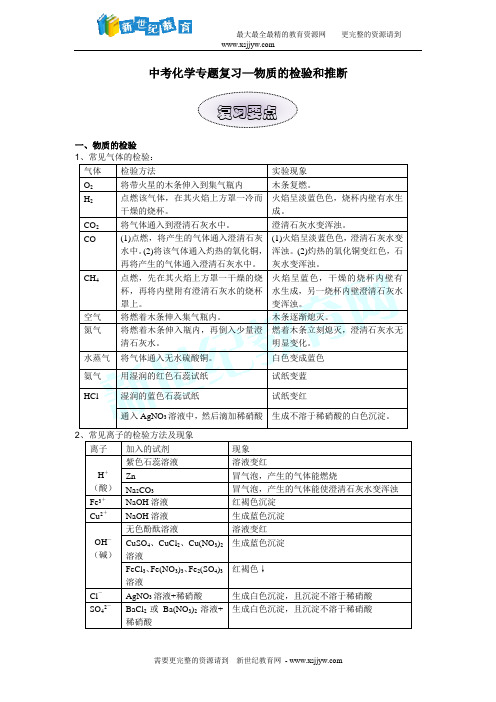
中考化学专题复习—物质的检验和推断一、物质的检验1、常见气体的检验:气体检验方法实验现象O2将带火星的木条伸入到集气瓶内木条复燃。
H2点燃该气体,在其火焰上方罩一冷而干燥的烧杯。
火焰呈淡蓝色色,烧杯内壁有水生成。
CO2将气体通入到澄清石灰水中。
澄清石灰水变浑浊。
CO (1)点燃,将产生的气体通入澄清石灰水中。
(2)将该气体通入灼热的氧化铜,再将产生的气体通入澄清石灰水中。
(1)火焰呈淡蓝色色,澄清石灰水变浑浊。
(2)灼热的氧化铜变红色,石灰水变浑浊。
CH4点燃,先在其火焰上方罩一干燥的烧杯,再将内壁附有澄清石灰水的烧杯罩上。
火焰呈蓝色,干燥的烧杯内壁有水生成,另一烧杯内壁澄清石灰水变浑浊。
空气将燃着木条伸入集气瓶内。
木条逐渐熄灭。
氮气将燃着木条伸入瓶内,再倒入少量澄清石灰水。
燃着木条立刻熄灭,澄清石灰水无明显变化。
水蒸气将气体通入无水硫酸铜。
白色变成蓝色氨气用湿润的红色石蕊试纸试纸变蓝HCl 湿润的蓝色石蕊试纸试纸变红通入AgNO3溶液中,然后滴加稀硝酸生成不溶于稀硝酸的白色沉淀。
2、常见离子的检验方法及现象离子加入的试剂现象H+(酸)紫色石蕊溶液溶液变红Zn 冒气泡,产生的气体能燃烧Na2CO3冒气泡,产生的气体能使澄清石灰水变浑浊Fe3+NaOH溶液红褐色沉淀Cu2+NaOH溶液生成蓝色沉淀OH-(碱)无色酚酞溶液溶液变红CuSO4、CuCl2、Cu(NO3)2溶液生成蓝色沉淀FeCl3、Fe(NO3)3、Fe2(SO4)3溶液红褐色↓Cl-AgNO3溶液+稀硝酸生成白色沉淀,且沉淀不溶于稀硝酸SO42-BaCl2或Ba(NO3)2溶液+稀硝酸生成白色沉淀,且沉淀不溶于稀硝酸复习要点CO32-盐酸+澄清石灰水产生使澄清石灰水变浑浊的气体有刺激性气味气体生成NH4+ 取样品与Ca(OH)2混在一起研磨,闻味。
3、日常生活中物质的检验(1)热塑性塑料与热固性塑料的鉴别取样加热,能熔化,冷却后凝固再加热又熔化的是热塑性塑料;不能熔化的是热固性塑料。
专项08物质的检验和鉴别、分离和提纯1.下列依据实验目的进行的实验设计,不合理的是选项实验目的实验操作A除去炭粉中的铁粉用磁铁吸引B鉴别羊毛纤维和合成纤维灼烧,闻气味C检验自来水是否为硬水加入肥皂水,振荡,观察现象D检验NaOH溶液是否混有Na2CO3滴入少量的酚酞溶液,观察现象A.A B.B C.C D.D【答案】D【详解】A、铁能被磁铁吸引,该选项设计合理;B、羊毛灼烧有烧焦羽毛的气味,合成纤维灼烧有刺激性气味,则能鉴别,该选项设计合理;C、肥皂水可鉴别硬水和软水,其中产生较少泡沫或较多浮渣的为硬水,该选项设计合理;D、氢氧化钠和碳酸钠溶液均显碱性,都能使酚酞溶液变红色,则不能检验氢氧化钠溶液中是否含有碳酸钠,该选项设计不合理。
故选D。
2选项实验目的操作方法A鉴别硬水和软水加肥皂水,振荡B鉴别一氧化碳和二氧化碳气体闻气味C鉴别纯碱溶液和烧碱溶液加酚酞溶液D鉴别氯化钠和硝酸铵固体加水溶解,比较温度变化A.A B.B C.C D.D【答案】B【详解】A、鉴别硬水和软水:加肥皂水,振荡,若泡沫少、浮渣多则为硬水,若泡沫多、浮渣少则为软水,可以鉴别,不符合题意;B 、鉴别一氧化碳和二氧化碳气体:一氧化碳和二氧化碳均为无色无味的气体,闻气味无法鉴别,符合题意;C 、鉴别纯碱(碳酸钠)溶液和烧碱(氢氧化钠)溶液:碳酸钠和氢氧化钠均呈碱性,加酚酞溶液,溶液都会变为红色,现象相同,无法鉴别,不符合题意;D 、鉴别氯化钠和硝酸铵固体:氯化钠溶于水温度不变,硝酸铵溶于水吸热,温度降低,现象不同,可以鉴别,不符合题意。
故选:B 。
3.设计实验方案是科学探究的重要环节。
以下实验方案设计中,不能达到实验目的的是A .用燃着的木条鉴别2N 和2CO B .用稀盐酸鉴别铁粉和氧化铜粉末C .用 2Ba OH 溶液鉴别 442NH SO 和43NH NO 溶液D .用水鉴别NaOH 固体和NaCl 固体【答案】A【详解】A 、氮气和二氧化碳均不可燃也不助燃,都会使燃着的木条熄灭,不能鉴别,该设计不能达到实验目的;B 、铁和盐酸反应生成氯化亚铁和氢气,有气泡产生,溶液由无色变为浅绿色,氧化铜和盐酸反应生成氯化铜和水,溶液由无色变为蓝色,能鉴别,该设计能达到实验目的;C 、氢氧化钡和硫酸铵反应生成硫酸钡沉淀和氨气、水,有刺激性气味的气体产生,并产生白色沉淀,氢氧化钡和硝酸铵反应生成硝酸钡、氨气和水,只有刺激性气味的气体产生,能鉴别,该设计能达到实验目的;D 、氢氧化钠溶解放热,温度升高,氯化钠溶解时溶液温度几乎不变,能鉴别,该设计能达到实验目的。
2024年中考化学复习考点归纳总结—物质的检验与鉴别(全国通用)知识点一、常见气体的检验与鉴别常见气体的检验与鉴别气体检验方法现象氧气带火星的木条伸入集气瓶木条复燃二氧化碳通入澄清的石灰水石灰水变浑浊氢气点燃,在火焰上方罩干冷的烧杯纯净气体能安静燃烧,有淡蓝色火焰,烧杯内壁有水珠依次通过灼热的氧化铜和白色的无水硫酸铜粉末黑色氧化铜变红,白色无水硫酸铜粉末变蓝一氧化碳点燃,在火焰上方罩涂有澄清石灰水的烧杯燃烧产生蓝色火焰,烧杯内壁石灰水变浑浊依次通过灼热的氧化铜和澄清石灰水黑色氧化铜变红,澄清石灰水变浑浊烧杯内壁有水珠,澄清石灰水变浑浊甲烷点燃,在火焰上方罩干冷的烧杯,迅速倒转后,注入少量澄清石灰水氨气用湿润的红色石蕊试纸放在试管口红色石蕊试纸变蓝水蒸气用燃着的木条伸入,再加入澄清石灰水,振荡木条的火焰熄灭,澄清石灰水不变浑浊氮气通入酸化的AgNO3溶液产生白色沉淀知识点二、物质的检验与鉴别综合运用(一)常见离子的检验与鉴别离子试剂、方法实验现象①变红;②pH<7;③产生气泡酸(H+)①滴加紫色石蕊试液;②pH试纸;③加入Zn粒碱(OH-)①滴加紫色石蕊试液;②滴加无色酚酞试①变蓝;②变红;③pH>7液;③pH试纸Cl-加入AgNO3溶液和稀硝酸产生白色沉淀,且白色沉淀不溶解S O42−加入稀盐酸酸化后再加入BaCl2溶液酸化后无现象,加入BaCl2后产生白色沉淀C O32−加入稀盐酸,将产生的气体通入澄清的石有无色无味气体产生,石灰水变浑浊灰水中N H4+加入强碱,加热,将产生的气体用湿润红色产生有刺激性气味的气体,试纸变蓝石蕊试纸检验Fe3+加入强碱溶液产生红褐色沉淀Cu2+插入铁丝(或加入强碱溶液)铁丝附有红色物质(或产生蓝色沉淀)(二)日常生活中一些常见物质的检验与鉴别1.化肥的鉴别(1)铵态氮肥:白色,易溶于水,与熟石灰研磨会产生有刺激性气味的气体。
(2)磷肥:多呈灰白色,不溶于水。