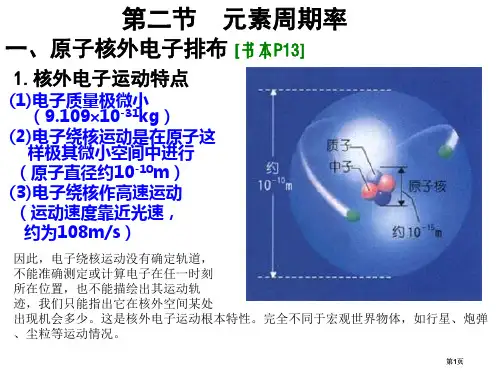
+7 +6 +5 +4 +3 +2 +1
-1 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
-2 -3 -4
2、元素化合价与元素在周期表中位置的关系
①价电子:元素的最外层中的电子(主族元素) ②主族族序数=价电子数=最外层电子数=主族 元素的最高正价数
③最高正价+ |最低负价| =8
得电子能力依次增大 原子半径依次减小
原子半径依次增大 失电子能力依次增大
金属性依次增强
非金属性依次增强 得电子能力依次增大
原子半径依次减小
原子半径依次增大 失电子能力依次增大
金属性依次增强
课堂练习:
1、下列递变规律中对的的是( C ) A、Na、Mg、Al 的还原性依次增强 B、Cl、Br、I 的非金属性依次增强 C、Si、P、S、Cl 的最高价氧化物的水化物的酸性依次增强 D、C、N、O、F 的原子半径依次增大
思考:在同一周期、同一主族最高价氧化物的水化物的酸 碱性,气态氢化物的稳定性如何变化?
同一周期最高价氧化物对应的水化物的酸性依次增强, 碱性依次削弱。
同一主族最高价氧化物对应的水化物的酸性依次削弱, 碱性依次增强。
同一周期气态氢化物的稳定性依次增强, 同一主族气态氢化物的稳定性依次削弱。
元素化合价周期性递变图
周期数=最外电子层数
练习
推算原子序数为 13,34,53,88,82的元素在周期表中的位置。
原子 序数
核外电子排布
周 期 族序 数数
6 2,4 13 2,8,3 34 2,8,18,6
2 ⅣA 3 ⅢA
4 ⅥA
53 2,8,18,18,7