第二章 紫外吸收光谱分析
- 格式:ppt
- 大小:1.48 MB
- 文档页数:35
紫外吸收光谱分析一概述紫外可见吸收光谱法是利用某些物质的分子吸收10~800nm光谱区的辐射来进行分析测定的方法,这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于有机和无机物质的定性和定量测定。
该方法具有灵敏度高、准确度好、选择性优操作简便、分析速度好等特点。
分子的紫外可见吸收光谱法是基于分子内电子跃迁产生的吸收光谱进行分析的一种常用的光谱分析法。
分子在紫外-可见区的吸收与其电子结构紧密相关。
紫外光谱的研究对象大多是具有共轭双键结构的分子。
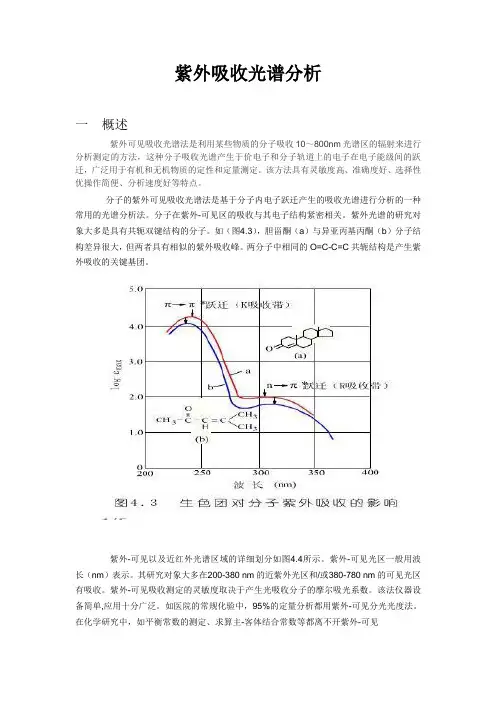
如(图4.3),胆甾酮(a)与异亚丙基丙酮(b)分子结构差异很大,但两者具有相似的紫外吸收峰。
两分子中相同的O=C-C=C共轭结构是产生紫外吸收的关键基团。
紫外-可见以及近红外光谱区域的详细划分如图4.4所示。
紫外-可见光区一般用波长(nm)表示。
其研究对象大多在200-380 nm的近紫外光区和/或380-780 nm的可见光区有吸收。
紫外-可见吸收测定的灵敏度取决于产生光吸收分子的摩尔吸光系数。
该法仪器设备简单,应用十分广泛。
如医院的常规化验中,95%的定量分析都用紫外-可见分光光度法。
在化学研究中,如平衡常数的测定、求算主-客体结合常数等都离不开紫外-可见二基本原理紫外可见吸收光谱的基本原理是利用在光的照射下待测样品内部的电子跃迁,电子跃迁类型有:(1)σ→σ* 跃迁指处于成键轨道上的σ电子吸收光子后被激发跃迁到σ*反键轨道(2)n→σ* 跃迁指分子中处于非键轨道上的n电子吸收能量后向σ*反键轨道的跃迁(3)π→π* 跃迁指不饱和键中的π电子吸收光波能量后跃迁到π*反键轨道。
(4)n→π* 跃迁指分子中处于非键轨道上的n电子吸收能量后向π*反键轨道的跃迁。
电子跃迁类型不同,实际跃迁需要的能量不同:σ→σ* ~150nmn→σ* ~200nmπ→π* ~200nmn→π* ~300nm吸收能量的次序为:σ→σ*>n→σ*≥π→π*>n→π*特殊的结构就会有特殊的电子跃迁,对应着不同的能量(波长),反反映在紫外可见吸收光谱图上就有一定位置一定强度的吸收峰,根据吸收峰的位置和强度就可以推知待测样品的结构信息三特点1、紫外可见吸收光谱所对应的电磁波长较短,能量大,它反映了分子中价电子能级跃迁情况。










第二章紫外-可见吸收光谱【教学内容】1. 紫外-可见吸收光谱概述2. 紫外-可见光谱的仪器原理3.紫外-可见吸收光谱的原理4.常用术语5 有机化合物紫外-可见光谱的吸收峰6 吸收谱带的四种类型7 常见有机化合物生色团的紫外吸收峰8 紫外-可见光谱的影响因素9.紫外-可见光谱的定性和定量应用【掌握内容】1.掌握紫外-可见光谱的基本概念12.掌握有机化合物中电子跃迁的基本类型。
3.掌握紫外-可见光谱的定性分析方法4.掌握紫外-可见光谱的定量分析方法【熟悉内容】熟悉紫外-可见光谱仪的基本原理【了解内容】了解无机化合物的紫外-可见吸收光谱【教学重点和难点】教学重点:紫外-可见吸收光谱的基本概念、定性和定量分析方法【教学目标】掌握紫外-可见光谱的基本概念,紫外-可见光谱的定性和定量分析方法。
【教学手段】课堂讲授,辅以多媒体幻灯图片【教学过程】1 紫外-可见吸收光谱概述紫外—可见分光光度法是利用某些物质分子能够吸收200 ~ 800 nm光谱区的辐射来进行分析测定的方法。
这种分子吸收光谱源于价电子或分子轨道上电子的电子能级间跃迁,广泛用于无机和有机物质的定量测定,辅助定性分析(如配合IR)。
1.1 分子吸收光谱的产生在分子中,除了电子相对于原子核的运动外,还有核间相对位移引起的振动和转动。
这三种运动能量都是量子化的,并对应有一定能级。
下图为分子的能级示意图。
图1. 分子中电子能级、振动能级和转动能级示意图分子总能量:E分子= E电子+ E振动+ E转动当用频率为ν的电磁波照射分子,而该分子的较高能级与较低能级之差△E恰好等于该电磁波的能量hν时,即有:△ E = hν(h为普朗克常数)此时,在微观上出现分子由较低能级跃迁到较高的能级;在宏观上则透射光的强度变小。
用一连续-辐射的电磁波照射分子,将照射前后光强度的变化转变为电信号,并记录下来,然后以波长为横坐标,以电信号(吸光度A)为纵坐标,就可以得到一张光强度变化对波长的关系曲线图-紫外吸收光谱图,如下:A称为吸光度(absorbance),吸收度或光密度(OD,optical density),a称为吸收系数(absorotiviry),是化合物分子的特性,它与浓度(c)和光透过介质的厚度(b)无关。
紫外吸收光谱分析摘要:分子内部的运动可分为价电子运动,分子内原子在平衡位置附近的振动和分子绕其重心的转动。
因此分子具有电子(价电子)能级、振动能级和转动能级。
分子的能量等于三者能量之和。
分子从外界吸收能量之后,就能引起分子能级的跃迁,即从基态能级跃迁到激发态能级。
分子吸收能量具有量子化的特征,即分子只吸收等于两个能级之差的能量。
由于三种能级跃迁所需能量不同,所以需要不同波长的电磁辐射使他们跃迁,即在不同的光学区出现吸收谱带。
由于电子能级跃迁而产生的吸收光谱主要处于紫外及可见光区域(200-780nm),这种分子光谱称为电子光谱或紫外可见光谱。
[1]关键词:电子能级跃迁红移蓝移溶剂效应一、形成原理在有机化合物分子中有形成单键的σ电子、有形成双键的л电子、有未成键的孤对n电子。
当分子吸收一定能量的辐射能时,这些电子就会跃迁到较高的能级,此时电子所占的轨道称为反键轨道,而这种电子跃迁同内部的结构有密切的关系。
在紫外吸收光谱中,电子的跃迁有σ→σ*、n→σ*、π→π*和n→π*四种类型,各种跃迁类型所需要的能量依下列次序减小:σ→σ*>n→σ*>π→π*>n→π*。
一般来说,未成键孤对电子较易激发,成键电子中π电子较相应的σ电子具有较高的能级,而反键电子却相反。
因此简单分子中n→π*跃迁、配位场跃迁需最小的能量,吸收带出现在长波段方向,n→σ*、π→π*及电荷迁移跃迁的吸收带出现在较短波段,而σ→σ*跃迁则出现在远紫外区。
二、紫外吸收光谱与分子结构的关系当饱和单键碳氢化合物中的氢被氧、氮、卤素、硫等杂原子取代时,由于这类原子中有n电子,n电子较σ键电子易于激发,使电子跃迁所需的能量减低,吸收峰向长波方向移动,这种现象称为深色移动或红移,此时产生n→σ*跃迁。
例如甲烷一般跃迁的范围在125~135nm(远紫外区),碘甲烷(CH3I)的吸收峰则处在150~210(σ→σ*跃迁)及259nm(n→σ*)。
第二章:紫外吸收光谱法一、选择1. 频率(MHz)为4.47×108的辐射,其波长数值为(1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状3. 紫外光谱是带状光谱的原因是由于(1)紫外光能量大(2)波长短(3)电子能级差大(4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因4. 化合物中,下面哪一种跃迁所需的能量最高(1)ζ→ζ*(2)π→π*(3)n→ζ*(4)n→π*5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大(1)水(2)甲醇(3)乙醇(4)正己烷6. 下列化合物中,在近紫外区(200~400nm)无吸收的是(1)(2)(3)(4)7. 下列化合物,紫外吸收λ值最大的是max(1)(2)(3)(4)二、解答及解析题1.吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定?2.紫外吸收光谱有哪些基本特征?3.为什么紫外吸收光谱是带状光谱?4.紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性?5.分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?6.影响紫外光谱吸收带的主要因素有哪些?7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系?8.溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素?9.什么是发色基团?什么是助色基团?它们具有什么样结构或特征?10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?11.为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。
12.芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。