肝细胞损伤时的肝功能试验
- 格式:doc
- 大小:66.00 KB
- 文档页数:7
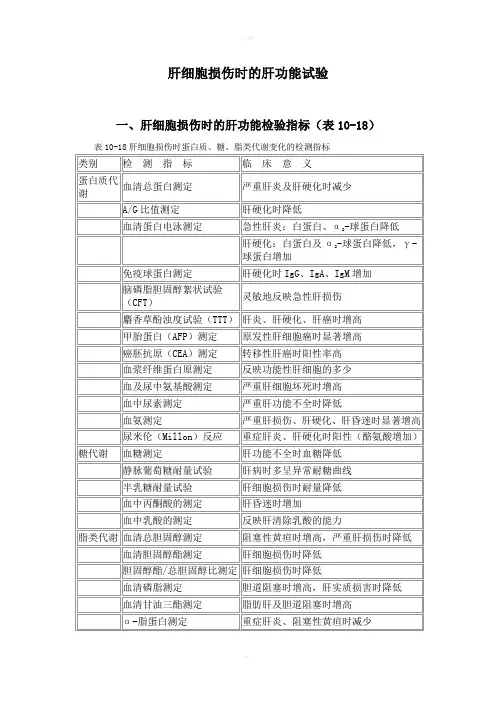
肝细胞损伤时的肝功能试验一、肝细胞损伤时的肝功能检验指标(表10-18)表10-18肝细胞损伤时蛋白质、糖、脂类代谢变化的检测指标续表二、急性肝细胞损伤的检验指标能引起急性肝细胞损伤的因素有感染(如病毒性肝炎)、中毒(药物及化学毒物中毒)、乙醇等。
反映肝细胞损伤的检验指标有:血清酶类的测定,血清铁的测定,F抗原等。
(一)血清酶活性的测定常用来反映肝细胞损伤以及判断损伤程度的酶有丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、乳酸脱氢酶(LDH)、谷氨酸脱氢酶(GLDH)、腺苷脱氨酶(ADA)、鸟嘌呤酶(GU)等。
这些酶中常用的重要的酶仍为ALT和AST,它们能敏感地提示肝细胞的损伤及损伤的程度。
反映急性肝细胞损伤时,以ALT为最敏感,而反映损伤程度时AST较为敏感。
一般认为AST大部分存在于肝细胞线粒体中(ASTm),当肝细胞损伤较严重时ASTm 释放入血液循环中,AST/ALT>1。
有人主张当AST、ALT活性增高(达正常20倍)情况下,AST/ALT的比值不同类型的肝细胞损伤其比值不同。
急性病毒性肝炎、药物性肝损伤时AST/ALT<1;重症肝炎、乙醇性肝炎时AST/ALT>1;正常人血清AST/ALT比值平均为1.15;急性病毒性肝炎早期或轻型肝炎时比值降至0.56,至恢复期比值逐渐上升;肝硬化代偿期AST/ALT比值为1.5-0.7,失代偿期为1.8-0.7;肝癌时比值明显上升,半数病例>3.0。
AST同工酶的测定有助于判断肝损伤病变程度。
AST同工酶包括细胞质AST(ASTc)和线粒体AST(ASTm),当肝细胞通透性增加时表现为ASTc的增高;当肝细胞坏死或线粒体崩解时,血清中ASTm明显增高;慢性肝病时若发现有ASTm升高则提示有活动性肝细胞损伤。
乳酸脱氢酶及其同工酶的测定亦可作为肝细胞损伤的诊断指标,急性肝炎时LDH同工酶谱的特点是LDH5增高,LDH1、LDH2降低。
酒精性肝炎有γ-GT增高,认为酒精可造成肝细胞微粒体损伤,导致血清中γ-GT的活性增高。

肝功能实验报告引言肝是人体最大的内脏器官,承担着多种重要的生理功能,包括代谢、解毒、合成和储存等。
肝脏疾病是世界范围内的严重健康问题,因此对肝功能进行实验研究具有重要意义。
本实验旨在通过一系列肝功能指标的检测,评估肝功能的健康程度和潜在风险。
实验设计本实验采用多种常用的实验方法,包括生化指标检测、功能评估和影像学观察等。
生化指标检测为了评估肝脏功能的整体状态,我们对参与实验的对象进行了一系列生化指标的检测。
首先,我们检测了血清中的丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)的水平,用于评估肝细胞损伤的程度。
此外,我们还检测了总胆红素的水平,以判断肝脏排泄功能是否正常。
功能评估为了评估肝脏对药物代谢和解毒的功能,我们使用了乙醇饮酒实验。
通过观察实验对象在饮酒后对乙醇的代谢速度来评估肝脏的酒精代谢能力。
影像学观察为了观察肝脏结构和形态的变化,我们使用了超声波技术。
通过超声波检测,可以检查肝脏的大小、形状和结构,以判断是否存在肝脏肿瘤、囊肿等异常情况。
结果与分析经过实验测定和观察,我们得到了以下结果:1. 生化指标检测:血清ALT和AST的水平较高,表明肝细胞损伤较为明显;总胆红素的水平正常,表明肝脏排泄功能良好。
2. 功能评估:实验对象在饮酒后乙醇代谢速度较慢,表明肝脏酒精代谢能力较差。
3. 影像学观察:肝脏结构整体正常,未观察到肿瘤、囊肿等异常情况。
根据以上结果分析,可以初步判断实验对象的肝功能受损程度较为严重,存在明显的肝细胞损伤和代谢功能不良的问题。
鉴于此,我们建议实验对象应尽快就医,接受进一步的检查和治疗。
结论肝功能是人体健康的重要保障之一,通过肝功能实验的一系列指标检测和评估,可以帮助我们判断肝脏健康状况,采取相应的措施保护和修复肝脏。
本次实验结果表明,实验对象的肝功能受损较为严重,需要及时求医治疗。
在今后的研究中,我们将进一步探索肝功能相关的疾病发生机制,寻找并开发新的治疗方法和药物,以提高肝疾病的预防和治疗效果,为人类健康做出更大的贡献。



肝功能常见检查项目及意义肝功能化验(详细解读肝功能化验单)2008年09月13日星期六 02:25 P.M.临床上检查肝功能的目的在于探测肝脏有无疾病、肝脏损害程度以及查明肝病原因、判断预后和鉴别发生黄疸的病因等。
目前,能够在临床上开展的肝功能试验种类繁多,不下几十种,但是每一种试验只能探查肝脏的某一方面的某一种功能,到现在为止仍然没有一种试验能反映肝脏的全部功能。
因此,为了获得比较客观的结论,应当选择多种试验组合,必要时要多次复查。
同时在对肝功能试验的结果进行评价时,必须结合临床症状全面考虑,避免片面性及主观性。
由于每家医院的实验室条件、操作人员、检测方法的不同,因此不同医院提供的肝功能检验正常值参考范围一般也不相同。
在这里我们不再罗列每个项目的正常值参考范围,只就每个项目的中文名称、英文代码及有何主要临床意义作一介绍。
反映肝细胞损伤的项目以血清酶检测常用,包括丙氨酸氨基转移酶(俗称谷丙转氨酶ALT)、门冬氨酸氨基转移酶(俗称谷草转氨酶AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT或GGT)等。
在各种酶试验中,ALT和AST能敏感地反映肝细胞损伤与否及损伤程度。
各种急性病毒性肝炎、药物或酒精引起急性肝细胞损伤时,血清ALT最敏感,在临床症状如黄疸出现之前ALT就急剧升高,同时AST也升高,但是AST升高程度不如ALT。
而在慢性肝炎和肝硬化时,AST升高程度超过ALT,因此AST主要反映的是肝脏损伤程度。
在重症肝炎时,由于大量肝细胞坏死,血中ALT逐渐下降,而此时胆红素却进行性升高,即出现“胆酶分离”现象,这常常是肝坏死的前兆。
在急性肝炎恢复期,如果出现ALT正常而γ-GT持续升高,常常提示肝炎慢性化。
患慢性肝炎时如果γ-GT持续超过正常参考值,提示慢性肝炎处于活动期。
反映肝脏分泌和排泄功能的项目包括总胆红素(Tbil)、直接胆红素(Dbil)、总胆汁酸(TBA)等的测定。
当患有病毒性肝炎、药物或酒精引起的中毒性肝炎、溶血性黄疸、恶性贫血、阵发性血红蛋白尿症及新生儿黄疸、内出血等时,都可以出现总胆红素升高。


一、实验目的1. 了解急性肝损伤的实验方法及原理。
2. 掌握急性肝损伤动物模型的建立方法。
3. 学习观察肝损伤指标的变化,评估肝损伤程度。
4. 探讨不同药物对急性肝损伤的保护作用。
二、实验原理急性肝损伤是指由多种因素导致的肝脏急性损伤,如药物、毒素、酒精等。
本实验采用CCl4诱导的小鼠急性肝损伤模型,通过观察肝功能指标的变化,评估肝损伤程度,并探讨不同药物对急性肝损伤的保护作用。
三、实验材料1. 实验动物:ICR小鼠,体重18-22g,雌雄不限。
2. 试剂与仪器:CCl4、橄榄油、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)试剂盒、酶标仪、离心机等。
四、实验方法1. 实验分组:将60只ICR小鼠随机分为6组,每组10只,分别为正常对照组、模型组、阳性对照组、药物高剂量组、药物中剂量组和药物低剂量组。
2. 建立急性肝损伤模型:除正常对照组外,其余各组小鼠按20mg/kg剂量腹腔注射CCl4橄榄油溶液,正常对照组注射等体积的橄榄油。
3. 给药:阳性对照组给予联苯双酯(200mg/kg),药物高、中、低剂量组分别给予不同剂量的药物,正常对照组和模型组给予等体积的生理盐水。
4. 样本采集:给药后24小时,各组小鼠眼球取血,分离血清,测定ALT、AST和TBIL。
5. 数据处理:采用SPSS 19.0统计软件进行数据分析,组间比较采用单因素方差分析。
五、实验结果1. 各组小鼠ALT、AST和TBIL水平比较:与正常对照组相比,模型组ALT、AST和TBIL水平显著升高(P<0.01);与模型组相比,阳性对照组和药物高、中、低剂量组ALT、AST和TBIL水平均显著降低(P<0.01)。
2. 药物对急性肝损伤的保护作用:与模型组相比,药物高、中、低剂量组ALT、AST和TBIL水平均显著降低,且呈剂量依赖性。
六、实验结论1. 本实验成功建立了CCl4诱导的小鼠急性肝损伤模型。

第一节肝脏病常用的实验室检测项目为发现肝脏损伤及了解、评估肝脏各种功能状态而设计的众多实验室检测方法,广义上可统称为肝功能试验(1iver function test,LFTs)。
肝癌标志物、肝炎病毒血清标志物及基因检测因不属基本肝功能范畴,在其他相关章节中讲述。
一、蛋白质代谢功能检测除γ球蛋白以外的大部分血浆蛋白,如清蛋白、糖蛋白、脂蛋白、多种凝血因子、抗凝因子、纤溶因子及各种转运蛋白等均在肝脏合成,当肝细胞受损严重时这些血浆蛋白质合成减少,尤其是清蛋白减少,导致低清蛋白血症。
临床上可出现水肿,甚至出现腹水与胸水。
γ球蛋白为免疫球蛋白,由B淋巴细胞及浆细胞产生。
当肝脏受损,尤其是慢性炎症时,刺激单核一吞噬细胞系统,γ球蛋白生成增加。
当患严重肝病时血浆纤维蛋白原、凝血酶原等凝血因子合成减少,临床上出现皮肤、黏膜出血倾向。
体内氨基酸及核酸代谢产生的氨在肝脏内通过鸟氨酸循环合成尿素、经肾脏排出体外,从而维持血氨正常水平,当肝细胞严重损害时,尿素合成减少,血氨升高,临床上表现为肝性脑病。
由于肝脏参与蛋白质的合成代谢与分解代谢,通过检测血浆蛋白含量及蛋白组分的相对含量(蛋白电泳)、凝血因子含量及血氨浓度,可了解肝细胞有无慢性损伤及其损害的严重程度。
(一)血清总蛋白和清蛋白、球蛋白比值测定90%以上的血清总蛋白(serum total protein,STP)和全部的血清清蛋白(albumin,A)是由肝脏合成,因此血清总蛋白和清蛋白含量是反映肝脏合成功能的重要指标。
清蛋白是正常人体血清中的主要蛋白质组分,肝脏每天大约合成120 mg/kg,半衰期19~21天,分子量为66 000,属于非急性时相蛋白,在维持血液胶体渗透压、体内代谢物质转运及营养等方面起着重要作用。
总蛋白含量减去清蛋白含量,即为球蛋白(globulin,G)含量。
球蛋白是多种蛋白质的混合物,其中包括含量较多的免疫球蛋白和补体、多种糖蛋白、金属结合蛋白、多种脂蛋白及酶类。


肝损害的诊断标准摘要:一、肝损害的诊断方法二、肝损害的诊断标准1.生物化学指标2.临床表现3.影像学检查4.组织学检查三、肝损害的鉴别诊断四、诊断肝损害的重要性五、总结正文:肝损害是指肝脏细胞受到各种原因引起的损伤,导致肝脏功能异常。
准确的诊断对于治疗和预后至关重要。
本文将介绍肝损害的诊断方法、诊断标准以及鉴别诊断。
一、肝损害的诊断方法1.生物化学指标:主要包括肝功能试验,如血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)和γ-谷氨酰转肽酶(GGT)等。
这些指标升高提示肝脏受损。
2.临床表现:包括乏力、食欲不振、腹胀、腹痛、体重减轻等。
此外,皮肤瘙痒、黄疸、腹水、下肢水肿等症状也可见于肝损害患者。
3.影像学检查:包括超声、CT、MRI等。
这些检查可以发现肝脏大小、形态、密度等方面的异常,为肝损害的诊断提供依据。
4.组织学检查:通过肝穿刺活检,观察肝脏组织的细胞损伤程度、炎症程度和纤维化程度,从而确定肝损害的类型和程度。
二、肝损害的诊断标准1.生物化学指标:血清ALT、AST等酶学指标升高,超过正常范围。
2.临床表现:伴有乏力、食欲不振、腹胀等症状。
3.影像学检查:肝脏大小、形态、密度等方面存在异常。
4.组织学检查:肝脏组织病理学表现为细胞损伤、炎症和纤维化。
三、肝损害的鉴别诊断根据患者的病史、临床表现和检查结果,与其他引起肝功能异常的疾病进行鉴别诊断,如病毒性肝炎、药物性肝损害、酒精性肝病、脂肪肝等。
四、诊断肝损害的重要性准确的诊断对于指导治疗、评估预后和预防并发症具有重要意义。
早期诊断和治疗可降低病死率,改善患者生活质量。
五、总结肝损害的诊断依据包括生物化学指标、临床表现、影像学检查和组织学检查。
诊断肝损害的重要性在于为治疗和预后提供依据。

肝功能12项肝功能12项是指通过对肝脏进行检测,综合评估肝脏功能的12个指标。
以下是对各项指标的简要介绍。
1. 谷草转氨酶(AST)和谷丙转氨酶(ALT):AST和ALT 是肝脏细胞损伤时释放的酶,其水平的升高可能意味着肝细胞损伤。
2. 总胆红素(TBil)和直接胆红素(DBil):这些指标用于评估肝脏对胆红素的代谢和排泄功能,其中升高的水平可能表明肝胆排泄功能异常。
3. 血清白蛋白(Alb):白蛋白是肝脏合成的重要蛋白质,其水平的降低可能意味着肝脏合成功能不良。
4. 血清总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C):这些指标用于评估肝脏对脂质代谢的影响。
5. 总蛋白(TP)和球蛋白(Glo):TP和Glo是评估肝脏合成蛋白质功能的指标,其中降低的水平可能表明肝脏合成功能受损。
6. 碱性磷酸酶(ALP):ALP是一种肝脏外泌酶,其水平的升高可能意味着胆汁淤积或肝胆损伤。
7. 血清谷氨酰转肽酶(GGT):GGT是另一种肝脏外泌酶,其水平的升高可能与肝胆疾病有关。
8. 总胆汁酸(TBA):TBA是评估肝胆系统功能的指标,其水平升高可能意味着肝胆排泄功能异常。
9. α-L-岩藻糖苷酶(α-L-Fucosidase):α-L-Fucosidase是一种肝脏酶,其水平的升高可能与肝脏疾病有关。
10. 右旋乳酸脱氢酶(D-LDH):D-LDH是一种肝脏特异酶,其水平的升高可能意味着肝细胞损伤。
11. 胆碱酯酶(CHE):CHE是评估肝脏合成胆碱能神经递质的功能的指标,其水平降低可能意味着肝功能异常。
12. 血尿素氮(BUN)和肌酐(Cr):这些指标用于评估肝脏对氮代谢的影响,其中升高的水平可能表示肝功能异常。
通过对这些指标进行综合分析,可以全面评估肝脏功能的状况,辅助诊断肝疾病或监测肝脏健康状态。
这些指标的异常水平可能表明肝脏受损或功能异常,需要进一步的检查和治疗。
谷丙转氨酶、谷草转氨酶等肝细胞指标分布、损伤相关血清指标参考值及临床意义
谷丙转氨酶(ALT)和谷草转氨酶(AST)是临床应用最广泛的反映肝细胞损伤的生化指标。
ALT主要分布于肝细胞胞浆,肝内浓度较血清高3000倍,是肝细胞损害的敏感指标;AST主要分布于肝细胞线粒体,少数分布于胞浆,如肝功能试验中发现AST浓度升高,说明肝细胞损伤的比较重,或者说主要损侵犯肝细胞的线粒体为主。
测定血清AST、ALT水平及AST/ALT比值有利于肝功能异常的诊断和鉴别。
参考范围
对于血清ALT和AST的正常值上限(ULN),目前尚无一致意见。
正常情况下,血清ALT和AST的浓度低于30-40U/L。
一般按照国际惯例,ALT ULN:男40U/L,女35U/L。
临床意义
急性肝炎和慢性肝炎的轻型:肝细胞虽有损伤,但细胞内的线粒体仍保持完整,故释放入血的主要是存在于肝细胞浆内的ALT和AST,以ALT的升高为主,AST/ALT<1。
重型肝炎和慢性肝炎的中型和重型:肝细胞内的线粒体也遭到了破坏,AST从线粒体漏出,表现出AST/ALT>1。
但当肝脏损伤发展到一定严重程度,症状恶化时,肝细胞大量坏死导致ALT枯竭,而胆红素进行性升高,表现为黄疸进行性加深,即出现“酶胆分离”现象,提示肝细胞严重破坏,预后不佳。
肝硬化和肝癌患者:线粒体的破坏程度更加严重,AST升高更加
明显,AST/ALT>1,甚至>2。
酒精性肝病患者:AST升高明显,ALT可正常,AST/ALT常>2,可伴γ-谷氨酰转肽酶(GGT)明显升高。
自身免疫性肝炎:ALT、AST明显升高,同时γ-球蛋白或IgG≥1.5倍正常值上限。
肝细胞实质损伤指标、胆红素代谢及胆汁淤积指标、肝脏合成功能指标、肝纤维化指标等肝功能指标参考值、临床表现和疾病指示❶丙氨酸氨基转氨酶(ALT)ALT(正常参考值为 0-40 U/L)主要存在于各种细胞中,尤以肝细胞为最,其次是肾脏、心肌和骨骼肌。
在各种急慢性肝脏疾病中(如病毒性肝炎、药物性肝炎、酒精性或非酒精性硬化等),肝细胞出现变性、坏死、细胞膜通透性增加等,ALT 大量释放入血中,因此 ALT 是反映肝细胞损害的敏感指标。
肝细胞受到损坏都可以引起 ALT 的升高,一般以 ALT 超过正常参考值上限 2.5 倍,持续异常超过半个月,作为诊断肝炎的标准。
但 ALT 升高程度与肝细胞损坏程度不一定成正比关系,急性重症肝炎时,由于肝细胞短时间内大量坏死,胆汁代谢异常,胆红素水平升高,转氨酶因大量消耗而迅速下降,出现酶-胆分离现象,提示预后不良。
❷天冬氨酸氨基转氨酶(AST)AST(正常参考值为 0-40 U/L)主要分布在心肌,其次是肝脏、骨骼肌和肾脏。
在肝细胞中,大约 80% 的 AST 存在于线粒体内。
正常人血清中含量很低,但当肝细胞或心肌细胞受损时,由于细胞膜通透性增加,胞浆内的 AST 释放入血浆,致使血清中转氨酶活性升高。
在急性病毒性肝炎时,血清 AST 活性明显增高,一般为正常参考值上限的 10-30 倍,当血清 AST 活性增高持续超过 ALT 活性时,提示肝炎病变呈慢性化和进展性。
另外,肝硬化、肝癌、肝淤血、胆道梗阻也可出现轻度增高现象。
❸AST/ALT 比值各种致病因素所致肝病均会引起 ALT 和 AST 不同程度升高,对ALT 和 AST 活性及 AST/ALT 分析可用于疾病诊断、鉴别及评估病情。
1)急性病毒性肝炎时虽有肝细胞损伤,但肝细胞线粒体仍保持完整,故释放入血的主要是存在于肝细胞浆内的 ALT,所以肝功能异常主要表现为 ALT 升高,AST/ALT 的比值 < 1。
肝损伤主要表现为肝脏酶学改变、胆红素代谢异常、物质合成功能障碍以及生物降解功能下降,但不同疾病所引起的生化异常和结构改变在性质和程度上各具特征;此外,胆道疾病亦可引起肝功能异常;肝脏生化检查是临床常用的实验室检测项目,主要包括ALT、AST、总蛋白、白蛋白Alb、球蛋白、TBil和DBil等指标;近年来肝脏生化检查又新增了一些项目,如铁蛋白、前白蛋白prealbumin,PA、透明质酸HA等;各检测指标具有不同的临床意义,可以将其分为四类:肝细胞损伤标志物、胆红素代谢标志物、肝脏合成功能标志物以及肝纤维化相关血清指标;通过对这些检查指标的分析可以判断疾病的性质以及严重程度,为疾病诊断和治疗提供依据;肝细胞损伤标志物氨基转移酶ALT和AST是临床应用最广泛的反映肝细胞损伤的生化指标;ALT主要分布于肝细胞胞浆,AST主要分布于肝细胞线粒体,少数分布于胞浆;当致病因素导致肝细胞变性、细胞膜通透性增加时,从细胞内释放的主要是ALT;而当肝细胞严重损伤、坏死时,线粒体内的AST 便释放出来,导致血清AST显着升高;轻型肝炎发生时,AST/ALT比值下降,重型肝炎、肝硬化和肝癌发生时,AST/ALT比值上升;因此,测定血清AST、ALT水平及AST/ALT比值有利于肝功能异常的诊断和鉴别;生理状态下,血清中ALT和AST活性较低,通常低于40U/L;在致病因子的作用下,肝细胞变性和坏死都会导致细胞内ALT和AST释放入血引起血清转氨酶活性升高;各种致病因素所致肝病会引起ALT和AST不同程度升高,因此,对于ALT和AST活性的分析可用于疾病诊断和鉴别以及评估病情严重程度;各种肝脏疾病都能引起转氨酶轻至中度升高,因此,中等程度以下<300U/L的转氨酶升高无特异性;若ALT急剧升高>1000U/L,提示存在大量肝细胞坏死,其最常见的疾病有急性病毒性肝炎、毒物或药物性肝损伤、急性缺血性肝病等;此外,重症自身免疫性肝炎和肝豆状核变性也能导致转氨酶急剧升高,但同时伴有自身免疫性抗体升高或铜代谢异常;如果致病因素持续存在,肝细胞长期遭受损伤将会引起转氨酶长期升高,常见疾病有慢性病毒性肝炎乙型肝炎和丙型肝炎、酒精性肝病、非酒精性脂肪肝以及药物性肝损伤;少见疾病有自身免疫性肝病、肝豆状核变性等;在我国,由于HBV感染率甚高,因此慢性乙型肝炎是导致转氨酶长期、反复升高的主要原因,这类患者转氨酶升高以ALT为主,并且AST与ALT的比值AST/ALT常<1,结合病毒学检查容易快速明确诊断;而对于酒精性肝病患者,血清转氨酶水平通常<400U/L,并且以AST升高为主;对于长期大量饮酒者,AST/ALT>2提示酒精性肝病可能,AST/ALT>3更具有诊断意义;另外,药物性肝损伤也是肝功能异常的常见原因;长期服用抗结核药如异烟肼、利福平、氮唑类抗真菌药以及抗抑郁药等均可引起血清转氨酶持续升高,停药后肝功能迅速恢复正常;除了肝脏病变外,其他系统的疾病也能导致血清转氨酶持续性升高,如甲状腺功能亢进、感染性腹泻、神经性厌食症、Addison病以及肌病等;这些疾病引起的血清转氨酶升高往往处于中低水平,当原发疾病被有效控制后,ALT 和AST亦逐渐恢复正常;表1列举了常见的引起转氨酶升高的疾病;碱性磷酸酶ALP血清中ALP主要来自于肝脏、骨骼和肠道,临床上测定ALP主要用于骨骼、肝胆系统疾病等的鉴别诊断,尤其是黄疸的鉴别诊断;胆道梗阻时,血清中ALP显着升高,并与胆道梗阻程度和时间呈正比,而此时ALT升高不明显,因此ALT/ALP比值较小,通常<2;在肝细胞损伤时,ALT显着升高,ALP不升高或轻度升高<3倍正常值上限,ALT/ALP比值较大,通常>5;而当ALT/ALP介于2~5时,提示肝细胞和胆道均受累及;值得注意的是,多种因素可引起正常人血清ALP显着升高;正常小儿ALP活性可达正常成人的2~5倍;餐后尤以高脂餐小肠分泌的ALP进入血中,一般可增高30U/L或更高,在B或O血型人中可持续12h;妊娠亦可引起ALP 升高,可达2~3倍正常值上限;因此,在分析ALP升高时应排除以上几种特殊情况;图1为ALP升高时的诊断流程图;γ-谷氨酰转肽酶GGTGGT主要分布于肾、肝、胰腺,但肾脏释放的GGT主要经尿液排出;血清GGT主要来自于肝脏,而肝脏GGT主要分布于胆管上皮细胞和肝细胞膜管腔面,二者在发生变性和坏死时会导致GGT大量溶解释放入血,引起血清GGT升高;因此GGT升高提示肝脏疾病,尤其是胆道疾病;肝外胆汁淤积由胆结石、胆管炎、胰头癌引起和肝癌的GGT明显增高,可高达5~30倍正常值上限;梗阻初期,GGT/AST比值为3~6,长期梗阻GGT/AST比值常>6;肝实质性疾病如急性肝炎时:GGT通常轻度升高;脂肪肝、肝硬化活动期时:GGT一般轻度升高;慢性肝炎及肝硬化非活动期:GGT可见正常;此外,血清GGT主要来自于肝脏,因此其可以用于辅助判断ALP的来源;ALP升高,GGT正常,表明ALP来自于骨骼或肠道;若二者均升高,表明ALP 来自肝脏,提示肝胆系统存在疾病;胆红素代谢标志物胆红素由肝脏产生,经胆道排泄,肝在胆红素代谢中具有摄取、结合和排泄作用;胆红素测定包括TBil和DBil,二者之差为间接胆红素IBil,多种致病因素可引起血清胆红素升高,导致黄疸;临床上将黄疸分为四类:1溶血性黄疸;2梗阻性黄疸;3肝细胞性黄疸;4先天性胆红素代谢障碍;当发生血管内溶血或红细胞大量破裂时,体内产生大量IBil而超过肝脏的摄取和代谢能力,血中IBil显着升高,引起溶血性黄疸,而此时DBil、ALT、AST和ALP基本正常;当胆道因为结石、肿瘤或周围肿物压迫致其梗阻时,肝细胞分泌的DBil排出受阻,由于胆管内压增高致使DBil逆流入血液,因此出现血中DBil显着升高,IBil不升高或轻度升高,且伴肝脏酶学改变,此为梗阻性黄疸;而当肝细胞受损时,一方面肝脏无法完全摄取和结合IBil,另一方面肝细胞内的DBil会从受损的肝细胞释出,因此导致血液中DBil和IBil均升高,同时转氨酶也显着升高,即导致肝细胞性黄疸;此外,Gilbert综合征因肝细胞摄取IBil障碍以及肝细胞微粒体中葡萄糖醛酸转移酶不足导致血液中IBil显着升高;Dubin-Jonhson 综合征主要因为肝细胞无法将DBil排泄至毛细胆管而致DBil升高;上述3种胆红素代谢障碍性肝病均不引起肝脏酶学显着改变;据此可初步判断黄疸的类型和原因;图2为高胆红素血症诊断流程图;肝脏合成功能标志物白蛋白Alb肝脏是人体合成Alb的唯一器官,合成后供机体需要,且几乎不被排出,其在血浆中的半衰期约为21d,因此Alb的高低反映肝脏合成代谢功能和储备功能,也是评估肝硬化严重程度及判断预后的指标;Alb增高主要由于血液浓缩而致相对性增高;在正常饮食和肾功能正常情况下,Alb降低可能与肝功能异常、肝脏合成蛋白质功能下降有关;Alb<30g/L时部分患者出现或将要出现腹水,至25g/L以下时预后不良,降至20g/L时预后极差;需要指出的是,由于Alb半衰期长,其不能用于评估急性肝损伤;凝血酶原时间PT血浆PT是评价肝脏合成功能的另一指标,该指标检测血液凝固时间,它需要肝脏产生的II、V、VII、IX因子的参与;当肝细胞广泛受损时,肝脏合成凝血因子的能力下降,导致PT延长,超过3s以上为异常;4~6s时,表明严重的肝损伤且预后极差;在反应肝功能急性损伤方面,PT优于Alb;由于在肝脏疾病早期仅有VII因子合成减少,因此PT出现延长早于活化部分凝血激酶时间;PA和血清假性胆碱酯酶pseudocholinesterase,PChE二者均由肝脏合成,半衰期分别为和10d=;其中,PA由于半衰期短,能快速、敏感地反映肝细胞的损伤和肝脏的合成功能;研究表明急性肝炎时PA异常率为34%,而Alb异常率仅为17%,因此PA能更灵敏地反映肝细胞损伤,可作为判断急性肝损伤的灵敏指标;此外,动态监测PA能反映肝衰竭患者肝脏合成功能的好转或恶化情况,动态观察PA升高明显者预后好,降低或升高不明显者预后差,故观察PA早期动态变化能作为肝衰竭预后的判断指标之一;肝纤维化相关血清指标透明质酸HAHA是一种分布在细胞外基质的氨基葡聚糖,主要由肝星状细胞或纤维母细胞合成,由窦状内皮细胞降解,在众多的肝纤维化指标中,HA的敏感性最高;急性肝炎时血清HA多正常,慢性肝炎或肝硬化时由于肝脏代谢能力下降,HA清除减少,使血清HA水平升高,并且其升高水平与肝脏炎症或肝纤维化程度呈正相关;IV型胶原type IV collagen,C IV和层黏蛋白laminin,LNC IV与LN均是构成基底膜的主要成分,当肝脏持续损伤时,二者合成增加,而肝脏对其降解能力降低,出现毛细血管化;同时,血清中C IV与LN升高,且其升高程度与肝纤维化程度具有相关性;转化生长因子TGFβ1TGFβ1是目前已知的最重要的肝星状细胞活化因子,在正常情况下与其他细胞因子处于一种网络平衡状态,共同维持肝脏内环境的相对稳定;肝脏慢性炎症时,Kupffer细胞大量浸润并分泌TGFβ1,TGFβ1进一步激活星状细胞和其他间质细胞分泌TGFβ1,因此导致血循环中TGFβ1水平升高,并且随肝纤维化程度加重逐渐升高;此外,Ⅲ型前胶原、血小板衍生生长因子-BB、基质金属蛋白酶-1、基质金属蛋白酶抑制剂-1、α巨球蛋白等指标亦具有诊断肝纤维化的价值;上述各血清指标具有较好的特异性,但敏感性差,单一指标诊断肝纤维化的作用有限,因此常联合检测多项指标诊断肝纤维化;近年来国内外建立了一系列基于各种血清指标的肝纤维化无创性诊断模型,代表性的有FibroTest其参数包括α巨球蛋白、血清载脂蛋白A1、GGT、胆红素及肝内珠蛋白、APRI指数AST与血小板比值指数和Forns 指数其参数包括血小板计数、GGT、年龄和胆固醇等;国内同行也提出SLFG模型其参数包括α巨球蛋白、年龄、GGT和HA、S指数其参数包括GGT、血小板和Alb等评价慢性HBV感染所致肝纤维化;这些诊断模型能较好的区分S2及以上肝纤维化,但对更早期肝纤维化的诊断作用极其有限;肝功能异常诊断思路1病史采集,包括肝炎病毒接触史、饮酒情况、不洁饮食、药物毒物史、家族史等;2体格检查,包括皮肤巩膜颜色、肝脏大小、肝区触痛、Murphy征等;3实验室检查,包括生化常规、病原学检测、免疫球蛋白分类定量和自身抗体等;4影像学检查,包括腹部B超、CT、磁共振成像等;5肝穿刺活组织检查,对于病因不明或需要进行评估病情的患者,有必要行肝穿刺活组织检查;由于引起肝功能异常的病因较多,既有肝脏本身的疾病,也有其他系统的疾病,对于肝损伤的诊断有时显得较为困难,因此需结合病史、实验室检查和影像学等多方面的信息才有可能明确诊断;小结肝脏生化检查,包括肝脏酶学检查、胆红素代谢检查、肝脏合成功能检查及肝纤维化血清学指标等,能较全面地反映肝脏功能状态,为肝功能异常的诊断提供重要线索,并能动态监测病情,是临床应用最广泛的实验室指标;除此之外,肝功能异常的诊断还需要详细的病史采集和全面的体格检查,以及病原学检测和B超、CT等影像学检查资料甚至肝活组织病理检查;只有将多方面的资料综合起来才能最终确定病因,评估病情,明确诊断,进而指导下一步的治疗;。
・述评・作者单位:510300 广州复大肿瘤医院肿瘤内科肝功能试验的评价徐克成 近年来,肝功能试验的品种和数量并无增加,相反,有些试验己被废弃,有些则限于研究或特殊情况下应用,但对一些常用试验的认识和解释有发展[1]。
现对常用肝功能试验作一评价。
1.血清转氨酶:包括丙氨酸转氨酶(AL T )和天冬氨酸转氨酶(AST ),迄今仍被认为是肝细胞损害的“金标准”[2]。
在临床应用中应注意[3]:①肝病时酶活性升高幅度越高,相对特异性也越高;大于正常上界10倍仅见于急性病毒性肝炎、中毒性(药物性)肝坏死和缺血性肝炎;②虽然酶活性水平反映肝坏死程度,但与病理改变之间不一定相关;酶活性下降可以是疾病恢复的表现,也可提示预后严重,后种情况见于肝细胞坏死殆尽,无能力产生转氨酶;③酒精性肝病时AL T 无明显升高,此与乙醇引致的吡哆醇缺乏有关;④急性胆道梗阻早期酶活性可升高至正常的8倍以上,但不论梗阻有无消除,24~72h 内均可降至正常或接近正常水平;⑤约20%的转氨酶升高一时找不到原因,应检查有无血色病、Wilson 病或α12抗胰蛋白酶缺乏性肝病以及某些非肝性疾病,如乳糜泻、Addison 病、神经性厌食、肌炎或过度运动后肌肉损伤。
有报道40%以上的乳糜泻病人肝活检显示不同程度脂肪变性、炎症和纤维化。
计算血清AST/AL T 比值有助于鉴别肝病,比值>2.0提示酒精性肝病;非酒精性脂肪性肝炎时常小于1.0;病毒性肝炎时比值小于1.0,如向肝硬化发展,则比值逐步增高[4]。
血清线粒体AST 升高主要见于酒精性肝病,监测此种AST 可作为病人是否戒酒的指标。
但在急性肝坏死时线粒体AST 也会升高。
2.碱性磷酸酶(AL P ):该酶为胆汁淤积的经典标志。
判断结果时需注意:①肝内和肝外胆汁淤积均可明显升高,无助于两者的鉴别;②由于AL P 升高是肝、胆细胞在胆汁诱导下合成增加所致,需要一定时间,因此在急性化脓性胆管炎早期血清中该酶活性可不升高;③肝癌和某些浸润性肝病时血清AL P 升高,系局限性胆道梗阻诱导酶合成所致,但在霍奇金病、肾细胞癌等肿瘤时,虽无肝受累也可升高;④败血症、艾滋病伴全身感染时AL P 可显著升高,原因不明;⑤AL P 活性降低可发生于甲状腺功能减退、恶性贫血、锌缺乏和先天性低磷酸酶血症。
肝细胞损伤时的肝功能试验
一、肝细胞损伤时的肝功能检验指标(表10-18)
二、急性肝细胞损伤的检验指标
能引起急性肝细胞损伤的因素有感染(如病毒性肝炎)、中毒(药物及化学毒物中毒)、乙醇等。
反映肝细胞损伤的检验指标有:血清酶类的测定,血清铁的测定,F抗原等。
(一)血清酶活性的测定
常用来反映肝细胞损伤以及判断损伤程度的酶有丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、乳酸脱氢酶(LDH)、谷氨酸脱氢酶(GLDH)、腺苷脱氨酶(ADA)、鸟嘌呤酶(GU)等。
这些酶中常用的重要的酶仍为ALT和AST,它们能敏感地提示肝细胞的损伤及损伤的程度。
反映急性肝细胞损伤时,以ALT为最敏感,而反映损伤程度时AST较为敏感。
一般认为AST大部分存在于肝细胞线粒体中(ASTm),当肝细胞损伤较严重时ASTm释放入血液循环中,AST/ALT>1。
有人主张当AST、ALT活性增高(达正常20倍)情况下,AST/ALT的比值不同类型的肝细胞损伤其比值不同。
急性病毒性肝炎、药物性肝损伤时AST/ALT<1;重症肝炎、乙醇性肝炎时AST/ALT>1;正常人血清AST/ALT比值平均为1.15;急性病毒性肝炎早期或轻型肝炎时比值降至0.56,至
恢复期比值逐渐上升;肝硬化代偿期AST/ALT比值为1.5-0.7,失代偿期为1.8-0.7;肝癌时比值明显上升,半数病例>3.0。
AST同工酶的测定有助于判断肝损伤病变程度。
AST同工酶包括细胞质AST(ASTc)和线粒体AST(ASTm),当肝细胞通透性增加时表现为ASTc的增高;当肝细胞坏死或线粒体崩解时,血清中ASTm明显增高;慢性肝病时若发现有ASTm升高则提示有活动性肝细胞损伤。
乳酸脱氢酶及其同工酶的测定亦可作为肝细胞损伤的诊断指标,急性肝炎时LDH同工酶谱的特点是LDH5增高,LDH1、LDH2降低。
酒精性肝炎有γ-GT增高,认为酒精可造成肝细胞微粒体损伤,导致血清中γ-GT的活性增高。
(二)血清铁测定
急性肝炎时血清铁增高,一般认为是由于肝细胞坏死而导致铁从肝细胞中逸出,引起血清铁增高。
(三)F抗原
F抗原又称F蛋白,是一种主要存在于肝细胞质中的蛋白质。
正常人血清中F抗原水平很低(10ng/ml),肝细胞损伤时血清F抗原浓度升高,是一项较灵敏的细胞损伤的指标。
有报道F抗原在药物引起的肝细胞损伤时反映灵敏,药物损伤肝小叶中心的肝细胞,而这一区域F抗原浓度高。
肝癌时F抗原亦升高。
三、慢性肝细胞损伤的检验指标
(一)慢性肝细胞损伤的酶学指标
γ-GT在反映慢性肝细胞损伤及其病变活动时较转氨酶敏感。
γ-GT活性75%存在于肝细胞微粒体,当慢性肝病有活动性病变时,诱导微粒体酶合成增加。
在急性肝炎恢复期ALT活性已正常,如发现γ-GT活性持续升高,即提示肝炎慢性化;慢性肝炎即使ALT正常,如γ-GT持续不降,在排除胆道疾病情况下,提示病变仍在活动;慢性持续性肝炎(CPH)γ-GT轻度增高;慢性活动性肝炎(CAH)γ-GT明显增高;肝细胞严重损伤,微粒体破坏时,γ-GT合成减少,故重症肝炎,晚期肝硬化时γ-GT反而降低。
此外,鸟氨酸氨甲酰基转移酶(OCT)、腺苷脱氨酶等的活性在慢性肝细胞损伤时可以增高,而卵磷酯胆固醇酰基转移酶(LCAT)、胆碱酯酶(ChE)活性则在慢性肝病时因酶合成减少而降低。
(二)慢性肝细胞损伤时血浆蛋白的变化
血浆白蛋白可反映肝脏合成功能,代表肝的储备功能。
此外前白蛋白(PA)及抗凝血酶Ⅲ(AT-Ⅲ)亦能很好地反映肝脏的储备能力,藉以判断慢性肝细胞损伤的病变程度。
γ-球蛋白增高的程度可评价慢性肝病的演变及预后,慢性持续性肝炎的γ-球蛋白正常或基本正常,慢性活动性肝炎及早期肝硬化时γ-球蛋白呈轻、中度升高,若γ-球蛋白增高达40%时提示预后不佳。
γ-球蛋白增高的机制是枯否细胞功能减退,不能清除血循环中内源性或肠源性抗原物质,后者刺激B细胞产生大量抗体IgG,以致γ-球蛋白增高。
ICG排泄试验测15分钟滞留率可用于筛选慢性职业中毒肝损伤、追踪慢性肝病的恢复和急性肝病的慢性化过程。
四、肝纤维化的生化诊断
肝纤维化是肝硬化前期的必经阶段,目前常规的肝功能试验无法诊断肝纤维化或早期肝硬化。
因此肝纤维化的血清标志物在临床上有重要诊断价值。
肝纤维化的实质是细胞外间质的结缔组织增生,其成分主要是胶原蛋白,还有各种糖蛋白和蛋白多糖等。
肝组织中肝实质细胞约占78%,肝窦壁细胞约占6%-7%,由上述细胞合成和分泌的细胞外基质(extracellular matrix)占肝的5%左右。
在肝硬化时细胞外基质成分较正常肝增加2-20倍。
细胞外基质成分中的胶原蛋白、有关的代谢酶、代谢产物等有的作为肝纤维化的标志物,用于肝纤维化的诊断,现将有临床应用价值的肝纤维化标志物列于表10-19。
五、肝癌的生化诊断原发性肝癌的诊断标志见表10-20。
应当指出:上述肝癌诊断标志虽具有一定的特异性、敏感性,但有的还难以鉴别原发性肝癌与转移性肝癌。
因此,进行几种肝癌诊断标志物的联合检测,可以互补而提高原发性肝癌诊断的阳性率,减少假阳性及假阴性的发生,提高诊断的准确性。