碳酸钠和碳酸氢钠ppt
- 格式:ppt
- 大小:21.35 MB
- 文档页数:26





碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)碳酸钠(Na2CO3)俗名纯碱,又叫苏打.碳酸氢钠(NaHCO3)俗名小苏打.碳酸钠和碳酸氢钠都属于盐类,但都被用做食用碱.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的区别碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)外观白色粉末细小的白色晶体溶解性较大比Na2CO3热稳定性稳定,受热不分解不稳定,受热容易分解溶于水后的酸碱性显较强碱性碱性比Na2CO3碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的各种化学反应.与盐酸反应:Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+2HCl=NaCl+CO2↑+H2O与NaOH溶液反应:Na2CO3不与NaOH反应.NaHCO3+NaOH=Na2CO3+ H2O与Ca(OH) 2或Ba(OH) 2反应:Na2CO3+ Ca(OH) 2= CaCO3↓+2NaOHNaHCO3+ Ca(OH)2= CaCO3↓+H2O+NaOHNa2CO3+ Ba(OH)2= BaCO3↓+2NaOHNaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH与CaCl2或BaCl2反应:Na2CO3+CaCl2= CaCO3↓+2NaClNa2CO3+BaCl2 = BaCO3↓+2NaClNaHCO3不与BaCl2和CaCl2反应Na2CO3和的NaHCO3相互转换向饱和的Na2CO3溶液通入CO2:Na2CO3 + CO2+ H2O =2 NaHCO3加热NaHCO3:2 NaHCO3 == Na2CO3 + H2O + CO2↑鉴别Na2CO3和NaHCO3的方法:①加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3②溶解,向水溶液中加入BaCl2或CaCl2,产生沉淀的是Na2CO3CO2气体中混有HCl气体,如何去除杂质?把混合气体通入Na2CO3或NaHCO3溶液中,Na2CO3或NaHCO3与HCl反应生成CO2。





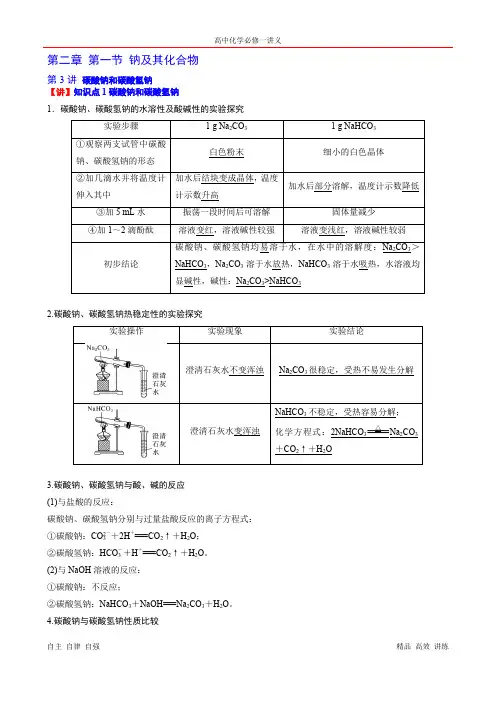
第二章第一节钠及其化合物第3讲碳酸钠和碳酸氢钠【讲】知识点1碳酸钠和碳酸氢钠1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究2.碳酸钠、碳酸氢钠热稳定性的实验探究3.碳酸钠、碳酸氢钠与酸、碱的反应(1)与盐酸的反应:碳酸钠、碳酸氢钠分别与过量盐酸反应的离子方程式:①碳酸钠:CO2-3+2H+===CO2↑+H2O;②碳酸氢钠:HCO-3+H+===CO2↑+H2O。
(2)与NaOH溶液的反应:①碳酸钠:不反应;②碳酸氢钠:NaHCO3+NaOH===Na2CO3+H2O。
4.碳酸钠与碳酸氢钠性质比较【练】1.判断题(1)碳酸氢钠可用于治疗胃酸过多()(2)HCO-3在强酸性、强碱性溶液中均不能大量共存()(3)Na2CO3固体中的NaHCO3可加热除去()(4)Na2CO3、NaHCO3都能与NaOH溶液反应()(5)Na2CO3俗称纯碱,所以Na2CO3属于碱()答案(1)√(2)√(3)√(4)×(5)×2.(1)向Na2CO3溶液中逐滴滴入稀盐酸并振荡,开始几乎无气泡产生,一段时间后有大量气泡产生,试用离子方程式及必要文字解释原因?提示开始盐酸量少,发生反应CO2-3+H+===HCO-3,无气泡,一段时间后当CO2-3完全变成HCO-3后,再滴加盐酸,发生反应HCO-3+H+===H2O+CO2↑,产生大量气泡。
(2)向盐酸中逐滴滴入Na2CO3溶液的现象呢?试用离子方程式及必要文字解释原因?提示开始即有大量气泡,由于盐酸量多,开始直接发生CO2-3+2H+===CO2↑+H2O。
(3)试着利用图像粗略描述上述两种情况,Ⅰ.向Na2CO3溶液中逐滴滴入盐酸,Ⅱ.向盐酸中逐滴滴入Na2CO3溶液。
提示2.根据初中所学CO 2通入澄清石灰水中的现象及反应,联系所学Na 2CO 3、NaHCO 3的性质,思考下列问题。
(1)Na 2CO 3和NaHCO 3相互转化的方法? 提示 Na 2CO 3溶液中通入CO 2①固体加热分解②加NaOH 溶液NaHCO 3(2)能否用加Ba(OH)2的方法鉴别Na 2CO 3、NaHCO 3溶液?试用离子方程式说明原因。
碳酸钠与碳酸氢钠反应
碳酸钠与碳酸氢钠的反应可以看作是两种化合物之间发生的复分解反应。
在水中,碳酸氢钠与碳酸钠可以相互转化。
碳酸氢钠和碳酸钠在水溶液中的反应是可逆的,碳酸氢钠的水解平衡是电离平衡的逆反应,表示生成水解平衡产物和产生氢氧化钠的能力,并且二氧化碳溶于水会产生碳酸氢钠,水解生成碳酸钠,这会进一步增强溶液的碱性。
如果是在常温常压下,反应非常慢,所以日常生活中很少能见到反应的产物。