最新碳酸钠和碳酸氢钠公开课
- 格式:ppt
- 大小:463.50 KB
- 文档页数:17


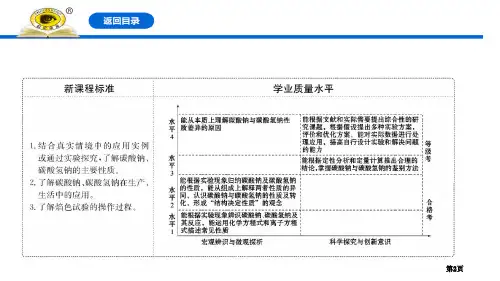
碳酸钠碳酸氢钠白色粉末,可溶于水俗名物理性质纯碱、苏打白色粉末,易溶于水小苏打(Na 2CO 3)(NaHCO 3)碳酸钠碳酸氢钠白色粉末,可溶于水俗名物理性质纯碱、苏打白色粉末,易溶于水小苏打(Na 2CO 3)(NaHCO 3)与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)纯碱不是碱盐溶液不一定呈中性。
碳酸钠碳酸氢钠白色粉末,可溶于水俗名物理性质纯碱、苏打白色粉末,易溶于水小苏打(Na 2CO 3)(NaHCO 3)与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应有气泡冒出有气泡冒出变浑浊变浑浊两者都能与酸反应,放出CO 2(较剧烈)Na 2CO 3+2HCl=2NaCl+H 2CO 3 CO 2↑+ H 2O NaHCO 3+HCl=NaCl+H 2CO 3 CO 2↑+ H 2O与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应Na 2CO 3+2HCl=2NaCl+H 2CO 3 CO 2↑+ H 2O NaHCO 3+HCl=NaCl+H 2CO 3 CO 2↑+ H 2O (较剧烈)233与澄清石灰水反应Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH能反应与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应Na2CO3+2HCl=2NaCl+H2CO3CO2↑+ H2ONaHCO3+HCl=NaCl+H2CO3CO2↑+ H2O(较剧烈)233与澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH能反应热稳定性稳定受热易分解2NaHCO3=Na2CO3+H2O+CO2↑与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应Na2CO3+2HCl=2NaCl+H2CO3CO2↑+ H2ONaHCO3+HCl=NaCl+H2CO3CO2↑+ H2O(较剧烈)233与澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH能反应热稳定性稳定受热易分解2NaHCO3=Na2CO3+H2O+CO2↑用途洗涤剂、造纸、纺织;制NaOH;制玻璃等侯德榜制碱工业先驱联合制碱法(又称侯氏制碱法)与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应Na2CO3+2HCl=2NaCl+H2CO3CO2↑+ H2ONaHCO3+HCl=NaCl+H2CO3CO2↑+ H2O(较剧烈)233与澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH能反应热稳定性稳定受热易分解2NaHCO3=Na2CO3+H2O+CO2↑用途洗涤剂、造纸、纺织;制NaOH;制玻璃等胃药、发酵粉;干粉灭火器、泡沫灭火器等与指示剂作用化学性质能使无色酚酞溶液变红能使无色酚酞溶液变红溶液呈碱性溶液呈碱性(较深)(较浅)(较强)(较弱)与酸反应Na2CO3+2HCl=2NaCl+H2CO3CO2↑+ H2ONaHCO3+HCl=NaCl+H2CO3CO2↑+ H2O(较剧烈)233与澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH能反应热稳定性稳定受热易分解2NaHCO3=Na2CO3+H2O+CO2↑用途洗涤剂、造纸、纺织;制NaOH;制玻璃等胃药、发酵粉;干粉灭火器、泡沫灭火器等D练习:下列关于Na2CO3和NaHCO3的说法中正确的是()A.Na2CO3广泛用于玻璃、造纸、纺织和洗涤剂的生产,俗称小苏打B.做面包时常用到一种既能减少面粉发酵产生的酸,又能使面包松软的白色物质是烧碱C.我国制碱工业先驱侯德榜发明了联合制碱法,制得的纯碱是一种碱D.小苏打可在一定条件下转化为苏打。



碳酸钠和碳酸氢钠公开课教案教案:化学实验——碳酸钠和碳酸氢钠教学目标:1. 了解碳酸钠和碳酸氢钠的基本性质和化学反应。
2. 学会正确使用化学实验器材。
3. 培养学生的实验观察能力和合作精神。
学习内容:1. 碳酸钠和碳酸氢钠的基本性质及化学反应。
2. 碳酸钠和碳酸氢钠溶液的配制方法。
3. 碳酸钠和碳酸氢钠溶液的酸碱中和反应。
实验器材和药品:1. 碳酸钠和碳酸氢钠固体。
2. 硝酸银溶液(0.1mol/L)。
3. 盐酸溶液(1mol/L)。
4. 化学试剂瓶、滴管、试管、玻璃棒等。
实验步骤:1. 准备工作:将碳酸钠和碳酸氢钠固体分别称取适量,分别加入试管中。
2. 碳酸钠溶液的配制:取一定量的碳酸钠固体加入一个试管中,用蒸馏水溶解,摇匀。
3. 碳酸氢钠溶液的配制:取一定量的碳酸氢钠固体加入另一个试管中,用蒸馏水溶解,摇匀。
4. 酸碱中和反应:分别取少量的碳酸钠溶液和碳酸氢钠溶液,用滴管滴入硝酸银溶液中,观察是否生成白色沉淀。
5. 酸碱中和反应:分别取少量的碳酸钠溶液和碳酸氢钠溶液,分别加入两个试管中,分别加入酸试剂(盐酸溶液),观察是否发生变化。
教学重点:1. 学生对碳酸钠和碳酸氢钠的基本性质及化学反应的理解和掌握。
2. 学生对实验仪器和试剂的正确使用和处理能力。
教学方法:1. 示范实验法:教师先进行实验演示,然后学生进行实验操作。
2. 互动讨论法:教师引导学生观察实验现象、探究实验结果,并进行讨论。
评估方式:1. 实验报告:学生根据实验内容和实验结果,撰写实验报告。
2. 课堂讨论:教师和学生共同讨论实验中遇到的问题和现象,进行分析和解释。
拓展练习:1. 尝试使用其他试剂进行酸碱中和反应,观察结果。
2. 制定一份安全实验操作规范,要求清晰明确。
教学延伸:1. 可与其他相关实验内容进行结合,拓展学生的实验能力。
2. 可开展小组合作实验,培养学生的团队合作能力。



