FE第八章 干燥
- 格式:ppt
- 大小:4.16 MB
- 文档页数:77

第八章--金属和金属材料(人教版)课题1---金属材料题号解析1 密度小,具有抗腐蚀性。
2 铁:可用于做菜刀、镰刀、锤子等;利用了硬度大的性质。
铜:可用于制电线、火锅等;利用了其导电性好,导热性好,熔点高的性质。
金:可用于制作项链、戒指等饰品;利用了其具有较好的金属光泽的性质。
点拨:物质的性质决定物质的用途。
3需要有光泽好,抗腐蚀,硬度大的性质。
提示:合金的强度和硬度一般比组成它们的纯金属更高,抗腐蚀性能等也更好。
4 (1)外科手术刀:不锈钢,因为其抗腐蚀性好。
(2)防盗门:锰钢,硬度大。
(3)门锁:黄铜,因为强度高,可塑性好、易加工、耐腐蚀。
(4)自行车支架:锰钢,因为其韧性好,硬度大。
5该金属可能的用途有:制作机器零件、火箭、飞机、轮船、电线、电榄、化工和通讯设备等。
6 解:1 000 kg铁红中铁的质量=1 000 kg××100%=1 000 kgX xl00%=700 kg答:1 000 kg铁红中最多含铁的质量为700 kg。
点拨:利用化学式中某元素的质量分数来求物质中某元素的质量。
课题2---金属的化学性质题号解析1 常温下铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,因此铝具有良好的抗腐蚀性能。
如果刷洗铝制品时,用钢刷、沙等来摩擦,就会破坏铝制品表面的致密氧化膜,使铝被腐蚀的速度加快。
2 配制波尔多液的硫酸铜溶于水可制成硫酸铜溶液,铁与硫酸铜在溶液中反应,使铁制品被腐蚀,硫酸铜变质发生反应的化学方程式为Fe+CuS04=FeS04+Cu,所以不能用铁制容器配制波尔多液,也不能在配制时用铁棒搅拌。
3 ①C+O2CO2。
(化合反应)或C+2CuO2Cu+CO2 (置换反应)②CO2+C2CO (化合反应) ③3Fe+2O2Fe3O4 (化合反应)④Fe3O4+4CO3Fe+4CO2⑤Fe+H2SO4=FeSO4+H2↑(置换反应)或Fe+CuSO4=FeSO4+Cu(置换反应)⑥Fe+2HCl=FeCl2+H2↑(置换反应)Fe+CuCl2=FeCl2+Cu(置换反应)点拨:本题主要熟练掌握有关化学方程式的书写,并会判断反应类型。

第八章化学与可持续发展第一节自然资源的利用与开发一、金属矿物的开发利用1、金属元素在自然界中存在的形态(1)极少数的不活泼金属(金、铂等)以游离态的形式存在。
(2)绝大多数金属元素以化合物的形式存在于自然界。
(3)在地壳中,含量最高的金属元素是铝,其次是铁。
2、金属冶炼原理与实质(1)原理:金属从化合物中还原出来。
(2)实质:化合物中金属得到电子被还原生成金属单质。
3、金属冶炼方法(1)加热分解法:①制Hg :2HgO=====△2Hg +O 2↑。
②制Ag :2Ag 2O=====△4Ag +O 2↑。
(2)电解法:①制Mg :MgCl 2(熔融)=====电解Mg +Cl 2↑。
②制Al :2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
③制Na :2NaCl(熔融)=====电解2Na +Cl 2↑。
(3)热还原法:①常用还原剂有焦炭、一氧化碳、氢气、铝等。
②高炉炼铁:CO 还原Fe 2O 3的化学方程式为3CO +Fe 2O 3=====高温2Fe +3CO 2。
③铝热反应:Al 还原Fe 2O 3的化学方程式为2Al +Fe 2O 3=====高温2Fe +Al 2O 3。
4、合理开发和利用金属资源的主要途径(1)提高金属矿物的利用率;(2)开发环保高效的金属冶炼方法;(3)防止金属的腐蚀;(4)加强废旧金属的回收和再利用;(5)使用其他材料代替金属材料。
二、海水资源的开发利用1、海水水资源的利用(1)海水水资源利用,主要包括海水淡化和直接利用海水进行循环冷却等。
(2)海水淡化:通过从海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较成熟,但成本较高。
2、海水的化学资源利用(1)海水中的化学元素:海水中含量最多的为O、H两种元素,还有Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素。

1.干燥:是利用热量使湿物料中水分等湿分被汽化去除,从而获得固体产品的操作。
2.去湿的方法——机械去湿法 化学去湿法 热能去湿法 ▲3.含水量(1)湿基含水量.(w ).(无量纲)——) m — 湿物料的质量,kg ;m w — 湿物料中所含水的质量,kg ;m s — 湿物料中所含有绝对干燥物料的质量,kgw 是习惯上常用的表示组分含量的方法,如未加说明,物料含水量即指湿基含水量。
(2)干基含水量.(x ).(无量纲)——两种含水量的换算关系▲4.水分活度.(a w ) — 一般把湿物料表面附近的水蒸汽压p 与同温度下纯水的饱和蒸汽压p 0之比作为湿物料水分活度a w 的定义: a w 的大小与食品中的含水量、所含各种溶质的类型和浓度以及食品的结构和物理特性都有关系。
▲5.吸湿和解湿(1)当a w >Φ 时 [Φ的定义式Φ=p v /p s ] p >p v 即湿物料表面附近水蒸汽压p 大于是空气中的水蒸气分压p v ,水分将从物料向湿空气中传递,这种过程称为物料的解湿。
解湿使物料含水量x 不断减少,这即是干燥过程。
(2)当a w <Φ时, p <p v ,水分将不断从湿空气向物料传递,这种过程称为物料的吸湿。
吸湿使物料含水量x 不断增加。
(3)当a w =Φ时,p=p v ,物料既不解湿,也不吸湿,两者相对于湿空气讲,此时物料的含水量x 称为平衡含水量x e 。
▲6.物料中水分的分类(1)按物料与水分的结合方式分类—化学结合水 物理化学结合水 机械结合水 (2)按水分去除的难易程度分类—结合水分 非结合水分 (3)按水分能否用于干燥的方法除去分类自由水分—物料中的水分能被干燥除去的部分。
平衡水分—平衡水分代表物料在一定空气状态下的干燥的极限。
7.湿空气热力学湿空气通常指干空气和水蒸气的混合物。
(1)湿密度:湿空气中所含水蒸气的质量m V 与湿空气体积V 之比,称为其湿密度ρV ▲(2)v p s 之比,称为湿空气的相对湿度φ: 对绝对干燥的空气,相对湿度φ=0; 对饱和空气,相对湿度φ=1。

序号1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36题干干燥硫化氢气体中的水分可以用浓硫酸。
利用浓H2SO4吸收物料中的湿份是干燥。
物料的平衡水分随其本身温度升高的变化趋势为增大。
T于不饱和空气,其干球温度>湿球温度>露点温度总是成立的;当空气温度为t、湿度为H时,干燥产品含水量为零是干燥的极限。
( )当湿空气的湿度H一定时,干球温度t愈低则相对湿度φ值愈低,因此吸水能力愈大。
对于一定的干球温度的空气,当其相对湿度愈低时,则其湿球温度愈低.沸腾床干燥器中的适宜气速应大于带出速度,小于临界速度。
干燥操作的目的是将物料中的含水量降至规定的指标以上。
干燥过程既是传热过程又是传质过程。
干燥介质干燥物料后离开干燥器其湿含量增加,温度也上升。
干燥进行的必要条件是物料表面的水气(或其他蒸气)的压强必须大于干燥介质中水气(或其他蒸气)恒速干燥阶段,湿物料表面的湿度也维持不变。
恒速干燥阶段,所除去的水分为结合水分。
空气的干、湿球温度及露点温度在任何情况下都应该是不相等的。
空气干燥器包括空气预热器和干燥器两大部分。
临界点是恒速干燥和降速干燥的分界点,其含水量X c越大越好。
临界水分是在一定空气状态下,湿物料可能达到的最大干燥限度。
喷雾干燥塔干燥得不到粒状产品。
热能去湿方法即固体的干燥操作。
任何湿物料只要与一定温度的空气相接触都能被干燥为绝干物料。
若相对湿度为零,说明空气中水汽含量为零。
湿空气的干球温度和湿球温度一般相等。
湿空气的湿度是衡量其干燥能力大小的指标值。
湿空气进入干燥器前预热,可降低其相对湿度。
湿空气温度一定时,相对湿度越低,湿球温度也越低。
湿球温度计是用来测定空气的一种温度计所谓露点,是指将不饱和空气等湿度冷却至饱和状态时的温度。
( )同一物料,如恒速阶段的干燥速率加快,则该物料的临界含水量将增大。

1、详解版第八章--金属和金属材料(人教版)课题1---金属材料题号1 密度小,具有抗腐蚀性。
2 铁:可用于做菜刀、镰刀、锤子等;利用了硬度大的性质。
铜:可用于制电线、火锅等;利用了其导电性好,导热性好,熔点高的性质。
金:可用于制作项链、戒指等饰品;利用了其具有较好的金属光泽的性质。
点拨:物质的性质决定物质的用途。
3 需要有光泽好,抗腐蚀,硬度大的性质。
提示:合金的强度和硬度一般比组成它们的纯金属更高,抗腐蚀性能等也更好。
4 (1)外科手术刀:不锈钢,因为其抗腐蚀性好。
(2)防盗门:锰钢,硬度大。
(3)门锁:黄铜,因为强度高,可塑性好、易加工、耐腐蚀。
(4)自行车支架:锰钢,因为其韧性好,硬度大。
5 该金属可能的用途有:制作机器零件、火箭、飞机、轮船、电线、电榄、化工和通讯设备等。
6 解:1 000 kg铁红中铁的质量=1 000 kg××100%=1 000 kgXxl00%=700 kg答:1 000 kg铁红中最多含铁的质量为700 kg。
点拨:利用化学式中某元素的质量分数来求物质中某元素的质量。
2CO C+2CuO2Cu+CO+C2CO2Fe+4CO3Fe+4CO22Mg+O22MgO 22CuO (课题3---金属资源的利用和保护题号解析1 (2)(3)点拨:铁生锈的条件是与氧气和水接触,这与环境因素有关。
2 (1)沙漠地区气候干燥.雨少。
(2)用干布擦自行车上的雨水是防止铁在潮湿的空气中生锈,用干布擦掉水分保护自行车的干燥。
擦干后用带油的布擦,就在自行车表面形成一层保护膜,水分不易侵入,可以防止铁生锈。
如果直接用带油的布擦,不仅不易擦干,而且还容易将水分盖在油层下面,使铁生锈。
3 ZnCO3ZnO+CO2↑ZnO+C2Zn+CO2↑2Cu2O+C4Cu+CO2↑点拨:书写化学方程式要注明反应条件,并且要配平化学方程式。
4解:设该厂理论上可日产含铁98%的生铁的质量为x。



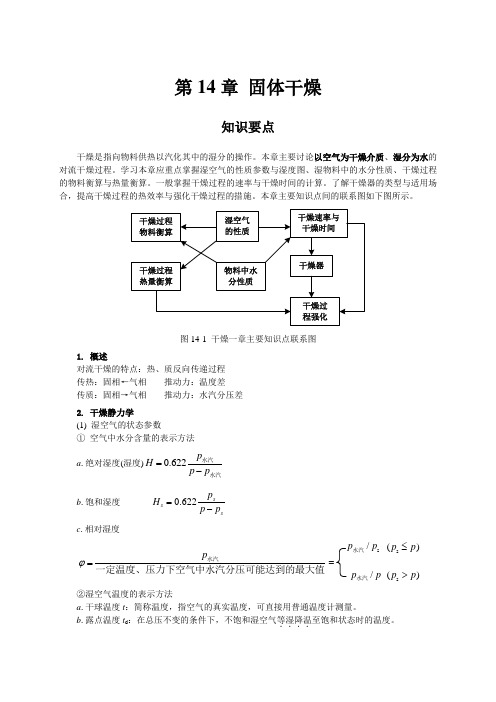
第14章 固体干燥知识要点干燥是指向物料供热以汽化其中的湿分的操作。
本章主要讨论以空气为干燥介质、湿分为水的对流干燥过程。
学习本章应重点掌握湿空气的性质参数与湿度图、湿物料中的水分性质、干燥过程的物料衡算与热量衡算。
一般掌握干燥过程的速率与干燥时间的计算。
了解干燥器的类型与适用场合,提高干燥过程的热效率与强化干燥过程的措施。
本章主要知识点间的联系图如下图所示。
图14-1 干燥一章主要知识点联系图1. 概述对流干燥的特点:热、质反向传递过程 传热:固相←气相 推动力:温度差 传质:固相→气相 推动力:水汽分压差 2. 干燥静力学(1) 湿空气的状态参数① 空气中水分含量的表示方法 a .绝对湿度(湿度)0.622p H p p =-水汽水汽b .饱和湿度 0.622ss sp Hp p =- c .相对湿度p ϕ=水汽一定温度、压力下空气中水汽分压可能达到的最大值s ()p p ≤s /p p 水汽s ()p p >/p p 水汽=②湿空气温度的表示方法a .干球温度t :简称温度,指空气的真实温度,可直接用普通温度计测量。
b .露点温度t d :在总压不变的条件下,不饱和湿空气等湿降温....至饱和状态时的温度。
c .绝热饱和温度t as : 指少量空气与大量水经长时间绝热接触后达到的稳定温度。
d .湿球温度t w :指大量空气与少量水经长时间绝热接触后达到的稳定温度。
e . 湿空气的四种温度间的关系不饱和湿空气:()d W as t t t t >>饱和湿空气:()d W as t t t t ==③湿空气的比热容(湿比热容)c pH :将1kg 干空气和其所带的H kg 水汽的温度升高1℃所需的热量,单位 kJ/(kg ∙℃)。
pH 1.01 1.88c H =+④湿空气的焓I :指1kg 干气及所带的H kg 水汽所占的总体积,单位m 3/kg 干气。
(1.01 1.88) 2 500I H t H =++⑤ 湿空气的比体积:指1kg 干气及所带的H kg 水汽所占的总体积,单位m 3/kg 干气。








《第八章 固体干燥》习题解答1) 已知空气的干燥温度为60℃,湿球温度为30℃,试计算空气的湿含量H ,相对湿度,焓I 和露点温度。
Ct Ct kPa p kg kJ I p p kPa p H kPap Ct H K r C K r t t H H p p P H kPap C t d s s s H tw Hh tw w t s s s t s t s w w w w 000000,,,04.184.18,18.2/44.960158.0249060)0158.088.101.1(11/18.20137.0923.19600137.009.1/242730)/](/)[(0272.0)/(622.0247.430=∴===⨯+⨯⨯+=∴==Φ∴=====∴==--==-===查表得由干空气求得此时由时时解:查表得αα2) 利用湿空气的I —H 图完成本题附表空格项的数值,湿空气的总压。
序 号干球温度 0C湿球温度 0C湿 度kg 水/kg 绝干空气 相对湿度 0/0 焓 kJ/kg 绝干气 露 点 0C 水气分压 kPa 1 60 30 0.015 13.398 21 2.5 2 40 27 0.016 33 79 20 2.4 3 20 17 0.012 80 50 16 2 4 30 290.02695982843) 湿空气( =20℃, )经预热后送入常压干燥器。
试求:①将空气预热到100℃所需热量:②将该空气预热到120℃时相应的相对湿度值。
000012.3)/(662.0/02.0,3.10164.1981202/(8.8380/22.088.101.188.101.1.1=ΦΦ-Φ===⋅⋅==∆=⋅⨯+=+=解得干气水时))绝干气)绝干气(比热)解:s s s H H H p p p H kg kg H kPa kPa p C C kg kJ C t C Q C KG kJ H H C4)湿度为的湿空气在预热器中加热到128℃后进入常压等焓干燥器中,离开干燥器时空气的温度为49℃,求离开干燥器时露点温度。