41原电池和电极电势
- 格式:ppt
- 大小:378.50 KB
- 文档页数:36










实验九 原电池电动势和电极电势的测定1 目的要求(1) 测定Cu-Zn 原电池的电动势及Cu 、Zn 电极的电极电势。
(2) 学会几种电极和盐桥的制备方法。
(3) 掌握可逆电池电动势的测量原理和EM-3C 型数字式电位差计的操作技术。
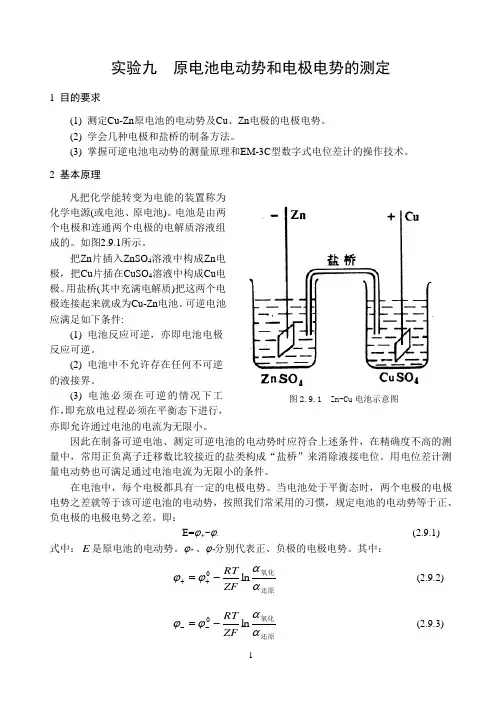
2 基本原理凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
电池是由两个电极和连通两个电极的电解质溶液组成的。
如图2.9.1所示。
把Zn 片插入ZnSO 4溶液中构成Zn 电极,把Cu 片插在CuSO 4溶液中构成Cu 电极。
用盐桥(其中充满电解质)把这两个电极连接起来就成为Cu-Zn 电池。
可逆电池应满足如下条件:(1) 电池反应可逆,亦即电池电极反应可逆。
(2) 电池中不允许存在任何不可逆的液接界。
(3) 电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
用电位差计测量电动势也可满足通过电池电流为无限小的条件。
在电池中,每个电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电池的电动势,按照我们常采用的习惯,规定电池的电动势等于正、负电极的电极电势之差。
即:E=ϕ+-ϕ- (2.9.1) 式中:E 是原电池的电动势。
ϕ+ 、ϕ-分别代表正、负极的电极电势。
其中:还原氧化ααϕϕln0ZF RT -=++ (2.9.2) 还原氧化ααϕϕlnZF RT -=--(2.9.3)在式(2.9.2)、(2.9.3)中:ϕ+、ϕ-分别代表正、负电极的标准电极电势。
R=8.134J.mol -1.K -1。
T 是绝对温度。
Z 是反应中得失电子的数量。
F=96500C ,称法拉第常数。
α氧化为参与电极反应的物质的还原态的活度。
对于Cu-Zn 电池,其电池表示式为:Zn|ZnSO 4(m 1)||CnSO 4(m 2)|Cu其电极反应为:⎩⎨⎧+→→+++++e Zn Zn Cu e Zn Cu 2)(2)(Cu 2222αα负极反应:正极反应:其电池反应为:)()(2222+++++→+Zn Cu Zn Cu Cu Zn αα其电动势为: Zn Zn Cu Cu E ,,22++-=ϕϕ (2.9.4)+++-=2221ln20,,Cu CuCu CuCu F RT αϕϕ (2.9.5) +++-=2221ln20,,Zn ZnZn ZnZnF RT αϕϕ (2.9.6) 在式2.9.5和2.9.6中,Cu 2+, Zn 2+的活度可由其浓度m i 和相应电解质溶液的平均活度系数γ±计算出来。
原电池电极电势计算公式
在化学反应中,电极电势可以通过以下公式来计算:
E = E° (RT/nF)lnQ.
其中,E 是电极电势,E° 是标准电极电势,R 是气体常数,T 是温度,n 是电子转移数,F 是法拉第常数,Q 是反应物的活度积。
这个公式的核心是涉及到了热力学和电化学的概念。
标准电极
电势是指在标准状态下,电极与溶液中的阳离子之间的电势差。
而
活度积则是反应物在溶液中的浓度乘积,它反映了反应物参与反应
的程度。
这个公式的应用范围非常广泛,它不仅可以用于预测电池的性能,还可以用于研究电化学反应的动力学过程。
通过对原电池电极
电势计算公式的研究和应用,科学家们可以更好地理解电化学反应
的基本原理,从而推动电池技术的发展和应用。