原电池的电动势与电极电位(势)
- 格式:ppt
- 大小:1.46 MB
- 文档页数:31

原电池电动势的测定一、 实验目的1、测定Cu —Zn 电池的电动势和Cu 、Zn 电极的电极电位。
2、了解可逆电池,可逆电极,盐桥等概念。
3、学会一些电极的制备和处理方法。
二、 实验原理电池由正、负两极组成。
电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。
电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。
从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系:G nFE ∆=- (1)式中G ∆是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -⋅);E 为电池的电动势。
所以测出该电池的电动势E 后,进而又可求出其它热力学函数。
但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件:(1)电池反应可逆,亦即电池电极反应可逆;(2)电池中不允许存在任何不可逆的液接界;(3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。
原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就可计算得到由它们组成的电池的电动势。
由(1)式可推导出电池的电动势以及电极电势的表达式。
下面以铜-锌电池为例进行分析。
电池表示式为:4142()()()()Zn s ZnSO m CuSO m Cu s ||||符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。
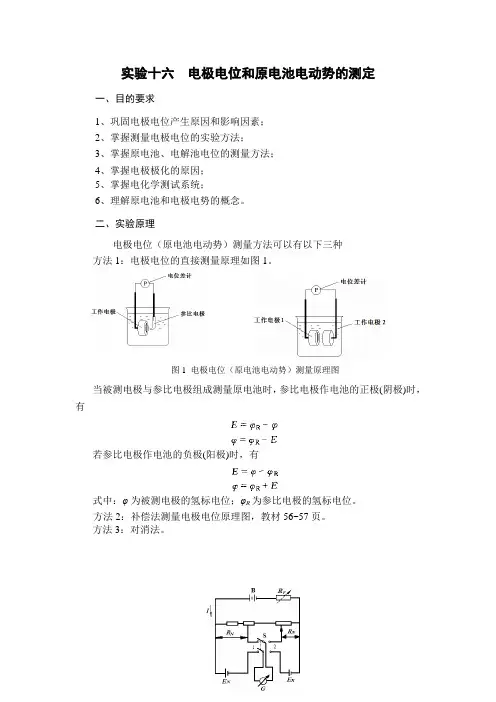
图1 电极电位(原电池电动势)测量原理图实验十六 电极电位和原电池电动势的测定一、目的要求1、巩固电极电位产生原因和影响因素;2、掌握测量电极电位的实验方法;3、掌握原电池、电解池电位的测量方法;4、掌握电极极化的原因;5、掌握电化学测试系统;6、理解原电池和电极电势的概念。
二、实验原理电极电位(原电池电动势)测量方法可以有以下三种方法1:电极电位的直接测量原理如图1。
当被测电极与参比电极组成测量原电池时,参比电极作电池的正极(阴极)时,有若参比电极作电池的负极(阳极)时,有式中:φ为被测电极的氢标电位;φR 为参比电极的氢标电位。
方法2:补偿法测量电极电位原理图,教材56~57页。
方法3:对消法。
图2 补偿法测量电极电位测量原理图对消法测定电动势就是在所研究的电极(电池)的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零(通过检流计指示)。
此时,所研究的电池的电动势就可以从外电路的电压数值读出。
原电池是由两个“半电池”组成,每个半电池中有一个电极和相应的溶液。
由不同的半电池可以组成各式各样的原电池,电池中的正极起还原作用,负极起氧化作用,电池的电动势等于两个电极电位的差值:左右ϕϕϕϕ-=-=-+E++++=a nF RT ln 0ϕϕ ---+=a nFRT ln 0ϕϕ 例如Cu-Zn 电池 Zn|ZnSO 4(a 1)||CuSO 4(a 2)|CuZn 的电极电位22201ln 2Zn Zn Zn Zn Zn RT F a ϕϕ+++=- Cu 的电极电位22201ln 2Cu Cu Cu Cu Cu RT F a ϕϕ+++=- Cu-Zn 电池的电动势为: ++++--=2222Cu n /Zn Zn 0Cu 0ln 2)(ααϕϕZ Cu /F RT E 三、仪器与药品 电化学测试系统 1套 饱和甘汞电极 1只盐桥 1个 电解池 1套Cu 电极片 1个 Fe 电极片 1个容量瓶 1个 量筒 1个广口瓶 3个 饱和KCl 溶液CuSO4(0.1mol.L-1)溶液 CuSO4(0.01mol.L-1)溶液NaCl (0.1mol.L-1)溶液四、实验步骤图4 工作电极的结构示意图 1、电极制备工作电极表面要平整,不能出现尖角或台阶,这些结构将会影响电极电位的分布。


化学反应中的电极电势与电池电动势化学反应是一种涉及原子和分子之间重组的过程,而电池则是利用化学反应产生电能的装置。
电极电势和电池电动势是描述电化学反应中电子转移能力的重要参数。
本文将介绍电极电势和电池电动势的概念、影响因素以及它们之间的关系。
一、电极电势的概念与测量电极电势是指电极与溶液或气体之间的电势差。
在电化学反应中,电极上电子的转移产生电势差,进而影响反应的进行。
电极电势能够反映电子在电极上的活动程度,是判断电极是氧化还是还原的参数。
电极电势通常用标准电极电势(E°)来表示,单位为伏特(V)。
测量电极电势的方法有很多种,其中最常用的方法是通过比较电池。
比较电池由两个半电池组成,可以产生一个已知电势差的电池。
通过将待测电极与比较电池相连,测量它们之间的电势差,从而确定待测电极的电势差。
二、电极电势的影响因素1. 温度:电极电势随温度的变化而变化。
温度升高会导致电极电势升高或降低,具体取决于反应的热力学性质。
2. 浓度:电极电势与参与反应的物质浓度有关。
当参与反应的物质浓度发生改变时,电极电势也会发生变化。
3. 压力:对于气体电极,电极电势随气体的分压变化而变化。
增大气体分压会导致电极电势升高。
4. pH 值:对于溶液电极,电极电势会受到 pH 值的影响。
改变溶液pH 值能够改变电极电势。
三、电池电动势的概念与计算电池电动势是指电池两个电极之间的电势差,表征了电化学反应产生的电能。
电池电动势通常用电池电动势(Ecell)来表示,单位为伏特(V)。
计算电池电动势的方法是通过测量两个电极的电极电势,并利用Nernst 方程进行计算。
Nernst 方程是描述电极电势与反应物浓度之间关系的数学方程。
Ecell = E°cell - (RT/nF)ln(Q)其中,E°cell 是标准电动势,R 是气体常数,T 是温度,n 是电子转移的摩尔数,F 是法拉第常数,Q 是反应物的活度积。


电解池原电池电动势电势计算电解池是一种将化学能转化为电能的装置。
在电解池中,通过电解反应使电流产生,从而把化学能转化为电能,是化学电池中最常用的一种。
电解池的原电池电动势就是在标准状态下,由电解反应引起的电动势,是电解池中化学能转变为电能的能力。
下面是电解池原电池电动势的电势计算方法。
一. 原电池电动势的定义原电池电动势E0是指在标准活化状态下,以纯物质作氧化剂和还原剂,产生1mol电子时,电池中的电势差。
二. 标准电极电势的测定标准电极电势是指在标准条件下,电化学电池中氧化反应和还原反应中电子的转移系数都是1时所测定的电极电势,它是用标准电极强度计测定的。
三. 标准电动势计算公式标准电池电动势的计算公式是:E0cell = E0cathode - E0anode其中,E0cell是标准电池电动势,E0cathode是还原电极的标准电极电势,E0anode是氧化电极的标准电极电势。
对于化学方程式2H+ + 2e− → H2,它的标准电极电势为0V。
对于化学方程式Cu2+ + 2e− → Cu,它的标准电极电势为+0.34V。
因此,铜/铜离子电池的标准电池电动势为:E0cell = E0cathode - E0anode = 0V - (+0.34V) = -0.34V四. 温度影响对于每个化学电池来说,它的电动势都会随着温度的变化而变化。
五. 氧化还原电位氧化还原电位是一种描述氧化还原反应趋势的物理量。
在实际应用中,氧化还原电位的计算、测定与预测是很关键的。
六. 应用范围电解池原电池电动势的电势计算是电化学基础知识之一,它在工业、生物、医学、环保等领域都有着广泛的应用。
对于电解池中的原电池电动势,它的电势计算是非常重要的,只有通过电势计算才能确定电池的电势差,从而实现化学能和电能之间的转化。

原电池电动势的测定实验报告原电池电动势的测定实验报告1实验目的1.掌握可逆电池电动势的测量原理和电位差计的操作技术2.学会几种电极和盐桥的制备方法3.学会测定原电池电动势并计算相关的电极电势实验原理凡是能使化学能转变为电能的装置都称之为电池(或原电池)。
可逆电池应满足如下条件:(1)电池反应可逆,亦即电池电极反应可逆;(2)电池中不允许存在任何不可逆的液接界;(3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,即测量时通过电池的电流应为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位;用电位差计测量电动势可满足通过电池电流为无限小的条件。
电位差计测定电动势的原理称为对消法,可使测定时流过电池的电流接近无限小,从而可以准确地测定电池的电动势。
可逆电池的电动势可看作正、负两个电极的电势之差。
设正极电势为φ+,负极电势为φ-,则电池电动势E = φ+ - φ- 。
电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极作为标准,规定其电极电势为零。
将标准氢电极与待测电极组成电池,所测电池电动势就是待测电极的电极电势。
由于氢电极使用不便,常用另外一些易制备、电极电势稳定的电极作为参比电极。
常用的参比电极有甘汞电极、银-氯化银电极等。
这些电极与标准氢电极比较而得的电势已精确测出,具体的电极电位可参考相关文献资料。
以饱和甘汞电极与铜/硫酸铜电极或锌/硫酸锌电极组成电池,测定电池的电动势,根据甘汞电极的电极电势,可推得这两个电极的电极电势。
仪器和试剂SDC-II型数字式电子电位差计,铜电极,锌电极,饱和甘汞电极,0.1 mol?L-1 CuSO4 溶液,0.1 mol?L-1 ZnSO4 溶液,饱和 KCl 溶液。
实验步骤1. 记录室温,打开SDC-II型数字式电子电位差计预热 5 分钟。

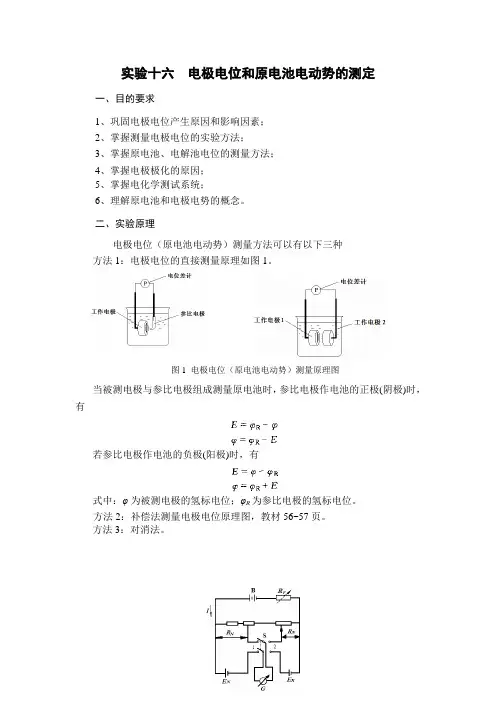
图1 电极电位(原电池电动势)测量原理图实验十六 电极电位和原电池电动势的测定一、目的要求1、巩固电极电位产生原因和影响因素;2、掌握测量电极电位的实验方法;3、掌握原电池、电解池电位的测量方法;4、掌握电极极化的原因;5、掌握电化学测试系统;6、理解原电池和电极电势的概念。
二、实验原理电极电位(原电池电动势)测量方法可以有以下三种 方法1:电极电位的直接测量原理如图1。
当被测电极与参比电极组成测量原电池时,参比电极作电池的正极(阴极)时,有若参比电极作电池的负极(阳极)时,有式中:φ为被测电极的氢标电位;φR 为参比电极的氢标电位。
方法2:补偿法测量电极电位原理图,教材56~57页。
方法3:对消法。
图2 补偿法测量电极电位测量原理图对消法测定电动势就是在所研究的电极(电池)的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零(通过检流计指示)。
此时,所研究的电池的电动势就可以从外电路的电压数值读出。
原电池是由两个“半电池”组成,每个半电池中有一个电极和相应的溶液。
由不同的半电池可以组成各式各样的原电池,电池中的正极起还原作用,负极起氧化作用,电池的电动势等于两个电极电位的差值:左右ϕϕϕϕ-=-=-+E++++=a nFRT ln 0ϕϕ---+=a nFRT ln 0ϕϕ例如Cu-Zn 电池 Zn|ZnSO 4(a 1)||CuSO 4(a 2)|Cu Zn 的电极电位22201ln2Zn Zn ZnZnZn RT Fa ϕϕ+++=-Cu 的电极电位22201ln2C u C u C uC uC u R T Fa ϕϕ+++=-Cu-Zn 电池的电动势为:++++--=2222Cun /ZnZnCu0ln2)(ααϕϕZ Cu/FRT E三、仪器与药品电化学测试系统 1套 饱和甘汞电极 1只 盐桥 1个 电解池 1套 Cu 电极片 1个 Fe 电极片 1个容量瓶 1个 量筒 1个 广口瓶 3个 饱和KCl 溶液CuSO4(0.1mol.L-1)溶液 CuSO4(0.01mol.L-1)溶液 NaCl (0.1mol.L-1)溶液 四、实验步骤图4 工作电极的结构示意图1、电极制备工作电极表面要平整,不能出现尖角或台阶,这些结构将会影响电极电位的分布。

实验九 原电池电动势和电极电势的测定1 目的要求(1) 测定Cu-Zn 原电池的电动势及Cu 、Zn 电极的电极电势。
(2) 学会几种电极和盐桥的制备方法。
(3) 掌握可逆电池电动势的测量原理和EM-3C 型数字式电位差计的操作技术。
2 基本原理凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
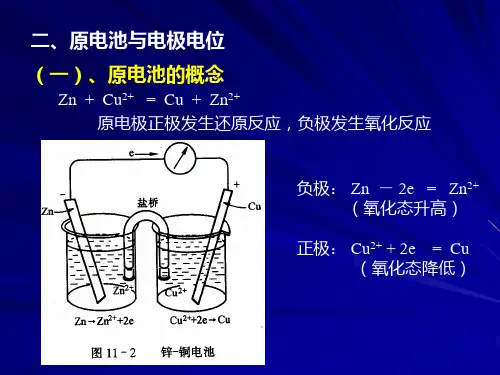
电池是由两个电极和连通两个电极的电解质溶液组成的。
如图2.9.1所示。
把Zn 片插入ZnSO 4溶液中构成Zn 电极,把Cu 片插在CuSO 4溶液中构成Cu 电极。
用盐桥(其中充满电解质)把这两个电极连接起来就成为Cu-Zn 电池。
可逆电池应满足如下条件:(1) 电池反应可逆,亦即电池电极反应可逆。
(2) 电池中不允许存在任何不可逆的液接界。
(3) 电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
用电位差计测量电动势也可满足通过电池电流为无限小的条件。
在电池中,每个电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电池的电动势,按照我们常采用的习惯,规定电池的电动势等于正、负电极的电极电势之差。
即:E=ϕ+-ϕ- (2.9.1) 式中:E 是原电池的电动势。
ϕ+ 、ϕ-分别代表正、负极的电极电势。
其中:还原氧化ααϕϕln0ZF RT -=++ (2.9.2) 还原氧化ααϕϕlnZF RT -=--(2.9.3)在式(2.9.2)、(2.9.3)中:ϕ+、ϕ-分别代表正、负电极的标准电极电势。
R=8.134J.mol -1.K -1。
T 是绝对温度。
Z 是反应中得失电子的数量。
F=96500C ,称法拉第常数。
α氧化为参与电极反应的物质的还原态的活度。
对于Cu-Zn 电池,其电池表示式为:Zn|ZnSO 4(m 1)||CnSO 4(m 2)|Cu其电极反应为:⎩⎨⎧+→→+++++e Zn Zn Cu e Zn Cu 2)(2)(Cu 2222αα负极反应:正极反应:其电池反应为:)()(2222+++++→+Zn Cu Zn Cu Cu Zn αα其电动势为: Zn Zn Cu Cu E ,,22++-=ϕϕ (2.9.4)+++-=2221ln20,,Cu CuCu CuCu F RT αϕϕ (2.9.5) +++-=2221ln20,,Zn ZnZn ZnZnF RT αϕϕ (2.9.6) 在式2.9.5和2.9.6中,Cu 2+, Zn 2+的活度可由其浓度m i 和相应电解质溶液的平均活度系数γ±计算出来。
实验十原电池电动势的测定参阅复旦大学等编庄继华等修订《物理化学实验》第三版P68Ⅰ、目的要求1、测定Cu—Zn电池的电动势和Cu、Zn电极的电极电位。
2、了解可逆电池,可逆电极,盐桥等概念。
3、学会一些电极的制备和处理方法。
Ⅱ、仪器与试剂NDM-1 精密数字直流电压测定仪标准电池(惠斯登电池)铜棒电极,锌棒电极玻璃电极管2个,饱和甘汞电极(SCE)洗耳球,小烧杯,细砂纸ZnSO4(0.100moldm-3),CuSO4(0.100 moldm-3) ,KCl(0.100 moldm-3),饱和KCl溶液,稀硫酸、稀硝酸。
Ⅲ、实验原理电池由正 ,负两极组成,电池放电过程中,正极起还原反应,负极起氧化反应,电池内部可以发生其他反应 (如发生离子迁移),电池反应是电池所有反应的总和.电池除了可以用来作为电源外 , 还可以用它来研究构成此电池的化学反应的热力学性质 . 从化学热力学知道 , 在恒温 , 恒压 , 可逆条件下,电池反应有如下关系 :(1)式中 : 是电池反应的自由能量 ,F 是法拉第常数 ( 等于 96500 库仑 ).n 是参与反应的克当量数 ,E 是电池的电动势 . 所以测定出该电池的电动势 E 后 , 便可求出, 通过又可求出其他热力学函数 . 但必须注意 ,只有在恒温,恒压可逆条件下 ,(1) 式才能成立 . 这就要求电池反映本身是可逆的 , 即要求电池电极也是可逆的,并且不存在任何不可逆的液接界 . 另外 , 电池还必须在可逆情况下工作,即放电和充电过程都必须在准平衡状态下进行 , 此时只有无限小的电流通过电池 .因此在用电化学方法研究化学反应的热力学性质时所设计的电池应尽量避免出现液接界 . 在精度要求不高的测量中 , 出现也接界电位时 , 常用“盐桥”来减小。
所谓“盐桥”,是指一种正负离子迁移数比较接近的盐类溶液所构成的桥,由来连接原来产生显著接界电位的两个液体,从而使其彼此不直接接界。
化学原电池和电解池知识点
1.化学原电池的构成:化学原电池由两个电极(即阳极和阴极)以及
一个电解质溶液组成。
2.化学原电池的原理:化学原电池的工作原理基于氧化还原反应。
在
阳极处,氧化反应发生,导致电子从金属离子中脱离,形成电子流向阴极。
而在阴极处,还原反应发生,接受来自电子流的电子,并被还原物质接受。
3.化学原电池的电势差:化学原电池的电势差是反应物的化学能转化
为电能的度量。
它可以通过电动势计进行测量。
电动势是指单位正电荷在
电池终端之间移动时所产生的深度影响。
4.化学原电池的电极电势:电极电势是指测量单个电极与相同参考电
极(例如标准氢电极)之间的电势差。
它是一个反应物的电化学测量,并
用于计算整个电池的电动势。
电解池:
1.电解池的构成:电解池由两个电极(即阳极和阴极)以及一个电解
质溶液组成。
与化学原电池不同的是,电解池外加电源,以提供所需的电能。
2.电解池的原理:电流通过电解质溶液,引发氧化反应在阳极发生,
同时还原反应在阴极发生。
该过程被称为电解,其中物质被分解成更简单
的物质。
3.电解程度:电解程度是指溶液中电解质的一部分被氧化或还原的程度。
这取决于电流的强度和时间。
4.法拉第定律:法拉第定律是描述物质电解程度与通过电解质溶液的电荷数量之间的关系。
法拉第定律表明,当通过溶液的电荷数等于物质的摩尔数时,反应会停止。
原电池电动势的测定Ⅰ、目的要求1、测定Cu—Zn电池的电动势和Cu、Zn电极的电极电位。
2、了解可逆电池,可逆电极,盐桥等概念。
3、学会一些电极的制备和处理方法。
Ⅱ、仪器与试剂NDM-1 精密数字直流电压测定仪,标准电池(惠斯登电池) ,铜棒电极,锌棒电极,玻璃电极管2个,饱和甘汞电极,氯化亚汞,洗耳球,小烧杯,细砂纸ZnSO4(0.100moldm-3),CuSO4(0.100 moldm-3) ,KCl(0.100 moldm-3),饱和KCl 溶液,稀硫酸、稀硝酸。
Ⅲ、实验原理原电池由正、负两极和电解质组成。
从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系:△r G m=-nFE (11.1)从式中可知,测得电池的电动势E后,便可求得△r G m,进而又可求得其他热力学参数。
但须注意,首先要求被测电池反应本身是可逆的,即要求电池的电极反应是可逆的,并且不存在不可逆的液接界。
同时要求电池必须在可逆情况下工作,即放电和充电过程都必须在准平衡状态下进行,此时只允许有无限小的电流通过电池。
因此,在用电化学方法研究化学反应的热力学性质时,所设计的电池应尽量避免出现液接界,在精确度要求不高的测量中,常用“盐桥”来减小液接界电势。
为了使电池反应在接近热力学可逆条件下进行,一般均采用电位差计测量电池的电动势。
原电池电动势主要是两个电极的电极电势的代数和,如能分别测定出两个电极的电势,就可计算得到由它们组成的电池电动势。
由(11.1)式可推导出电池电动势以及电极电势的表达式。
下面以锌-铜电池为例进行分析。
电池表示式为: Zn∣ZnS04(m1)‖CuS04(m2)l∣Cu当电池放电时:负极起氧化反应 Zn→Zn2+(a Zn2+)+2e-正极起还原反应 Cu 2+(a Cu 2+)+2e-→Cu电池总反应为 Zn+ Cu 2+(a Cu 2+)→Zn2+(a Zn2+)+Cu电池反应的吉布斯自由能变化值为:(11.2)纯固体物质的活度等于1,则有:a(Zn)= a(Cu)=1 (11.3)在标准态时,a(Zn2+)= a(Cu2+)=1,则有:(11.4)由(11.1)至(11.4)式可解得:(11.5)对于任一电池,其电动势等于两个电极电势之差值,其计算式为:E=φ+(右,还原电势)- φ-(左,还原电势) (11.6)对锌-铜电池而言,(11.7)(11.8)式中是当a(Zn2+)= a(Cu2+)=1时,铜电极和锌电极的标准电极电势。