水溶液中离子平衡图像微专题
- 格式:ppt
- 大小:406.50 KB
- 文档页数:15


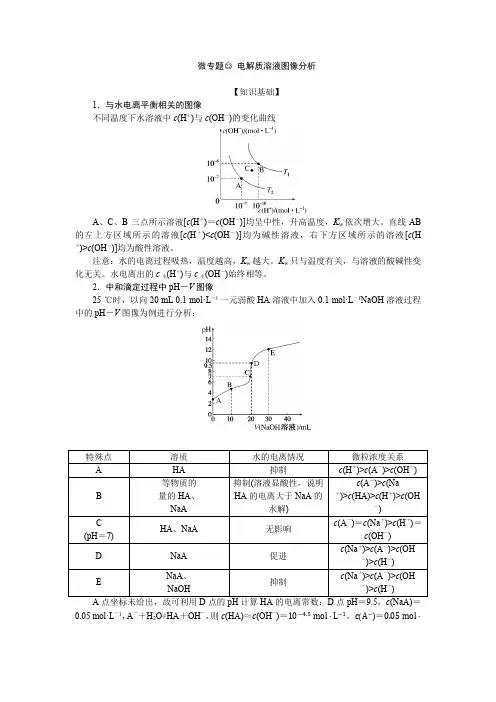
微专题○22电解质溶液图像分析【知识基础】1.与水电离平衡相关的图像不同温度下水溶液中c(H+)与c(OH-)的变化曲线A、C、B三点所示溶液[c(H+)=c(OH-)]均呈中性,升高温度,K w依次增大。
直线AB 的左上方区域所示的溶液[c(H+)<c(OH-)]均为碱性溶液,右下方区域所示的溶液[c(H +)>c(OH-)]均为酸性溶液。
注意:水的电离过程吸热,温度越高,K w越大。
K w只与温度有关,与溶液的酸碱性变化无关。
水电离出的c水(H+)与c水(OH-)始终相等。
2.中和滴定过程中pH-V图像25 ℃时,以向20 mL 0.1 mol·L-1一元弱酸HA溶液中加入0.1 mol·L-1NaOH溶液过程中的pH-V图像为例进行分析:0.05 mol·L-1,A-+H2O⇌HA+OH-,则c(HA)≈c(OH-)=10−4.5 mol·L−1,c(A−)=0.05 mol·L −1 −10−4.5mol ·L−1≈0.05 mol ·L −1,K h (A-)=c (HA )·c (OH −)c (A −)=10−4.5×10−4.50.05=2×10-8,则K a (HA)=K w K h (A −)=10−142×10−8=5×10−7。
3.分布分数图像分布分数图像一般是以pH 为横轴、分布分数(组分的平衡浓度占总浓度的分数)为纵轴的关系曲线,以草酸H 2C 2O 4为例,含碳元素的各组分分布分数(δ)与pH 的关系如图所示。
曲线含义分析:随着pH 的逐渐增大,溶质分子的浓度逐渐减小,酸式酸根离子浓度先逐渐增大后逐渐减小,酸根离子浓度逐渐增大,所以δ0表示H 2C 2O 4、δ1表示HC 2O 4−、δ2表示C 2O 42−。
特殊点的应用:对于物种分布分数图像,一般选择“交点”处不同微粒的等浓度关系,代入电离常数公式计算各级电离常数。


水溶液中的离子平衡图像分析题考试范围:xxx ;考试时间:100分钟;命题人:xxx注意事项:1 •答题前填写好自己的姓名、班级、考号等信息2 •请将答案正确填写在答题卡上第I 卷(选择题)请点击修改第I 卷的文字说明评卷人 得分.选择题(共40小题)molL 「1 CfCOONa 溶液中,所得溶液 pH 变化曲线如图所示(忽 略体积变化)。
下列说法不正确的是( )B .点②所示溶液中: c ( Na +)= c (CD +c (CH a COO 「)C .点③ 所示溶液中:c (Na +)> c (CD > c (CfcOO 「)= c (CfcOOH)D .点④ 所示溶液中:c ( Na +) +c (CfCOOH +c (H +)> molL ^11.常温下,将L 「1盐酸慢慢加入到浓度为A .点①所示溶液中由水电离产生的 c (OH ) = 10 molL 12 .常温下,100mL L的H2A溶液中滴加L NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示,F列说法正确的是( )I “A. H2A在水中的电离方程式是:H2A= H++HA「,HA「H+A2B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大C. Y点溶液中存在以下关系: c ( Na+)> c ( HA ) = c (A2)> c (OH )> c ( H+)D. X点溶液中含A元素相关离子:c (H2A) +c ( HA「)+c (A2「)= L3 •常温下将NaOH溶液添加到己二酸(H2X,为二元弱酸)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述正确的是( )A. 己二酸电离常数Ka i (H2X)约为10B. 曲线M表示pH与lg的变化关系C. 当溶液中c (X2「)= c ( HX)时,溶液为碱性D. 当混合溶液呈中性时, c (Na+)> c ( HX「)> c (X2「)> c(OH「)= c ( H+)4. 已知:pBa 2+ =- lgc ( Ba 2。
