溶液中的离子平衡图像相关问题(含答案含解析非常全)
- 格式:doc
- 大小:1.13 MB
- 文档页数:20
2019年高考化学七类选择题真题汇总:
溶液中的离子平衡图像题
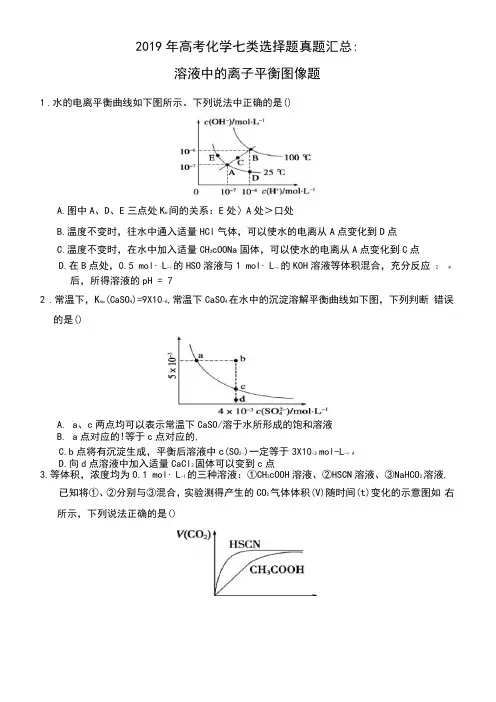
1.水的电离平衡曲线如下图所示。
下列说法中正确的是()
A.图中A、D、E三点处K w间的关系:E处〉A处>口处
B.温度不变时,往水中通入适量HCl气体,可以使水的电离从A点变化到D点
C.温度不变时,在水中加入适量CH3cOONa固体,可以使水的电离从A点变化到C点
D.在B点处,0.5 mol・L-i的HSO溶液与1 mol・L-i的KOH溶液等体积混合,充分反应 2 4
后,所得溶液的pH = 7
2.常温下,K sp(CaSO4)=9X10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误
的是()
A.a、c两点均可以表示常温下CaSO/溶于水所形成的饱和溶液
B.a点对应的!等于c点对应的,
C.b点将有沉淀生成,平衡后溶液中c(SO2-)一定等于3X10-3 mol-L-1 4
D.向d点溶液中加入适量CaCl2固体可以变到c点
3.等体积,浓度均为0.1 mol・L-1的三种溶液:①CH3cOOH溶液、②HSCN溶液、③NaHCO3溶液,
已知将①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)变化的示意图如右所示,下列说法正确的是()。

水溶液中的离子平衡图像1.(广东省深圳市2020年普通高中高三年级线上统一测试)常温下,用0.1 mol ·L -1KOH 溶液滴定10 mL 0.1 mol ·L -1HA (K a =1.0×10-5)溶液的滴定曲线如图所示。
下列说法错误..的是A .a 点溶液的pH 约为3B .水的电离程度:d 点>c 点C .b 点溶液中粒子浓度大小:c (A -)>c (K +)>c (HA )>c (H +)>c (OH-)D .e 点溶液中:c (K +)=2c (A -)+2c (HA ) 【答案】D【解析】A .由溶液pH=7时消耗KOH 的体积小于10mL 可知,HA 为弱酸,设0.1 mol ·L -1HA 溶液中c (H +)=xmol/L ,根据电离平衡常数可知2-5x =1100.1-x⨯,解得x ≈1×10-3mol/L ,因此a 点溶液的pH 约为3,故A 不符合题意;B .d 点溶质为KA ,c 点溶质为HA 、KA ,HA 会抑制水的电离,KA 会促进水的电离,因此水的电离程度:d 点>c 点,故B 不符合题意;C .b 点溶质为等浓度的KA 和HA ,149W h 5a 101010K K K ---===,HA 的电离程度大于A -的水解程度,结合溶液呈酸性可知b 点溶液中粒子浓度大小:()()()()()A K HA H OH c c c c c -++->>>>,故C 不符合题意;D .e 点物料守恒为:()()()2K 3A 3HA c c c +-=+,故D 符合题意;故答案为:D 。
【点睛】比较时溶液中粒子浓度:(1)弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。
如在稀醋酸溶液中:CH3COOHCH 3COO -+H +,H 2OOH-+H +,在溶液中微粒浓度由大到小的顺序:c (CH 3COOH)>c (H +)>c (CH 3COO -)>c (OH -);(2)弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。

第15练水溶液中的离子平衡图像分析1.pH 与稀释倍数的线性关系图像分析(以HX,HY 为例子)【方法技巧】(1)依据曲线变化,判断HY 为强酸、HX 为弱酸(2)a、b 两点的溶液中:c (X -)=c (Y -)=c (H +)一c (OH -)(3)水的电离程度:d>c>a=b2.酸碱中和滴定曲线上的特殊点分析(常温下,用0.1000mol·L -1NaOH 溶液滴定20.00mL 0.1000mol·L -1CH 3COOH 溶液所得滴定曲线为例子)【方法技巧】解题时巧抓“四点”,突破溶液中的粒子浓度关系:(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,判断生成什么溶质及溶液的酸碱性。
(3)抓溶液的“中性”点,判断生成什么溶质,哪种物质过量或不足。
(4)抓反应的“过量”点,判断溶液中是什么溶质,哪种物质过量。
“一半”点B 点,溶质为CH 3COONa、CH 3COOH,离子浓度关系:c (CH 3COO -)>c (Na +)>c (H +)>c (OH -);“中性”点C 点,溶质为CH 3COONa、CH 3COOH,离子浓度关系:c (CH 3COO -)=c (Na +)>c (H +)=c (OH -);“恰好”反应点D 点,溶质为CH 3COONa,离子浓度关系:【方法技巧】沉淀溶解平衡图像题的解题策略第一步:明确图像中横、纵坐标的含义横、纵坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义(1)在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时。
在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时(3)曲线下方区域的点均为不饱和溶液,此时第三步:抓住Ksp的特点,结合选项分析判断(1)溶液在蒸发时,离子浓度的变化分两种情况:①原溶液不饱和时,离子浓度都增大;②原溶液饱和时,离子浓度都不变。


电解质溶液中的图像练习题1.某温度下,相同pH的盐酸和醋酸分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。
据图判断正确的是 ( )A.Ⅱ为盐酸稀释时的pH变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点K W的数值比c点K W的数值大D.b点酸的总浓度大于a点酸的总浓度2.25 ℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH 溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
下列叙述正确的是( )A.HA溶液的物质的量浓度为0.01 mol·L-1B.b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)D.25 ℃时,HA的电离平衡常数K约为1.43×10-23.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH 变化如图所示。
下列说法正确的是 ( )A.稀释前,c(A)=10c(B)B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/LC.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等4.(2017河南南阳等六市联考,13)某温度下,向一定体积0.1mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示。
下列说法不正确的是( )A.M点和N点溶液中H2O的电离程度相同B.Q点溶液中,c(N)+c(NH3·H2O)=c(Cl-)C.M点溶液的导电性小于Q点溶液的导电性D.N点溶液加水稀释,变小5.(2016河南顶级名校调研,9)在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。
下列说法中正确的是( )A.a点对应的溶液中能大量存在:Fe3+、Na+、Cl-、SO42-B.b点对应的溶液中能大量存在:N、Ba2+、OH-、I-C.c点对应的溶液中能大量存在:Na+、Ba2+、Cl-、C O32-D.d点对应的溶液中能大量存在:Na+、K+、SO42-、Cl-6.(2018湖北部分重点中学联考,7)常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是( )A.滴定过程的任何时刻都存在:c(H+)+c(Na+)=c(OH-)+c(Cl-)B.曲线b是氢氧化钠溶液滴定盐酸的滴定曲线C.氢氧化钠溶液的物质的量浓度为0.1mol·L-1D.P点时恰好完全中和,溶液呈中性7.(2017江西九江十校第二次联考,13)25℃时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。



与缓冲溶液有关的图像问题1、(2012•江苏)25℃时,有c(CH3COOH)+c(CH3COO﹣)=0.1mol•L﹣1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO ﹣)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是A.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)B.W 点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH﹣)C.pH=3.5 的溶液中:c(Na+)+c(H+)﹣c(OH﹣)+c(CH3COOH)=0.1mol•L﹣1D.向W 点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH﹣)2、(2015•抚州模拟)25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是A.当c(HS﹣)>c(S2﹣)时,溶液一定显酸性B.当pH=7时,溶液中有c(Na+)=c(HS﹣)+2c(S2﹣)+c(H2S)C.当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Ksp(CuS)=6.3×10﹣36)D.当pH=9时,溶液中有c(H+)=c(OH﹣)+c(HS﹣)3、(2009•包河区校级模拟)右图是一水溶液在pH从0至14的范围内H2CO3、HCO3﹣、CO32﹣三种成分平衡时组成分数,下列叙述不正确的是A.人体血液的pH约为7.4,则CO2在血液中多以HCO3﹣形式存在B.在pH为10.25时,溶液中c(HCO3﹣)=c(CO32﹣)C.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上D.此图是1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液的滴定曲线4、(2015•浙江模拟)某浓度的二元弱酸酒石酸溶液的型体分布图如图,将酒石酸简写成H2A,下列有关叙述正确的是A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小B.H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同C.溶液的pH=4.5时,存在如下关系:c(Na+)>c(HA﹣)>c(A2﹣)>c(H+)>c(OH﹣)D.已知HClO的电离平衡常数为10﹣7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO﹣═HClO+HA﹣5、(2012•北京)6、(2015•奉贤区二模)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定.这种溶液称为缓冲溶液.例如:人体血液中HCO3﹣和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05.某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L 的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液.已知该缓冲溶液利用的平衡体系是:H2PO4﹣⇌H++HPO42﹣,请根据该平衡体7、(2015•台州校级模拟)磷酸(H 3PO 4)在水中可分三步电离,能够以H 3PO 4、H 2PO 4﹣、HPO 42﹣、PO 43﹣等四种粒子形式存在,当溶液的pH 发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分数分布)也可能发生变化.图1是某浓度H 3PO 4溶液中各种粒子的物质的量分数δ随pH 的变化曲线.用NaOH 标准溶液滴定该H 3PO 4溶液,绘得滴定曲线如图2.下列说法不正确的是 A .从图1可知H 3PO 4、HPO 42﹣、PO 43﹣不能大量共存,0.01mol•L ﹣1NaH 2PO 4溶液中c (H 2PO 4﹣)>c (H 3PO 4)>c (HPO 42﹣)B .PO 43﹣+H 2O ⇌0H ﹣+HPO 42﹣的平衡常数为10﹣1.7C .从a 点到b 点的反应为H 2PO 4﹣+OH ﹣=HPO 42﹣+H 2O ,可以选用pH 计确定滴定终点,无需添加指示剂D .在Na 2HPO 4溶液中存在c (Na +)+c (OH ﹣)=c (H +)+c (PO 43﹣)+2c (HPO 42﹣)+3c (H 2PO 4﹣)+4c (H 3PO 4)8、(2013•江苏)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.(3)磷的重要化合物NaH 2PO 4、Na 2HPO 4和Na 3PO 4可通过H 3PO 4与NaOH 溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.①为获得尽可能纯的NaH 2PO 4,pH 应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 . ②Na 2HPO 4溶液显碱性,若向溶液中加入足量的CaCl 2溶液,溶液则显酸性,其原因是 (用离子方程式表示).9、(2015•石家庄一模)高铁酸钾(K 2FeO 4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.(1)湿法制备K 2FeO 4:在KOH 溶液中,用KC1O 直接氧化Fe (NO 3)3即可制得K 2FeO 4.该反应的离子方程式为 . (2)测定K 2FeO 4:样品纯度:i .称取样品mg ,加入到盛有过量碱性亚铬酸钠[NaCr (OH )4]溶液的锥形瓶中充分反应; ii .将所得铬酸钠(Na 2CrO 4)溶液酸化;iii .在所得Na 2Cr 2O 7溶液中加入8﹣9滴二苯胺磺酸钠溶液作指示剂,用c mol .L ﹣1(NH 4)2Fe (SO 4)2溶液滴定至终点,消耗溶液体积为V mL .整个过程中发生的反应如下:i . Cr (OH )4﹣+ FeO 42﹣+ = Fe (OH )3(H 2O )3↓+ CrO 42﹣+ii .2CrO 42﹣+2H +═Cr 2O 72﹣+H 2Oiii .Cr 2O 72﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O①配平方程式i ; ②利用上述数据计算该样品的纯度为 .(用含字母的代数式表示). (3)高铁酸盐在水溶液中有四种含铁形体.25℃时,它们的物质的量分数随pH 的变化如图所示: ①pH=2.2时,溶液中主要含铁形体浓度的大小关系为 ;为获得尽可能纯净的高铁酸盐,pH 应控制在 .②已知H 3FeO 4+的电离常数分别为:K 1=2.51×10﹣2,K 2=4.16×10﹣4,K 3=5.01×10﹣8,当pH=4时,溶液中 .③向pH=6的高铁酸盐溶液中加入KOH 溶液,发生反应的离子方程式为 . (4)某新型电池以金属锂为负极,K 2FeO 4为正极,溶有LiPF 6的有机溶剂为电解质.工作时+第8题图10、(2015•杭州三模)酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9﹣3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是A.常温下,H2T⇌H++HT﹣Ka=10﹣3B.当HT﹣和T2﹣物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度C.当葡萄酒的pH为3.7时,HT﹣所占分数达到最大,此时葡萄酒中c(H2T)<c(T2﹣)D.葡萄酒中除了存在酒石酸外,还存在酒石酸盐11、(2012•广州校级三模)常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是A.H2A是二元弱酸B.当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)C.当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)D.当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小12、(2015•台州一模)在25℃时,向10mL0.01moL.L﹣1NaCN溶液滴加入0.01moL.L﹣1的盐酸,滴定曲线如图1所示,CN﹣1、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是A.b点时,溶液中微粒浓度大小的关系:c(CN﹣)>c(Cl﹣)>c(HCN)>c(OH﹣)>c(H+)B.d点溶液垂直的关系:c(Na+)+c(H+)=c(HCN)+c(OH﹣)+2c(CN﹣)C.图2中的e点对应图1中的c点D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小13、(2009•平邑县校级模拟)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.请回答下列问题:(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:.(2)写出Na2CO3溶液中加入少量盐酸的离子方程式.(3)当混合液的pH=时,开始放出CO2气体.(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10﹣7 g时开始产生沉淀X,则K SP(X)=.14、(2014秋•榕城区校级期中)磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:①从图1中推断NaH2PO4溶液呈性(填“酸”、“碱”或“中”),这说明.②在Na3PO4溶液中,c(Na+)/c(PO43﹣)3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43﹣)的值减小,原因是.③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O.如图2是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率.15、(2009•淮阴区校级模拟)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式.(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为.当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是.(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是.(4)在Na3PO4溶液中,3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,的值减小,原因是16、(2010秋•红岗区校级期末)草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4﹣、C2O42﹣,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4②NaHC2O4③H2C2O4④(NH4)2C2O4⑤NH4HC2O4已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42﹣) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H2C2O4溶液中滴加0.1mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)时,溶液显性(填“酸”、“碱”或“中”),且V(NaOH)10mL(填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A.溶液②中,c(C2O42﹣)<c(H2C2O4)B.溶液②中,c(H2C2O4)+c(OH﹣)=c(C2O42﹣)+c(H+)C.溶液④⑤中都符合c(NH4+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)D.五种溶液都符合c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.1mol•L﹣1.(5)五种溶液中c(H2C2O4)由大到小排列的顺序是.(6)配平氧化还原反应方程式:C2O42﹣+MnO4﹣+H+=CO2↑+Mn2++H2O(7)称取6.0g含H2C2O4•2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液用0.10mol/L 酸性KMnO4溶液滴定,滴定终点如何判断.当加入16mL 0.10mol/L 酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4•2H2O 的质量分数为,KHC2O4的质量分数为.如果用0.25mol/L NaOH 溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数(填“偏高”“偏低”或“无影响”)17、(2006•广东)水体中重金属铅的污染问题备受关注。
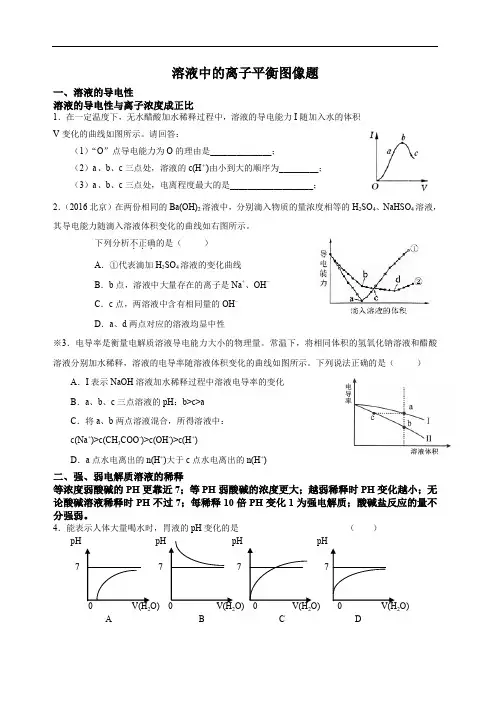
溶液中的离子平衡图像题一、溶液的导电性溶液的导电性与离子浓度成正比1.在一定温度下,无水醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答:(1)“O”点导电能力为O的理由是______________;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_________;(3)a、b、c三点处,电离程度最大的是___________________;2.(2016北京)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性※3.电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)二、强、弱电解质溶液的稀释等浓度弱酸碱的PH更靠近7;等PH弱酸碱的浓度更大;越弱稀释时PH变化越小;无论酸碱溶液稀释时PH不过7;每稀释10倍PH变化1为强电解质;酸碱盐反应的量不分强弱。
4.能表示人体大量喝水时,胃液的pH变化的是()7 7 7O)2222A B C D5.0.1 mol·L -1的醋酸与0.1 mol·L -1的盐酸,分别稀释相同的倍数,随着水的加入,溶液中c (H +)的变化曲线(如下图)正确的是( )6.某温度下,相同pH 值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积变化的曲线如图所示。

易错专题14水溶液中离子平衡图像聚焦易错点:►易错点一稀释图像►易错点二滴定曲线►易错点三K W 、K sp 的图像►易错点四分布系数图像易错点一稀释图像【易错典例】例1(2023·浙江温州·三模)在一定温度下,冰醋酸稀释过程中溶液的导电能力与pH 的变化如图。
下列有关说法中正确的是A .a 点3CH COOH 溶液未达到电离平衡状态B .离子总浓度越大,溶液导电能力越强C .向a 、b 两点溶液中分别滴入同一NaOH 溶液至中性,溶液中的()3n CH COO -相同D .b 点后,溶液中加水稀释,所有离子浓度均减小B 【详解】A .加水稀释过程中,a 点、b 点都达到了电离平衡,故A 错误;B .导电能力与离子浓度和所带电荷数有关,因此离子总浓度越大,溶液导电能力越强,故B 正确;C .根据电荷守恒3n(CH COO )n(OH )n(Na )n(H )--+++=+,溶液呈中性,3n(CH COO )n(Na )-+=,a 点醋酸浓度大,向a 、b两点溶液中分别滴入同一NaOH 溶液至中性,a 点消耗的氢氧化钠溶液比b 点消耗的氢氧化钠溶液多,因此溶液中的()3n CH COO -是a 点大于b 点,故C 错误;D .b 点后,溶液中加水稀释,醋酸根、氢离子浓度减小,氢氧根浓度增大,故D 错误。
【解题必备】稀释图像(pH 与稀释倍数的线性关系)①HY为强酸、HX为弱酸②a、b两点的溶液中:c(X-)=c(Y-)③水的电离程度:d>c>a=b ①MOH为强碱、ROH为弱碱②c(ROH)>c(MOH)③水的电离程度:a>b【变式突破】1.(2023·北京房山·一模)某温度下,将pH和体积均相同的HCl和3CH COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。
下列叙述不正确的是A.稀释前溶液的浓度:()()3HCl CH COOHc c<B.溶液中水的电离程度:b点<c点C.从b点到d点,溶液中()()c H c OH+-⋅逐渐增大D.在d点和e点均存在:()H c c+>(酸根阴离子)C【详解】A.稀释前两溶液的pH值相等,由于醋酸是部分电离,因此溶液的浓度:c(HCl)<c(CH3COOH),故A正确;B.b点pH值小于c点pH值,说明c点酸性弱,抑制水的电离程度小,水的电离程度大,因此溶液中水的电离程度:b点<c点,故B正确;C.从b点到d点,由于溶液的温度不变,因此溶液中c(H+)·c(OH-)不变,故C错误;D.在d点和e点均存在电荷守恒即c(H+)=c(酸根阴离子)+c(OH-),因此存在:c(H+)>c(酸根阴离子),故D正确。

1.I2在KI溶液中存在平衡I2(aq)+I(aq)=I—(aq)。
某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上的任何点都表示平衡状态)。
下列说法正确的是①I2(aq)+I—(aq)=I3—(ag) ΔH>0②若温度为T1、T2时反应的平衡常数分别为K1、K2,则K1>K2③若反应进行到状态D时,一定有v正>v逆④状态A与状态B相比,状态A的c(I2)大⑤保持温度不变,向该混合溶液中加水,将变大A.只有①②B.只有②③C.①③④D.①③⑤【答案】B2.室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。
下列说法正确的是A.NaOH溶液和浓氯水可以使用同种滴定管盛装B.a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)C.b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-【答案】C3.25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。
下列说法正确的是A.图中M、N两点对应溶液中的c(OH-)比较:前者>后者B.丙酸的电离常数K=10-4.88C.等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c (HCOOH)>c(HCOO-)>c(OH-)>c(H+)【答案】B4.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
水溶液中离子平衡图像题入门训练(教师版)1.25℃时,用0.1mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1某二元弱酸H2A ( K a1 =1.1×10-3,K a2= 3.9×10-6 )溶液,滴定过程中溶液的pH 变化曲线如图所示。
下列说法正确的是A.a 点的pH 大于2B.b 点溶液中c(H2A) > c(A2-)C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH-)-c(H+)D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)【答案】C【解析】a 点发生H2A的电离且K a1>>K a2,故K a1=c(HA−)×c(H+)/c(H2A)=1.1×10-3,则c2(H+)=1.1×10-3×0.1,解得c(H+)≈1.05×10-2,故pH小于2,A项错误;b点酸碱恰好完全反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),则c(H2A)<c(A2-),B项错误;c点为Na2A,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),得到:c(HA-)+2c(H2A )=c(OH-)-c(H+),C项正确;d点为Na2A和NaOH的混合物,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),D项错误;答案选C。
2.已知某二元酸H2MO4在水中电离分以下两步:H2MO4⇌H++HMO4-,HMO4-⇌H++MO42-。
专题11水溶液中的离子平衡1.【2018新课标3卷】用0.100mol·L-1AgNO3滴定50.0mL0.0500 mol·L-1Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400mol·L-1Cl-,反应终点c移到a D.相同实验条件下,若改为0.0500mol·L-1Br-,反应终点c向b 方向移动【答案】C【解析】C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a点对应的是15mL,选项C错误。
D.卤化银从氟化银到碘化银的溶解度应该逐渐减小,所以K SP(AgCl)应该大于K SP(AgBr),将50mL0.05mol/L的Cl-溶液改为50mL 0.05mol/L的Br-溶液,这是将溶液中的氯离子换为等物质的量的溴离子,因为银离子和氯离子或溴离子都是1:1沉淀的,所以滴定终点的横坐标不变,但是因为溴化银更难溶,所以终点时,溴离子的浓度应该比终点时氯离子的浓度更小,所以有可能由a点变为b点。
选项D 正确。
考点定位:考查沉淀溶解平衡以及图像分析等【试题点评】本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。
注意:横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。
本题虽然选择了一个学生不太熟悉的滴定过程——沉淀滴定,但是其内在原理实际和酸碱中和滴定是一样的。
分布系数图像1.柠檬酸(用H 3R 表示)可用作酸洗剂。
常温下,向0.1mol ·L -1H 3R 溶液中加入少量NaOH 固体(忽略溶液体积的变化),H 3R 、H 2R -、HR 2-和R 3-的含量与pH 的关系如图所示。
下列叙述正确的是( )。
A .图中b 曲线表示HR 2-的变化B .HR 2-的电离常数为K a3=1×10-6C .pH =7时,c (Na +)=c (HR 2-)+c (H 2R -)+c (R 3-)D .pH =5时,c (HR 2-)+c (H 2R -)+c (R 3-)=0.1mol ·L -1【解析】选B 。
A 项,H 3R 溶液中加入NaOH ,先反应生成NaH 2R ,再生成Na 2HR ,最后生成Na 3R ,则图中曲线a 、b 、c 、d 分别代表H 3R 、H 2R -、HR 2-和R 3-,错误;B 项,HR 2-的电离常数K a3=)()()(--23HR R H c c c ⨯+,由图可知,HR 2-和R 3-的含量相等时,溶液的pH =6,则有K a3=c (H +)=1×10-6,正确;C 项,常温下,pH =7时,溶液呈中性,则有c (H +)=c (OH -),结合电荷守恒推知,c (Na +)=2c (HR 2-)+c (H 2R -)+3c (R 3-),错误;D 项,由图可知,pH =5时溶液中存在H 3R 、H 2R -、HR 2-和R 3-,据物料守恒可得c (HR 2-)+c (H 2R-)+c(R3-)+c(H3R)=0.1mol·L-1,错误。
2.(2020·滨州二模)柠檬酸(用H3R表示)是一种高效除垢剂。
常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。
下列说法正确的是()。
A.由a点判断H3R的第一步电离常数K a1(H3R)的数量级为10-3B.若b点溶液中金属阳离子只有Na+,则有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)D.反应2H2R-H3R+HR2-在该温度下的平衡常数K=10x-y【解析】选CD。
答案和解析1.【答案】【解析】【分析】假设加入来调节溶液的值,则随着的加入,逐渐减小,逐渐增大,则从左往右曲线分别代表A、和,据此分析解题。
【解答】A.根据电荷守恒可知,点对应的溶液中存在,A 错误;B.由图示信息可知,点对应的溶液中最大,,所以溶液显碱性,即在溶液中存在,B错误;C.由图示信息可知,当时即点,溶液,说明小于,故室温下,将与按物质的量:混合加入纯水中,,即此时溶液的,C错误;D.过程中,溶液的酸性逐渐减弱,对水电离的抑制程度也逐渐减弱,同时、浓度促进增大,、的水解程度即对水的电离的促进作用逐渐加强,故室温下,、、三点对应的溶液中,由水电离的与的乘积数值由大到小顺序:,D正确;故答案为:。
2.【答案】【解析】溶液中的来自醋酸的电离和水的电离,所以,A错误;等体积混合后,恰好完全反应生成,为强碱弱酸盐,越稀越水解,因此浓度小于的,B正确;等体积混合后,溶液呈酸性,说明的电离程度大于的水解程度,因此,C错误;等体积混合后,恰好完全反应生成,水解促进水的电离,等体积混合,电离产生的抑制水的电离,因此等体积混合后水的电离程度比等体积混合后水的电离程度大,D错误。
3.【答案】【解析】【分析】本题考查了离子浓度大小比较,明确酸的电离平衡常数与酸的强弱、酸根离子水解程度大小之间的关系是解本题关键,再结合物料守恒、物质的性质等知识点来分析解答,试题侧重考查学生的分析能力及综合应用能力,题目难度中等。
【解答】A、、均为一元酸,等体积、等物质的量浓度的和,,中和酸消耗的碱与酸的物质的量成正比,所以消耗的一样多,故A错误;B、相同物质的量浓度的,,,,水解程度越大,溶液越大,电离程度,所以水解程度,则大小为:,故B错误;C、由表中数据可知,酸性:,强酸能够制取弱酸,二者反应生成和,离子方程式为:,故C错误;D、根据电荷守恒规律:和,由于甲酸的酸性大于,所以等物质的量浓度的和溶液,溶液水解能力强,较大,相对较小,由于两溶液相等,所以溶液中所含阴离子总数大于溶液所含阴离子总数,故D正确。
与缓冲溶液有关的图像问题1、(2012•江苏)25℃时,有c(CH3COOH)+c(CH3COO﹣)=0.1mol•L﹣1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO ﹣)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是A.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)B.W 点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH﹣)C.pH=3.5 的溶液中:c(Na+)+c(H+)﹣c(OH﹣)+c(CH3COOH)=0.1mol•L﹣1D.向W 点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH﹣)2、(2015•抚州模拟)25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是A.当c(HS﹣)>c(S2﹣)时,溶液一定显酸性B.当pH=7时,溶液中有c(Na+)=c(HS﹣)+2c(S2﹣)+c(H2S)C.当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Ksp(CuS)=6.3×10﹣36)D.当pH=9时,溶液中有c(H+)=c(OH﹣)+c(HS﹣)3、(2009•包河区校级模拟)右图是一水溶液在pH从0至14的范围内H2CO3、HCO3﹣、CO32﹣三种成分平衡时组成分数,下列叙述不正确的是A.人体血液的pH约为7.4,则CO2在血液中多以HCO3﹣形式存在B.在pH为10.25时,溶液中c(HCO3﹣)=c(CO32﹣)C.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上D.此图是1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液的滴定曲线4、(2015•浙江模拟)某浓度的二元弱酸酒石酸溶液的型体分布图如图,将酒石酸简写成H2A,下列有关叙述正确的是A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小B.H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同C.溶液的pH=4.5时,存在如下关系:c(Na+)>c(HA﹣)>c(A2﹣)>c(H+)>c(OH﹣)D.已知HClO的电离平衡常数为10﹣7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO﹣═HClO+HA﹣5、(2012•北京)6、(2015•奉贤区二模)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定.这种溶液称为缓冲溶液.例如:人体血液中HCO3﹣和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05.某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L 的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液.已知该缓冲溶液利用的平衡体系是:H2PO4﹣⇌H++HPO42﹣,请根据该平衡体7、(2015•台州校级模拟)磷酸(H 3PO 4)在水中可分三步电离,能够以H 3PO 4、H 2PO 4﹣、HPO 42﹣、PO 43﹣等四种粒子形式存在,当溶液的pH 发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分数分布)也可能发生变化.图1是某浓度H 3PO 4溶液中各种粒子的物质的量分数δ随pH 的变化曲线.用NaOH 标准溶液滴定该H 3PO 4溶液,绘得滴定曲线如图2.下列说法不正确的是 A .从图1可知H 3PO 4、HPO 42﹣、PO 43﹣不能大量共存,0.01mol•L ﹣1NaH 2PO 4溶液中c (H 2PO 4﹣)>c (H 3PO 4)>c (HPO 42﹣)B .PO 43﹣+H 2O ⇌0H ﹣+HPO 42﹣的平衡常数为10﹣1.7C .从a 点到b 点的反应为H 2PO 4﹣+OH ﹣=HPO 42﹣+H 2O ,可以选用pH 计确定滴定终点,无需添加指示剂D .在Na 2HPO 4溶液中存在c (Na +)+c (OH ﹣)=c (H +)+c (PO 43﹣)+2c (HPO 42﹣)+3c (H 2PO 4﹣)+4c (H 3PO 4)8、(2013•江苏)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.(3)磷的重要化合物NaH 2PO 4、Na 2HPO 4和Na 3PO 4可通过H 3PO 4与NaOH 溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.①为获得尽可能纯的NaH 2PO 4,pH 应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 . ②Na 2HPO 4溶液显碱性,若向溶液中加入足量的CaCl 2溶液,溶液则显酸性,其原因是 (用离子方程式表示).9、(2015•石家庄一模)高铁酸钾(K 2FeO 4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.(1)湿法制备K 2FeO 4:在KOH 溶液中,用KC1O 直接氧化Fe (NO 3)3即可制得K 2FeO 4.该反应的离子方程式为 . (2)测定K 2FeO 4:样品纯度:i .称取样品mg ,加入到盛有过量碱性亚铬酸钠[NaCr (OH )4]溶液的锥形瓶中充分反应; ii .将所得铬酸钠(Na 2CrO 4)溶液酸化;iii .在所得Na 2Cr 2O 7溶液中加入8﹣9滴二苯胺磺酸钠溶液作指示剂,用c mol .L ﹣1(NH 4)2Fe (SO 4)2溶液滴定至终点,消耗溶液体积为V mL .整个过程中发生的反应如下:i . Cr (OH )4﹣+ FeO 42﹣+ = Fe (OH )3(H 2O )3↓+ CrO 42﹣+ii .2CrO 42﹣+2H +═Cr 2O 72﹣+H 2Oiii .Cr 2O 72﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O①配平方程式i ; ②利用上述数据计算该样品的纯度为 .(用含字母的代数式表示). (3)高铁酸盐在水溶液中有四种含铁形体.25℃时,它们的物质的量分数随pH 的变化如图所示: ①pH=2.2时,溶液中主要含铁形体浓度的大小关系为 ;为获得尽可能纯净的高铁酸盐,pH 应控制在 .②已知H 3FeO 4+的电离常数分别为:K 1=2.51×10﹣2,K 2=4.16×10﹣4,K 3=5.01×10﹣8,当pH=4时,溶液中 .③向pH=6的高铁酸盐溶液中加入KOH 溶液,发生反应的离子方程式为 . (4)某新型电池以金属锂为负极,K 2FeO 4为正极,溶有LiPF 6的有机溶剂为电解质.工作时第8题图10、(2015•杭州三模)酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9﹣3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是A.常温下,H2T⇌H++HT﹣Ka=10﹣3B.当HT﹣和T2﹣物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度C.当葡萄酒的pH为3.7时,HT﹣所占分数达到最大,此时葡萄酒中c(H2T)<c(T2﹣)D.葡萄酒中除了存在酒石酸外,还存在酒石酸盐11、(2012•广州校级三模)常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是A.H2A是二元弱酸B.当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)C.当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)D.当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小12、(2015•台州一模)在25℃时,向10mL0.01moL.L﹣1NaCN溶液滴加入0.01moL.L﹣1的盐酸,滴定曲线如图1所示,CN﹣1、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是A.b点时,溶液中微粒浓度大小的关系:c(CN﹣)>c(Cl﹣)>c(HCN)>c(OH﹣)>c(H+)B.d点溶液垂直的关系:c(Na+)+c(H+)=c(HCN)+c(OH﹣)+2c(CN﹣)C.图2中的e点对应图1中的c点D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小13、(2009•平邑县校级模拟)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.请回答下列问题:(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:.(2)写出Na2CO3溶液中加入少量盐酸的离子方程式.(3)当混合液的pH=时,开始放出CO2气体.(4)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10﹣7 g时开始产生沉淀X,则K SP(X)=.14、(2014秋•榕城区校级期中)磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:①从图1中推断NaH2PO4溶液呈性(填“酸”、“碱”或“中”),这说明.②在Na3PO4溶液中,c(Na+)/c(PO43﹣)3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43﹣)的值减小,原因是.③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O.如图2是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率.15、(2009•淮阴区校级模拟)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式.(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为.当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是.(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是.(4)在Na3PO4溶液中,3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,的值减小,原因是16、(2010秋•红岗区校级期末)草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4﹣、C2O42﹣,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4②NaHC2O4③H2C2O4④(NH4)2C2O4⑤NH4HC2O4已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42﹣) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H2C2O4溶液中滴加0.1mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)时,溶液显性(填“酸”、“碱”或“中”),且V(NaOH)10mL(填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A.溶液②中,c(C2O42﹣)<c(H2C2O4)B.溶液②中,c(H2C2O4)+c(OH﹣)=c(C2O42﹣)+c(H+)C.溶液④⑤中都符合c(NH4+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)D.五种溶液都符合c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.1mol•L﹣1.(5)五种溶液中c(H2C2O4)由大到小排列的顺序是.(6)配平氧化还原反应方程式:C2O42﹣+MnO4﹣+H+=CO2↑+Mn2++H2O(7)称取6.0g含H2C2O4•2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液用0.10mol/L 酸性KMnO4溶液滴定,滴定终点如何判断.当加入16mL 0.10mol/L 酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4•2H2O 的质量分数为,KHC2O4的质量分数为.如果用0.25mol/L NaOH 溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数(填“偏高”“偏低”或“无影响”)17、(2006•广东)水体中重金属铅的污染问题备受关注。
2021高考水溶液中的离子平衡(攻克各种图像问题)1.已知25 ℃时有关弱酸的电离平衡常数见下表:则下列有关说法正确的是()A.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)B.将a mol·L-1的HA溶液与a mol·L-1的NaA溶液等体积混合,混合液中:c(Na+)>c(A-) C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-=2HA===2A-=H2B D.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)2.下列说法正确的是A.以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜B.水的电离是吸热过程,升高温度,水的离子积增大、减小pHC.由反应2C+SiO2Si+2CO,可得出C的非金属性强于SiD.pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同3.利用某些有机物的同分异构体间的转化可用来贮存热能,如降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的反应(—88.62kJ·mol—1),下列说法不正确的是A.NBD、Q、甲苯三者互为同系物B.降低温度有利于Q转化为NBDC.一定条件下遇HCl时Q比NBD稳定D.NBD、Q、甲苯三者是同分异构体4.下列说法不正确的是A.容量瓶在使用前均需要检漏B.取某盐溶液少量,滴加浓氢氧化钠溶液并加热,产生了能使湿润的红色石蕊试纸变蓝气体,说明该溶液中含有NH4+C.往某少量溶液中滴加少量BaCl2溶液,产生白色沉淀,说明溶液一定存在SO42-D.做焰色反应实验时,用稀盐酸清洗铂丝5.下列实验中.对应的现象以及结论都正确且两者具有因果关系的是A.A B.B C.C D.D6.在常温下,将体积相同,把pH=13的NaOH溶液、氨水,分别加水稀释m倍=n倍,溶液的pH都变成9,那么m与n的关系为A.4m=n B.m=n C.m<n D.m=n7.常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。
-与缓冲溶液有关的图像问题1、(2012•江苏)25℃时,有c(CH3COOH)+c(CH3COO﹣)=•L﹣1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO﹣)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是A.pH= 的溶液中:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)B.W 点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH﹣)C.pH= 的溶液中:c(Na+)+c(H+)﹣c(OH﹣)+c(CH3COOH)=•L﹣1D.向W 点所表示的 L 溶液中通入 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH﹣)2、(2015•抚州模拟)25℃时L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是—A.当c(HS﹣)>c(S2﹣)时,溶液一定显酸性B.当pH=7时,溶液中有c(Na+)=c(HS﹣)+2c(S2﹣)+c(H2S)C.当4<pH时,向其中滴加L CuSO4都有CuS沉淀(Ksp(CuS)=×10﹣36)D.当pH=9时,溶液中有c(H+)=c(OH﹣)+c(HS﹣)3、(2009•包河区校级模拟)右图是一水溶液在pH从0至14的范围内H2CO3、HCO3﹣、CO32﹣三种成分平衡时组成分数,下列叙述不正确的是A.人体血液的pH约为,则CO2在血液中多以HCO3﹣形式存在B.在pH为时,溶液中c(HCO3﹣)=c(CO32﹣)?C.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上D.此图是L碳酸钠溶液滴定LHCl溶液的滴定曲线4、(2015•浙江模拟)某浓度的二元弱酸酒石酸溶液的型体分布图如图,将酒石酸简写成H2A,下列有关叙述正确的是A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小B.H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同C.溶液的pH=时,存在如下关系:c(Na+)>c(HA﹣)>c(A2﹣)>c(H+)>c(OH﹣)D.已知HClO的电离平衡常数为10﹣将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO﹣═HClO+HA﹣-5、(2012•北京)6、(2015•奉贤区二模)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定.这种溶液称为缓冲溶液.例如:人体血液中HCO3﹣和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在±.某同学取19ml L的NaH2PO4溶液,81ml L的Na2HPO4溶液混合,配制L PH=的磷酸缓冲溶液.已知该缓冲溶液利用的平衡体系是:H2PO4﹣⇌H++HPO42﹣,请根据该平衡体系分析其缓冲原理:7、(2015•台州校级模拟)磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO4﹣、HPO42﹣、PO43﹣等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分数分布)也可能发生变化.图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线.用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2.下列说法不正确的是A.从图1可知H3PO4、HPO42﹣、PO43﹣不能大量共存,•L﹣1NaH2PO4溶液中c(H2PO4﹣)>c(H3PO4)>c(HPO42﹣)B.PO43﹣+H2O⇌0H﹣+HPO42﹣的平衡常数为10﹣。
C.从a点到b点的反应为H2PO4﹣+OH﹣=HPO42﹣+H2O,可以选用pH计确定滴定终点,无需添加指示剂D.在Na2HPO4溶液中存在c(Na+)+c(OH﹣)=c(H+)+c(PO43﹣)+2c(HPO42﹣)+3c(H2PO4﹣)+4c(H3PO4)8、(2013•江苏)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.①为获得尽可能纯的NaH2PO4,pH应控制在;pH=8时,溶液中主要含磷物种浓度大小关系为.②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是(用离子方程式表示).》9、(2015•石家庄一模)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.(1)湿法制备K2FeO4:在KOH溶液中,用KC1O直接氧化Fe(NO3)3即可制得K2FeO4.该反应的离子方程式为.(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8﹣9滴二苯胺磺酸钠溶液作指示剂,用c mol.L﹣1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL.整个过程中发生的反应如下:i. Cr(OH)4﹣+ FeO42﹣+ = Fe(OH)3(H2O)3↓+CrO42﹣+#ii.2CrO42﹣+2H+═Cr2O72﹣+H2Oiii.Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O①配平方程式i;②利用上述数据计算该样品的纯度为.(用含字母的代数式表示).(3)高铁酸盐在水溶液中有四种含铁形体.25℃时,它们的物质的量分数随pH的变化如图所示:①pH=时,溶液中主要含铁形体浓度的大小关系为;为获得尽可能纯净的高铁酸盐,pH应控制在.第8题图②已知H3FeO4+的电离常数分别为:K1=×10﹣2,K2=×10﹣4,K3=×10﹣8,当pH=4时,溶液中.③向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为.(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质.工作时Li+通过电解质迁移入K2FeO4晶体中,生成K2Li x FeO4.该电池的正极反应式为.…10、(2015•杭州三模)酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为﹣.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是A.常温下,H2T⇌H++HT﹣ Ka=10﹣3B.当HT﹣和T2﹣物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度C.当葡萄酒的pH为时,HT﹣所占分数达到最大,此时葡萄酒中c(H2T)<c(T2﹣)D.葡萄酒中除了存在酒石酸外,还存在酒石酸盐11、(2012•广州校级三模)常温下,向10mL H2A溶液中滴加L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是【A.H2A是二元弱酸B.当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)C.当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)D.当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小12、(2015•台州一模)在25℃时,向.L﹣1NaCN溶液滴加入.L﹣1的盐酸,滴定曲线如图1所示,CN﹣1、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是A.b点时,溶液中微粒浓度大小的关系:c(CN﹣)>c(Cl﹣)>c(HCN)>c(OH﹣)>c(H+)~B.d点溶液垂直的关系:c(Na+)+c(H+)=c(HCN)+c(OH﹣)+2c(CN﹣)C.图2中的e点对应图1中的c点D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小13、(2009•平邑县校级模拟)常温下在LNa2CO3溶液中逐滴加入L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.请回答下列问题:(1)用等式表示Na2CO3溶液中所有阳离子和阴离子浓度的关系:.,(2)写出Na2CO3溶液中加入少量盐酸的离子方程式.(3)当混合液的pH= 时,开始放出CO2气体.(4)在20mL LNa2CO3溶液中加入BaCl2粉末×10﹣7 g时开始产生沉淀X,则K SP(X)= .14、(2014秋•榕城区校级期中)磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:①从图1中推断NaH2PO4溶液呈性(填“酸”、“碱”或“中”),这说明.②在Na3PO4溶液中,c(Na+)/c(PO43﹣)3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43﹣)的值减小,原因是.》③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O.如图2是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为L,pH=条件下,反应前10min内磷酸的沉淀速率.15、(2009•淮阴区校级模拟)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式.(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为.当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是.(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是.(4)在Na3PO4溶液中,3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,的值减小,原因是(;16、(2010秋•红岗区校级期末)草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4﹣、C2O42﹣,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为L的下列溶液:①Na2C2O4②NaHC2O4③H2C2O4④(NH4)2C2O4⑤NH4HC2O4已知NaHC2O4溶液显酸性.·(2)Na2C2O4溶液中,c(Na+)/c(C2O42﹣) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL L H2C2O4溶液中滴加L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)时,溶液显性(填“酸”、“碱”或“中”),且V(NaOH)10mL(填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A.溶液②中,c(C2O42﹣)<c(H2C2O4)B.溶液②中,c(H2C2O4)+c(OH﹣)=c(C2O42﹣)+c(H+)C.溶液④⑤中都符合c(NH4+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)D.五种溶液都符合c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=•L﹣1.(5)五种溶液中c(H2C2O4)由大到小排列的顺序是.$(6)配平氧化还原反应方程式:C2O42﹣+ MnO4﹣+ H+= CO2↑+Mn2++ H2O(7)称取含H2C2O4•2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加L NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液用L 酸性KMnO4溶液滴定,滴定终点如何判断.当加入16mL L 酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4•2H2O的质量分数为,KHC2O4的质量分数为.如果用L NaOH 溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数(填“偏高”“偏低”或“无影响”)17、(2006•广东)水体中重金属铅的污染问题备受关注。