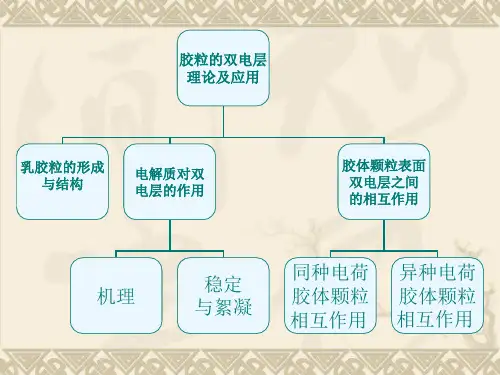
双电层理论
- 格式:doc
- 大小:106.00 KB
- 文档页数:10


电化学基础(ⅲ)——双电层模型及其发展引言电化学是研究电与化学相互作用的学科,它的核心是电极上的电荷转移过程。
而双电层模型是电化学研究中的重要理论模型之一,它描述了电极表面与电解质溶液之间形成的一层电荷分布现象。
本文将介绍双电层模型的基本概念、发展历程以及在电化学研究中的应用。
一、双电层模型的基本概念双电层模型是由德国物理学家赫尔曼·赫尔姆霍兹于19世纪末提出的。
它认为在电极表面与电解质溶液之间存在一个电荷分布层,该层由两层电荷组成:靠近电极表面的一层是吸附在电极上的电荷,称为内层电荷;远离电极表面的一层是溶液中的离子,称为外层电荷。
这两层电荷之间形成了一个电势差,称为电极电势。
二、双电层模型的发展随着科学技术的不断发展,双电层模型逐渐得到了完善。
20世纪初,瑞典物理学家古斯塔夫·奥斯特瓦尔德提出了电解质溶液中的离子在电场作用下会发生移动的理论,即电解质溶液中的离子迁移现象。
这一理论为双电层模型提供了更加准确的解释。
在古斯塔夫·奥斯特瓦尔德的基础上,英国化学家彼得·迪拜和美国化学家约翰·纽曼进一步发展了双电层模型。
他们发现,双电层模型中的电荷分布不仅与离子的吸附有关,还与电解质溶液中的离子浓度、温度、电极材料等因素有关。
近年来,随着纳米技术的发展,双电层模型在纳米材料研究中得到了广泛应用。
研究人员发现,纳米材料的比表面积较大,因此它们与电解质溶液之间形成的双电层效应更加显著。
这为纳米材料的电化学应用提供了理论支持。
三、双电层模型在电化学研究中的应用双电层模型在电化学研究中有着广泛的应用。
首先,它可以用于解释电解质溶液中的离子迁移现象。
通过研究双电层模型,可以揭示离子在电场作用下的迁移规律,从而优化电解质溶液的组成,提高电化学反应的效率。
双电层模型还可以应用于电化学传感器的设计与制备。
电化学传感器是一种利用电化学原理进行物质检测的装置,它通常由电极、电解质溶液和检测物质组成。
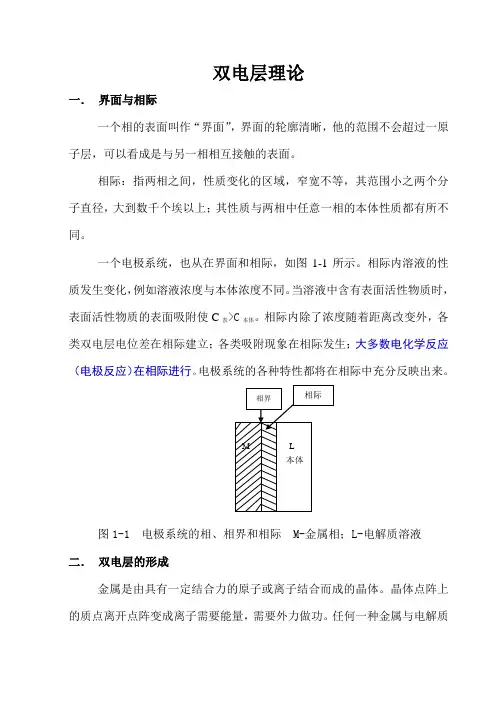
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界和相际 M-金属相;L-电解质溶液二.双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成 (1)自发形成的双电层(a )离子双电层 (b )吸附双电层 (c )偶极双电层 (2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:+++++M M2Hg–2e- = Hg22+ ,φ =0.1 VK+ + e- = K , φ= -1.6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。

双电层理论表面物理化学所涉及的内容非常宽广,固体在溶液中的荷电性质,实际上影响着固体表面性质和界面区的电荷转移反应及其进行的速度。
由于多种极其重要的表面电化学效应的发现,表面电化学引起了许多种科学家的重视和研究。
第一节 双 电 层2.1.1 双电层的产生在自然界中,固体与液体接触时,固体表面的荷电现象实际上是普遍存在的。
它导致了固—液界面的液体一侧带着相反电荷,这种界面电荷影响界面周围介质中的离子分布,与界面电荷符号相反的介质中的离子被吸向界面(这种离子称为反离子Counter -ions ),而相同符号的离子(称为同离子Co -ions )则被排离界面。
与此同时,离子的热运动又促使它们均匀混合在一起。
因此,在带电界面上形成一个扩散双电层(diffuse double layer )。
所谓扩散,就是界面周围介质中的反离子的过量是以扩散形式分布的,而不是非常整齐地集中排列在带电界面的周围。
例如,人体内与血液接触的动静脉壁和血液中胶粒等界面区都存在双电层结构,致使血液在血管中畅通无阻地流动以输送全身新陈代谢的营养而不产生血栓。
双电层理论研究反离子的扩散分布和带电界面的性质。
固体在溶液中荷电而构成双电层的原因,除了外加电场之外,大致上可归纳为以下几种情况: ① 电离作用固体表面在溶液中产生电离或溶液中的电离成分依靠某种结合力与固体表面结合而使其荷电。
例如,玻璃与水接触时,玻璃中的硅酸盐可电离出钾离子、钠离子或氢离子等,于是使玻璃带负电性而溶液带正电性;蛋白质分子具有的羧基(—COOH)和胺基(—NH 2)官能团,当pH 值降低时(酸性),溶液中电离的H +与胺基以氢键结合,从而使蛋白质带正电,-NH 2+H 2O -NH 3++OH -,而溶液一侧带负电,即在羧酸介质中—COOH 的电离被高氢浓度离子所抑制:—COOH+H 2O -COO -+H 3O+ 当pH 值升高时(碱性),蛋白质的羧基电离而使其带负电。

双电层原理双电层原理是指存在于电解质和电极表面之间的一层电荷分布。
这层电荷分布是由于电解质中的带电离子与电极表面形成吸附层产生的。
以下是关于双电层原理的详细介绍。
一、双电层原理的形成当电解质中存在可溶性的带电离子时,它们会在离子的热运动下随机地扩散到电极的附近,之后受到电极的吸引,靠近电极表面。
这时,由于电解质中水分子的存在,离子周围会确立起一个氢氧离子云。
这个云称作特定溶液中的化学"物种",因为它与其它物种有着各种互动,从而影响离子与表面之间的关系。
二、双电层原理的组成在电解质中,离子云的内部是快速扩散的带电离子。
离子周围是由于水分子氢氧离子云的形成而形成的介质带负电荷。
这个带负电荷的层就是电极空气层内的第一个向外延伸的层,称为吸附层。
吸附层的带负电荷是由于氢氧离子的分布。
在吸附层之外,电子云变得稀疏。
这层称作野区。
野区内,带正电荷的离子云和带负电荷的吸附层之间出现了弱电场。
电解质中其他离子和分子也会被拖着它们的电荷排列在野区之中。
这些离子和分子的排列就构成了电解质充电层。
三、双电层原理的应用双电层原理在电化学和表面化学中是非常重要的。
例如,这个原理是一些电化学传感器和电化学电容器的基础。
电解质中的离子云是对电容器的第一极板,而电极表面是对电容器的第二极板。
这种电容器的电容远低于空气电容器,因为电离子中的电存在于离子的质量中。
总结双电层原理是一种在电极表面和电解质间的电荷分布层。
这一理论构成了电解质与电极间的电化学交互作用的基础。
双电层原理被广泛用于电化学和表面化学中,它是理解电化学传感器和电化学电容器的原理的基础。
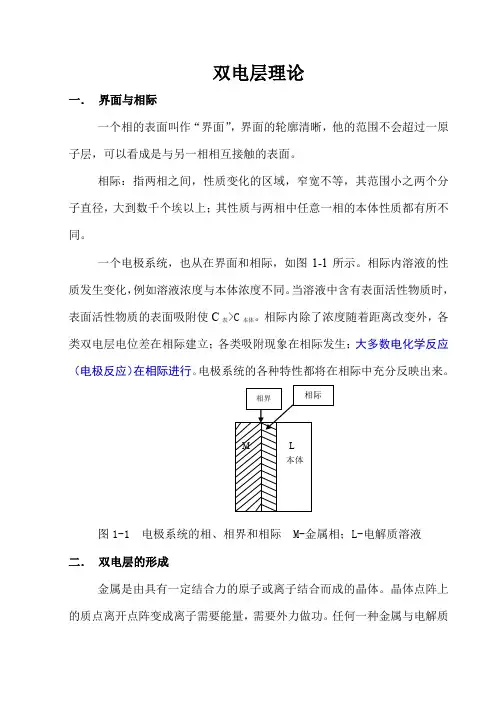
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界和相际 M-金属相;L-电解质溶液二.双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成 (1)自发形成的双电层(a )离子双电层 (b )吸附双电层 (c )偶极双电层 (2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:+++++M M2Hg–2e- = Hg22+ ,φ =0.1 VK+ + e- = K , φ= -1.6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。

双电层理论界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时, 表面活性物质的表面吸附使C a>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1电极系统的相、相界和相际M-金属相;L-电解质溶液双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电 层。
1. 界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布双电层:由于电极和溶液界面带有的电荷符号相反,故电极上的荷电物质能部分地定向排列在界面两侧。
2. 界面电荷层的形成(1)自发形成的双电层 (a )离子双电层(2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作 用下强制形成双电层。
以如下电极反应为例:/溶液界面MSM F F干㊀+ (b )吸附双电层 (C )偶极双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电 极。
如KCI 溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变 化的电极。
双电层的建立,引起电位差的变化,这种电位差变化对金属离子继续进 入溶液有阻滞作用,相反有利于返回金属表面。


双电层概念
双电层概念,是电化学中一个非常重要的概念,它是指在电解质溶液中,电极表面与周围溶液之间存在着一层由溶剂分子形成的电性分界层,其厚度为分子级别的层,这个分界层被称为“双电层”。
下面,我们将分步骤来阐述这个概念。
1. 双电层形成的原因
在电解质溶液中,电极表面和周围的溶液之间存在明显的电荷分离现象,这是因为溶剂分子在电极表面的作用下,其电荷状态发生改变,其中,通过电极表面的电子、离子等,与溶液中的带电离子相互作用,在表面附近形成了正负电荷的分离,从而形成了电性分界层,即双电层,这一层在电极表面附近,具有明显的电荷分离现象。
2. 双电层的性质
双电层是由溶剂分子组成的,它具有着一些独特的性质,其中最为特殊的是双电层的厚度非常小,只有分子级别,一般在1nm左右,同时,双电层的电荷密度也非常高,通常在1012~1014 cm-2之间,这些性质决定了双电层与周围环境之间的交互作用非常强烈。
3. 双电层的作用
双电层在电化学中具有着非常重要的作用,其中最为重要的是作为电极与溶液之间的电性分界层,屏蔽了电极表面的电荷,从而保证了电极反应的正常进行。
同时,双电层还能够吸附带电离子和分子,这种吸附作用可以调控电极反应的速率和方向,从而对反应的过程和结果产生深刻的影响。
综上所述,双电层概念是电化学中一个非常重要的概念,它通过精细的电荷分离作用,在电极反应中发挥着至关重要的作用。
双电层的研究不仅能够加深电化学理论的认识,还能够为电化学技术的发展提供新的思路和方法。

双电层理论PCEC借鉴了毛细管区带电泳和HPLC的基本原理,在分离效能和选择性调节等方面具有更大的优势。
PCEC以EOF替代压力降解为流动相的驱动力,有效地改善了流动相模型,使分离效能提高。
电动效应包括电泳、电渗、沉降点位等多种形式。
而这些电动现象都与固液相界面形成的双电层密切相关。
1.双电层的形成当固体和极性液体接触时,固体表面通过离解、特异性吸附等方式而带点。
带电的固体表面将影响液体中界面离子的分布。
反离子通过静电作用被吸附到固体表面附近,而同离子则被排斥出固体表面区域。
2.带电粒子的电泳迁移离子在溶液中的迁移过程,不仅与自身质量和所带电荷有关,而且与外加电场和其所处的化学氛围有关。
3.毛细管电色谱中影响电渗流速度的因素影响电渗流速度的主要因素为外加电场以及可以影响流动相介电常数和黏度的因素。
(1)流动相离子强度对电渗流的影响在液相色谱中,流动相一般不加入缓冲液,而在电色谱中,为了获得稳定的电渗流,通常需要在流动相中加入一定的缓冲液。
如果电渗流流动相不采用缓冲液,随PH值得变化,固定相颗粒表面的电荷将发生变化,并引起电渗流的较大变化。
不考虑流动相的介电常数和黏度的变化,无孔固定相颗粒填充的电色谱柱中,电渗流淌度随缓冲溶液浓度的变化仅由ε电位决定。
因此,离子强度的增加将造成双电层厚度的减少,ε电势下降,最终导致电渗流速度的减小。
采用大孔固定相颗粒的电色谱中,孔内电渗流对整体电渗流的贡献将不能忽视。
(2)流动相有机调节剂对电渗流的影响在毛细管电色谱中,流动相中的有机调节剂组成和浓度不仅影响溶质的保留行为,而且对电渗流也有很大影响。
在相同的有机溶剂浓度下,电渗流速率按乙腈、甲醇、四氢呋喃、异丙醇的顺序递减。
目前大多数电色谱实验都采用乙腈水体系为流动相(3)柱温(4)PH 等。
§2-1 界面双电层理论双电层类似于平行板电容器(由于静电引力)离子反离子场强 Ε= σ/ε, σ表面电荷密度;ε介电常数对于均匀电场,两点间电位差应等于场强与距离的乘积:Δσ= Ε⋅Δχ∵Δχ= δ;Δψ= ψ0∴δ=ε⋅ ψ0/δ平行板双电层表面电荷密度σ—表面电荷密度C·m–2ε—介质介电常数F·m–1ψ0—表面电势 Vδ—双电层厚度 m有过量无机盐存在时,离子型活性剂在溶液表面吸附的分子电容器模型。
¾该模型无法解释电动现象。
¾该模型最大的问题是假设了反离子平行地束缚在表面附近,忽略了由热运动和浓度差而引起的扩散问题。
¾由于静电引力和扩散的双重影响,使反离子在界面附近有一定的分布,这种分布与地面上空气密度分布不均匀是一样的。
二、Gouy(1910)-Chapman(1913)扩散双电层基本假设¾粒子表面为无限大平板,电荷均匀分布;¾扩散层中反离子是服从Boltzmann分布的点电荷;¾双电层中介质性质与体相相同;¾只有一种对称电解质。
电动电位1 体积电荷密度设:表面带正电,表面电位 ψ0单位体积内正负离子数n +、n -¾在距表面很近处n- ≈ n+, Δψ ≈ ψ0¾在距表面很远处ψ→0, n- = n+,¾根据Boltzmann 分布n -= n 0e Ζe ψ/kTn += -n 0e Ζe ψ/kTΖ—离子价数e—电子电量(1.6×10-19C )k—Boltzmann 常数zeψ—电位能,从无限远处将电荷移到x 处所作的功。
设:ρ为双电层中体积电荷密度,因为只有一种对称电解质∵表面带正电,ψ>0, sinh(y)>0, ∴ρ<0ρ<0,表明(n+-n-)<0.¾结论:表面带正电时,双电层内正电荷数小于负电荷数。
当x→∞,ψ=0,sinh(ze ψ /kT)=0, ρ=0¾在距表面无限远处,正负离子数相等。
双电层(electrical double layer)假设,将一个金属片放进电解液中,那么会发生什么呢?更准确地描述是:在电极与电解液的界面处,物质与电荷的分布状态是怎样的?(1)Helmholtz模型首先,亥姆赫兹(Helmholtz)试图探究这个问题,他建立了一个模型,我们简称其为H模型,其核心思想是:相反的电荷等量分布于界面两侧。
这也是“double layer”的由来。
进而,这个结构可以等效为一个平板电容器,并用如下公式描述单侧的电荷密度(σ)与两层电荷间的电势差(V)的关系,其中,d为正负电荷中心的距离。
σ=εε0 dV而且,该电容器的电容(Cd)可表示为:ðσðV =C d=εε0d至此,H模型成功地将将一个电化学的普遍场景抽象为两个基本公式。
然而,该模型存在一个明显缺陷:由上式可推论出,Cd是一个恒定值,然而实验观测中,Cd是一个变量,相对电位与电解液浓度等都会对其产生影响。
比如,汞电极在NaF电解液中,测得Cd值如下图所示:其中,可以看到明显的两个趋势是:(1)Cd相对于电位成V型的对称分布;(2)电解液的浓度越高,Cd数值越大。
因此,一个良好双电层模型需要解释这两个现象。
(2)Gouy-Chapman模型随后,Gouy和Chapman联手改进了这个模型,我们简称其为G-C模型。
G-C 模型的核心是引入了一个新的概念:扩散层(diffuse layer)让我们回到电极与电解液的界面处,电荷在电极这一侧是严格分布于其表面。
然而,在电解液这一侧却不是这样:由于不同离子间的相互作用,使得很多电荷会扩散到远离界面的体相溶液中。
因此,G-C模型可由下图近似表示:经过G-C模型的改进,原本电容公式中的d就变成了一个变量。
不难想象,当界面两侧电势差较大时,更多的离子会被压缩到靠近电极的位置;当电解液浓度高时,离子也可以在较小的空间上与电极达到电荷平衡。
经过G-C 模型的改进,双电层预测NaF的水溶液作为电解液,其电容与电位及浓度关系如下,可见,经过G-C模型的改进,双电层理论对变化有了很好的解释。
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1电极系统的相、相界和相际M-金属相;L-电解质溶液二.双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成(1)自发形成的双电层(a )离子双电层(b )吸附双电层(c )偶极双电层(2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:M+ + MMHg2Hg–2e-=Hg22+,φ=0.1VK++e-=K,φ=-1.6V理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。
双电层理论
一.界面与相际
一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界和相际 M-金属相;L-电解质溶液二.双电层的形成
金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质
溶液接触时
,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层
(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成 (1)自发形成的双电层
(a )离子双电层 (b )吸附双电层 (c )偶极双电层 (2)强制形成的双电层
金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层
+
+
+
+
+
M M。
以如下电极反应为例:
2Hg–2e- = Hg22+ ,φ =0.1 V
K+ + e- = K , φ= -1.6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。
双电层的建立,引起电位差的变化,这种电位差变化对金属离子继续进入溶液有阻滞作用,相反有利于返回金属表面。
这两个相反的过程逐渐趋于速度相等的状态,即达到动态平衡,最终在相界面建立起稳定的离子双电层。
由此可以解释,在阴极保护中,如果利用外加直流电流或脉冲电流来改变双电层的带电状况,引起金属与介质之间的电位变化,使其电位差达到一
个可以阻滞金属离子转入介质中的范围,进而使得被保护金属(阴极)的电化学反应降低甚至停止。
3.双电层的微分电容 (1)微分电容概念
理想极化电极作为平行板电容器处理,电容值为一常数,即
(3-1)
微分电容:引起电位微小变化时所需引入电极表面的电量,也表征了界面在电极电位发生微小变化时所具备的贮存电荷的能力。
(3-2)
电解池等效电路:
也就是说在这种完全极化的电极系统中,当流过一个微小的外电流时,作为电极材料的金属相与介质相之间没有电荷转移,亦即没有电极反应发生,全部电流只是用于改变界面的结构起着使“电容器”充电的作用,改变双电层两侧的电荷数量,此时电极系统的相界区可用一个不漏电的电容器C 来模拟。
微分电容曲线:用微分电容C d 相对于电极电位φ的变化所作的曲线,称为微分电容曲线。
微分电容法:根据微分电容曲线所提供的信息来研究界面结构与性质的实验方法。
l
C r
εε0=
ϕ
d dq C d =
微分电容曲线的应用:
利用
判断q 正负 ; 研究界面吸附 ;
求剩余电荷q 、积分电容C i (从φ0到某一电位φ之间的平均
电容称为积分电容 ):
积分电容C i 和微分电容C d 的关系: φ=φ0时q =0:
不完全极化电极系统等效电路图3-2
在这种系统中,作为电极材料的金属相与溶液相之间有电荷转移,即有电极反应发生。
由于金属和溶液这两个导体相中符号相反的过剩电荷因静电作用力,都只能处于相界区的两测,不能分散到各相的本体深处。
所以在这种电极系统中,双电层的形成,除了上述表面力的作用外,还因电极反应达到平衡前电荷在两相之间的转移而造成的电荷分离。
因此,对这种电极系统通以外电流,则外电流除了消耗于使外电层充电外,还有一部分消耗于是电极反应向一个反应方向进行。
所以对于这种电极来说,外电流的一部分使双电层两侧的电位差改变,为充电电流,常把这种电流称为非法拉第电流;外
0ϕo i q
q C ϕϕϕ-=∆=积分常数+=⎰ϕd C q d ⎰⎰==q
d d C dq q 00
ϕ
ϕϕ
电流的另一部分,是进行电极反应的电流,把他称为法拉第电流。
这样的电极系统的相界区就像一个漏电的电容器。
思考:
(1)在阴极保护中,采用直流阴极保护和脉冲电流阴极保护,是否脉冲电流阴极保护可以比直流阴极保护更好的是双电层的建立?
(2)脉冲电流在建立的双电层中引起被保护金属与介质的电位差是否要比直流阴极保护引起的电位差范围更广?
(3)脉冲电流引起的电位差对金属离子进入介质的阻滞作用更加精确?
(4)脉冲电流跟直流电流相比是不是能够在更远的距离时较好的引起被保护金属与介质形成的双电层电位差变化?
电极及电极极化
一.电极
电极实际上是一个半电池,一般是由金属和溶液构成的体系。
电极又分为单电机和多重电极两种。
单电机是指在电极的相界面(金属/溶液)上只进行单一的电极反应。
而多重电极则可能发生多个电极反应。
在一个电极上发生两个反应的称为二重电极,例如在无氧的盐酸溶液中的锌电极即属于此。
电极还可以分为可逆电极和不可逆电极。
单电极往往可以做到电子交换和物质交换的平衡,成为可逆电极。
因此只有单电极才可能是可逆电极,有平衡电位可言。
多重电极一般是不可逆电极,只能建立非平衡电位。
1. 单电极
单电极包括金属电极、气体电极和氧化还原电极三种。
(1)金属电极
金属在含有自己离子的溶液中构成的电极称为金属电极。
此时金属离子可以超过相界面,并建立起电极平衡。
如铜在硫酸溶液中建立起来的平衡电极即为这种电极,其反应可写为:
22Cu Cu e +⇔+
在Cu/4CuSO 的相界面只发生22()()Cu Cu Cu sol ++⇔的迁越,如果是正反应22()()Cu Cu Cu sol ++⇔,则电极的金属部分溶解,
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。