双电层模型(精)
- 格式:ppt
- 大小:151.50 KB
- 文档页数:12



164扩散双电层理论和 Zeta 电势胶体粒子的表面常因解离、吸附、极化、摩擦等原因而带电,分散介质则带反电荷,因此, 在相界面上便形成了双电层。
胶体的这种结构决定了它的电学性质, 并对其稳定性起着十分重要的作用。
本专题便来讨论胶体的双电层结构, 并从中引出一个决定胶体电学性质和稳定性的重要指标——ς(Zeta电势。
1.双电层模型(1 Helmholtz模型1879年, Helmholtz 在研究胶体在电场作用下运动时,最早提出了一个双电层模型。
这个模型如同一个平板电容器, 认为固体表面带有某种电荷, 介质带有另一种电荷, 两者平行, 且相距很近,就像图 64-1所示。
图 64-1 Helmholtz双电层模型按照这个模型,若固体表面的电势为0ψ,正、负电荷的间距为δ,则双电层中的电势随间距直线下降,且表面电荷密度σ与电势0ψ的关系如下式表示δεψσ0= (64-1 式中ε为介质的介电常数。
显然, 这是一个初级双电层模型, 它只考虑到带电固体表面对介质中反离子的静电作用, 而忽视了反离子的热运动。
虽然, 它对胶体的早期研究起过一定的作用, 但无法准确地描述胶体在电场作用下的运动。
(2 Gouy(古依— Chapman (恰普曼模型由于 Helmholtz 模型的不足, 1910和 1913年, Gouy 和 Chapman 先后作出改进,提出了一个扩散双电层模型。
这个模型认为, 介质中的反离子不仅受固体表面离子的静电吸引力, 从而使其整齐地排列在表面附近, 而且还要受热运动的影响, 使其离开表面, 无规则地分散在介质中。
这便形成如图 64-2所示的扩散双电层结构。
2图 64-2 Gouy— Chapman 扩散双电层模型他们还对模型作了定量的处理,提出了如下四点假设:①假设表面是一个无限大的平面,表面上电荷是均匀分布的。
②扩散层中,正、负离子都可视为按 Boltzmanm 分布的点电荷。
③介质是通过介电常数影响双电层的,且它的介电常数各处相同。

电化学基础(ⅲ)——双电层模型及其发展引言电化学是研究电与化学相互作用的学科,它的核心是电极上的电荷转移过程。
而双电层模型是电化学研究中的重要理论模型之一,它描述了电极表面与电解质溶液之间形成的一层电荷分布现象。
本文将介绍双电层模型的基本概念、发展历程以及在电化学研究中的应用。
一、双电层模型的基本概念双电层模型是由德国物理学家赫尔曼·赫尔姆霍兹于19世纪末提出的。
它认为在电极表面与电解质溶液之间存在一个电荷分布层,该层由两层电荷组成:靠近电极表面的一层是吸附在电极上的电荷,称为内层电荷;远离电极表面的一层是溶液中的离子,称为外层电荷。
这两层电荷之间形成了一个电势差,称为电极电势。
二、双电层模型的发展随着科学技术的不断发展,双电层模型逐渐得到了完善。
20世纪初,瑞典物理学家古斯塔夫·奥斯特瓦尔德提出了电解质溶液中的离子在电场作用下会发生移动的理论,即电解质溶液中的离子迁移现象。
这一理论为双电层模型提供了更加准确的解释。
在古斯塔夫·奥斯特瓦尔德的基础上,英国化学家彼得·迪拜和美国化学家约翰·纽曼进一步发展了双电层模型。
他们发现,双电层模型中的电荷分布不仅与离子的吸附有关,还与电解质溶液中的离子浓度、温度、电极材料等因素有关。
近年来,随着纳米技术的发展,双电层模型在纳米材料研究中得到了广泛应用。
研究人员发现,纳米材料的比表面积较大,因此它们与电解质溶液之间形成的双电层效应更加显著。
这为纳米材料的电化学应用提供了理论支持。
三、双电层模型在电化学研究中的应用双电层模型在电化学研究中有着广泛的应用。
首先,它可以用于解释电解质溶液中的离子迁移现象。
通过研究双电层模型,可以揭示离子在电场作用下的迁移规律,从而优化电解质溶液的组成,提高电化学反应的效率。
双电层模型还可以应用于电化学传感器的设计与制备。
电化学传感器是一种利用电化学原理进行物质检测的装置,它通常由电极、电解质溶液和检测物质组成。




双电层双电层的形成:当两相接触时,如果电子或离子等荷电粒子在两相中具有不同的电化学位,荷电粒子就会在两相之间发生转移或交换,界面两侧便形成符号相反的两层电荷,人们把界面上的这两个荷电层称为双电层;如金属、溶液界面M/L 两侧,若μM+>μM+L,则荷电粒子发生转移,金属表面荷负点;反之,则金属表面荷正,这种双电层常称为离子双层;尽管有时上述的离子双层并不存在,但金属与溶液界面间仍然会存在着电位差,无论是金属表面,还是溶液表面,都存在着偶极层;由于偶极子正负电荷分隔开而形成的双电层,称为偶极双电层;对任何一种金属而言,由于金属的电子会“溢出”金属表面形成双极子;所以即使溶液一侧不存在偶极子层,但对金属与溶液的界面来说,这种偶极双层总是存在的;此外,溶液中某一种离子有可能被吸附于电极与溶液界面上,形成一层电荷;这层电荷又借助静电作用吸引溶液中同等数量的带相反电荷的离子而形成双电层,可称之为吸附双层;这里应当注意:界面上第一层电荷的出现,靠的是静电力以外的其他化学与物理作用,而第二层电荷则是由第一层电荷的静电力引起的;如果界面上有了吸附双层,当然也会产生一定大小的电位差;金属与溶液界面的电位差系由上述的三种类型电位差的一部分或全部组成,但其中对电极反应速度有重大影响的,则主要是离子双层的电位差;离子双层的形成有两种可能的情况;一是在电极与溶液一旦接触后的瞬间自发形成的;另一种情况,是在外电源作用下强制形成的双电层;因为有的时候,当金属与溶液接触时,并不能自发地形成双电层;如将纯汞Hg放入Kill溶液的界面上常常不能自发的形成双电层;但是,如果将Hg电极与外电源负极连接,外电源就向Hg电极供应电子,在其电位达到K+还原电位之前,电极上不会发生电化学反应,因而此时Hg电极上有了多余的电子而带上负电;这层负电荷吸引溶液中相同数量的正电荷如K+,形成双电层;双电层的结构模型:金属电极和溶液之间界面上形成的双电层,从结构上可以有离子双电层、表面偶极双电层和吸附双电层等三种类型;关于带质点在双层内分布的问题,各个时期提出了不同的模型;这里着重讨论离子双电层结构的几个经典模型;(1)平板电容器模型早在19世纪末,亥姆霍茨Helmholtz就曾提出“平板电容器”模型,或称为“紧密双电层”,模型;按照这种模型,电极表面上和溶液中的剩余电荷都紧密地排列在紧密两侧,形成类似于平板电容器那样的双层结构;如果假设溶液中负离子能比正离子更接近电极表面,采用这种模型可以解释某种溶液中;测得的微分电容曲线在两侧各有一段水平的线段;但是这种模型完全无法解释为什么在稀溶液中会出现极小值;2古依Gouty—查普曼Chapman模型为了绕过平板电容器模型所遭遇的困境,古依Gouty和查普曼Chapman在1913年前后,各自独立地提出了“分散双电层”模型;他们提出对溶液一侧离子分布的一种假想;这种假想与10年之后由Debye-Hackle提出的关于强电解质理论的前提具有相同的出发点1923年;他们认为:由于离子热运动的影响,溶液一侧的剩余电荷不可能紧密地排列在界面上,而应当按照位能场中粒子的分配规律分布在邻近界面的液层中,即形成电荷的“分散层”;这种模型可以满意地解释稀溶液中出现的电容极小值;但是在电荷表面密度过高时,计算得出的电容值却远大于实验测得的数值,在发展过程中又出现了新的矛盾;(3)斯特恩Stern模型1924年,斯特恩Stern提出了一种改进后的双层模型;他是在古依Gouty—查普曼Chapman分散双层模型基础上发展起来的,同时又吸取了亥姆霍茨紧密双层模型的合理部分;根据这一模型,双电层可以同时具有紧密性和分散性;这种模型认为:当电极表面电荷密度较大,同时电解质溶液的总浓度较大约几摩尔/升以上时,液相中离子倾向于紧密地分布在界面上,这时可能形成所谓“紧密双电层”,与一个荷电的平板电容器相似;如果溶液中离子浓度不够大,或是电极表面电荷密度比较小,则是由于离子热运动,致使溶液中的剩余电荷不可能全部集中排列在界面上,而使电荷分布具有一定的“分散性”;这种情况下,双电层包括“紧密层”与“分散层”两部分;设d为水化离子的半径,在与电极距离x=0至x=d的薄层中不可能存在电荷,也就是说,在紧密双电层中x≤d不存在离子电荷,故电场强度为恒指,电位梯度也保值不变,在此间隔中电位与x成线性变化,且此直线很陡;在x>d的区间内,当x增大,电场强度及电位梯度的数值也随之变小,直至趋近于零;因此在分散层中,电位ψ随距离x呈曲线变化,曲线的形状先陡后缓;这时电极与溶液之间的电位差ψ实际包含两个组成部分:①紧密双电层中的电位差,ψ-ψ1;②分散层中的电位差,ψ1.这里的ψ和ψ1都是相对溶液内部的电位规定为零而言的;根据上面的讨论容易看出:如果电极表面所带电荷多,静电作用占优势,离子热运动的影响减小,双电层结构较紧密,在整个电位中,紧密层电位占地比例较大,即ψ1电位的值变小;溶液浓度增大时,离子热运动变困难,故分散层厚度减小,ψ1的值也减小;所以,电极表面带的电荷很多,并且溶液中离子的浓度很大时,分散层厚度几乎等于零,可以认为ψ1≈0;反之,当金属表面所带电荷极少,且溶液很稀,则分散层厚度可以变得相当大,以至于近似认为双层中紧密层不复存在;若电极表面所带电荷下降为零,则达到了很高的分散,离子双层随之消失;温度升高时,质点热运动增大,ψ1电位亦增大;当溶液与温度相同时,双电层的分散性随离子价数的增加4而减小;以上讨论金属与溶液之间的双电层时,只考虑了金属上的剩余电荷与溶液中的离子剩余电荷之间的作用,诚然,这是形成金属与溶液间双电层的主要原因;但除此之外,还有溶剂例如水的极性分子与金属上剩余电荷的作用以及溶液中某种负离子在金属上的特性吸附作用会影响界面双电层的结构;1963年,Backrest等考虑水和水和离子的定性吸附,对Gouty-Chapman-SternGCS模型进一步修正,提出紧密层分为内紧密层和外紧密层;内紧密层IHP由吸附水离子﹑特性吸附离子组成;外紧密层OHP为紧密层与分散层的分界,由水化离子组成;当电荷表面存在负的剩余电荷时,水化正离子并非与电极直接接触,二者之间存在着一层吸附水分子,在这种情况下,水化正离子距电极表面稍远些;由这种离子电荷构成的紧密层称为外紧密层;当电极表面化的剩余电荷为正时,构成双电层的的水化负离子的水化膜被破坏,并且它能挤掉吸附在电极表面上的水分子而与电极表面直接接触;这种情况下紧密层中负离子的中心线与电极表面距离比正离子小得多,可称之为内紧密层;因此根据构成双电层离子离子性质不同,紧密层有内层和外层之分,正如前所述,可以解释电极表面荷正电时,测得的电容值比电极表面荷负电时要大的原因;经典双电层理论的研究方法主要是根据假设模型计算得到界面参数并与实验测定值相比较,如果吻合,说明假设模型成立;而且在经典模式中,未考虑溶剂与溶质分子,离子的粒子性以及个粒子间的相互作用,认为在亥姆霍茨平面内每一点都是等单位的,而事实上,这个平面内不同点存在不同的电位值如果考虑亥姆霍茨平面内的离子电荷作为一个点电荷在金属表面层中引起的“镜像电荷”,则金属表面电荷的分布也是不均匀的;自20世纪70年代以来,双电层理论研究进一步向深度发展,如人们提出溶液离子为荷电硬球的设想,把溶剂近似为连续介质或简化为点偶极硬球来处理,以流体物理为基础,借助计算机模拟技术对经典模型进行修正,在双电层理论的研究中取得了一定的进展;近年来采用电化学扫描隧道显微镜等先进物理化学手段对双电层研究取得了一定的进展;有关最新双电层理论和研究请参看相关文献;双电层任何两个不同的接触都会在两相间产生,这是因分离引起的;两相各有过剩的电荷,相等,相反,相与,形成双电层;123概述在的金属-电解质的两相界面存在电势,同样将产生双电层electricaldoublelayer,其总厚度一般约为0.2-20纳米;电极的金属相为良导体,过剩电荷集中在表面;的较大,过剩电荷只部分紧贴相界面,称紧密双层compactdoublelayer;余下部分呈分散态,称分散双层diffusedoublelayer;有误译为“”;的核心步骤——迁越骤即活化步骤都需在紧密层中进行,影响电极反应的过程也发生在双电层中,故双电层结构的研究对于的理论和生产都有重要意义;胶核表面拥有一层离子,成为电位离子,电位离子层通过,把溶液中电荷相反的吸引到胶核周围,被吸引的离子称为,它们的电荷总量与电位离子的相等而符号相反;这样,在胶核周围介质的相间界面区域就形成所谓双电层;扩散双电层理论溶胶粒子带电,这些电荷的主要来源是从水溶液中选择性地吸附某种离子:吸附正离子胶粒带正电,吸附负离子带负电,但整个溶液是的,故还应有等量的反离子存在;固粒的离子和溶液中的反离子构成双电层;反离子在溶液中受到两个方向相反的作用:1.固粒表面被吸附的离子的引力,力图将它们拉向界面;2.离子本身的热运动,使之离开界面而扩散到溶液中去,其结果使反离子在固粒表面外呈平衡分布:靠近界面处反离子浓度大些;随着与界面距离的增大,反离子由多到少,形成扩散分布,如图3-7所示;MN代表粒子的平表面,设它吸附负离子,则电量相等的扩散分布,就好象大气层中气体分子按高度分布的状态;直到界面负电荷电力所不及处,过剩离子浓度等于零;带电表面及这些反离子,就构成扩散双电层;双电层的厚度随溶液中离子浓度和电荷数而不同;实验证明,溶胶粒子在电场下与溶液发生相对移动时,分界面不是在固液界面MN处,而是有一层液体牢固地附在固体表面,并随表面运动;按电泳算出的就是此滑动面上的电势,称电动电势或€-电势;€-电势除受决定电势的离子浓度影响外,还与溶液中其它电解质的浓度有关;当电解质浓度增加时,被压缩、变薄;同时某些具有特异性吸附能力的离子加入后,还可使€-电势符号改变。


锌铜原电池双电层模型锌铜原电池是一种常见的原电池,它基于锌和铜两种金属之间的化学反应产生的电能。
在锌铜原电池中,锌金属作为负极材料,铜金属作为正极材料,它们之间通过电解质溶液进行接触。
锌铜原电池的双电层模型是一种描述电池工作原理的模型。
它将电池中的电荷分布分为两个区域:电解质层和电极电缓冲层。
电解质层是指电解质溶液与金属电极之间的接触面积。
在电解质溶液中,溶质会负责释放或接收电荷,并通过离子传递电流。
这些电荷在溶液中通过离子和或电子形式传递,从而维持电池的电流。
电极电缓冲层是锌和铜金属表面与电解质之间的接触区域。
当电解质中的正负离子接触到金属表面时,它们会吸附在金属表面上,形成一个电荷层,称为电荷分离层。
这个分离层中的电荷主要来源于溶解或沉积在金属表面的离子。
这一层的存在能够阻止金属表面进一步溶解或沉积,从而保护电极免受腐蚀。
在锌铜原电池中,当电池闭合时,锌金属通过电解质向铜金属释放电荷。
锌金属表面发生氧化反应,将离子释放到电解质溶液中,同时电子通过外部电路流向铜金属,形成电流。
铜金属表面接收到的金离子会还原,从溶液中沉积到金属表面。
双电层模型的核心思想是,在电极电缓冲层中存在着大量的表面电荷,通过吸附和吸附等机制与电解质中的离子交换电荷。
在电池工作过程中,这些电荷层的行为会影响电极的电位和电荷的传递速度。
因此,理解电极电缓冲层的特性和电荷分布对于理解锌铜原电池的工作原理至关重要。
需要指出的是,双电层模型只是对锌铜原电池内部电荷分布和传递的一种理论解释,并不涉及电池的具体结构和其他细节。
在实际应用中,锌铜原电池的性能还受到许多因素的影响,如金属纯度、电解质浓度、温度等。
因此,在设计和使用锌铜原电池时,还需要考虑这些因素,以获得更好的电池性能。
电化学基础(ⅲ)——双电层模型及其发展介绍如下:
在电化学中,双电层模型是一个核心概念,用来解释电解质溶液中电位生成的原理。
双电层是指一个电极表面与周围电解质溶液之间的区域。
这个区域对于电极的电位具有显著的贡献,在电化学反应中具有重要作用。
双电层模型最初的概念是在19世纪末由德国化学家赫尔曼·冯·海姆霍兹提出的,他认为双电层是由电极表面电荷所引起的电解质排斥作用和质子吸附所形成的。
这个模型虽然初步解释了电极电位的生成,但是却无法解释一些实验发现上的不足,例如初始化瞬态。
随着研究的不断深入,双电层模型逐渐得到完善,发展出新的理论。
其中最有代表性的是由英国学者戴维·奥特南提出的“电双层模型”。
这个模型的基本假设是电极表面有一个稀薄的、不带电的层,叫做“亲水层”(a layer of adsorbed water molecules),亲水层外面有一层电荷分布的电视双层隔开。
电视双层的内部是带电的,“阳离子云”(cations' cloud)和“阴离子云”(anions' cloud)分别带正负电荷,可以解释很多实验现象,成为当前主流的双电层模型。
除此之外,还有许多其他的双电层模型被提出,例如双相模型、裂解亲水层模型等。
这些模型都试图在实验和理论上对双电层进行更为准确和全面的描述和解释。
总之,双电层模型是电化学领域中非常基础的概念,对于解释电解质溶液中电极的电位和电流行为具有重要的作用。
随着研究的不断深入和技术的不断发展,我们对双电层模型的认识和理解也越来越深入和准确。
双电层及其结构模型双电层是指由正负离子之间形成的电荷层,存在于液体中。
它由紧密吸附在电极表面的正离子层(即化学吸附层)和漂浮在电极表面附近的负离子层(即物理吸附层)组成。
这种双电层的存在是由离子在液体中的溶解度和电离度决定的。
双电层的结构模型可以分为两种,分别是亚布力德双电层模型和海维赛德双电层模型。
亚布力德双电层模型是由瑞士物理学家亚布力德在20世纪30年代提出的。
他认为双电层可以看作由一个内层和一个外层组成。
内层是紧贴电极表面的化学吸附层,包含正离子和一些吸附的溶质分子。
溶质分子与电极表面之间通过共价键或静电相互作用而吸附在一起。
外层则是由溶剂中的负离子组成的物理吸附层,负离子漂浮在电极表面附近,受到电极电场的作用而停留在该位置。
这种模型认为,双电层是稳定的,且在不同电势条件下会有不同的结构。
海维赛德双电层模型是由英国科学家海维赛德在20世纪起提出并发展的。
这个模型认为双电层由内层和外层组成,类似于亚布力德的模型。
但是,海维赛德提出了一种新的概念,即溶剂分子的极化。
他认为,在电极表面附近,溶剂分子会被电场极化,形成一个特定方向的电偶极子,这些电偶极子会受到电场力的作用而定向堆积,形成外层。
因此,海维赛德提出的双电层模型中考虑了电极表面电场对溶剂的影响。
总的来说,双电层的结构模型揭示了离子在液体中的封闭性和电极表面的吸附现象。
根据这些模型,我们可以更好地理解双电层的形成和性质,进一步研究电化学反应、电容和电化学储能等领域的基本原理和应用。
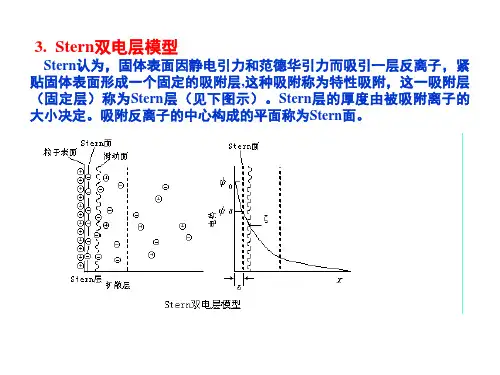
简述斯特恩扩散双电层模型的要点全文共四篇示例,供读者参考第一篇示例:斯特恩扩散双电层模型是描述电解质溶液板间的电荷分布和电荷传输特性的经典模型。
它由德国化学家斯特恩于1924年发表,是对古典电解质理论的重要补充,为后来电化学领域的发展奠定了基础。
斯特恩扩散双电层模型主要包括普朗克层和斯特恩层两部分,下面将详细介绍其要点。
普朗克层是指电解质板间的一个致密层,其中的电荷分布由电离的离子和溶剂分子组成。
在这一层内,带正电荷的离子和带负电荷的溶剂分子被吸附在固体表面上,形成一个电荷层。
普朗克层的存在表明,在电解质板间有着一定程度的电离和电荷分布,从而影响溶液的电导率和电化学性质。
斯特恩扩散双电层模型的要点在于描述了电解质溶液中的电荷分布和电荷传输特性,揭示了电解质溶液板间的复杂结构和动力学过程。
这一模型在电化学领域具有重要的理论意义和实际应用价值,为研究电解质在溶液中的行为提供了有力的理论支持。
它不仅有助于理解溶液的电导率、极化性和化学反应动力学等方面的问题,还有助于设计新型电化学传感器、储能器件和电解质材料等应用。
斯特恩扩散双电层模型是电化学领域的经典模型之一,对于理解电解质溶液中的电荷分布和传输特性具有重要意义。
通过研究该模型,我们可以更深入地认识电解质溶液的结构和性质,为开发新型电化学器件和解决环境、能源等问题提供理论支持和技术指导。
希望本文所介绍的斯特恩扩散双电层模型的要点能够对读者有所启发,促进电化学领域的研究和发展。
第二篇示例:斯特恩扩散双电层模型是描述电解质溶液中电荷粒子的扩散行为的重要理论模型。
该模型由德国物理化学家斯特恩在20世纪初提出,并被广泛应用于解释电解质在电解质溶液中的扩散现象。
在斯特恩扩散双电层模型中,电解质溶液被认为是由两层电荷分布较为复杂的离子团组成,即离子团层和双电层。
离子团层是由电解质分子及其离子团组成的,在浓度较高的情况下,这一层中的离子趋向于形成大的簇块,受到周围电场的影响较小。
双电层双电层的形成:当两相接触时,如果电子或离子等荷电粒子在两相中具有不同的电化学位,荷电粒子就会在两相之间发生转移或交换,界面两侧便形成符号相反的两层电荷,人们把界面上的这两个荷电层称为双电层。
如金属、溶液界面(M/L)两侧,若μM+>μM+(L),则荷电粒子发生转移,金属表面荷负点;反之,则金属表面荷正,这种双电层常称为离子双层。
尽管有时上述的离子双层并不存在,但金属与溶液界面间仍然会存在着电位差,无论是金属表面,还是溶液表面,都存在着偶极层。
由于偶极子正负电荷分隔开而形成的双电层,称为偶极双电层。
对任何一种金属而言,由于金属的电子会“溢出”金属表面形成双极子。
所以即使溶液一侧不存在偶极子层,但对金属与溶液的界面来说,这种偶极双层总是存在的。
此外,溶液中某一种离子有可能被吸附于电极与溶液界面上,形成一层电荷。
这层电荷又借助静电作用吸引溶液中同等数量的带相反电荷的离子而形成双电层,可称之为吸附双层。
这里应当注意:界面上第一层电荷的出现,靠的是静电力以外的其他化学与物理作用,而第二层电荷则是由第一层电荷的静电力引起的。
如果界面上有了吸附双层,当然也会产生一定大小的电位差。
金属与溶液界面的电位差系由上述的三种类型电位差的一部分或全部组成,但其中对电极反应速度有重大影响的,则主要是离子双层的电位差。
离子双层的形成有两种可能的情况。
一是在电极与溶液一旦接触后的瞬间自发形成的。
另一种情况,是在外电源作用下强制形成的双电层。
因为有的时候,当金属与溶液接触时,并不能自发地形成双电层。
如将纯汞(Hg)放入Kill溶液的界面上常常不能自发的形成双电层。
但是,如果将Hg电极与外电源负极连接,外电源就向Hg电极供应电子,在其电位达到K+还原电位之前,电极上不会发生电化学反应,因而此时Hg电极上有了多余的电子而带上负电。
这层负电荷吸引溶液中相同数量的正电荷(如K+),形成双电层。
双电层的结构模型:金属电极和溶液之间界面上形成的双电层,从结构上可以有离子双电层、表面偶极双电层和吸附双电层等三种类型。