氮氧化物的产生及相互转化复习过程
- 格式:ppt
- 大小:1.05 MB
- 文档页数:16

燃烧过程中氮氧化物的生成机理一、本文概述氮氧化物(NOx)是燃烧过程中产生的一类重要污染物,对人类健康和环境质量构成了严重威胁。
本文旨在深入探讨燃烧过程中氮氧化物的生成机理,为有效控制其排放提供理论基础。
文章首先概述了氮氧化物的主要来源和危害,然后详细介绍了燃烧过程中氮氧化物的生成途径,包括热力型NOx、快速型NOx和燃料型NOx的生成过程。
接着,文章分析了影响氮氧化物生成的主要因素,如燃烧温度、氧气浓度、燃料种类等。
在此基础上,文章探讨了降低氮氧化物排放的技术措施,如低氮燃烧技术、烟气脱硝技术等。
文章对氮氧化物生成机理的未来研究方向进行了展望,旨在为燃烧过程氮氧化物减排技术的研发和应用提供有益参考。
二、氮氧化物的生成途径氮氧化物的生成主要发生在高温、富氧的燃烧环境中,其生成途径主要分为三种:热力型NOx、快速型NOx和燃料型NOx。
热力型NOx:在高温条件下,空气中的氮气与氧气直接发生反应,生成NO,这是热力型NOx的主要生成方式。
这种反应通常在燃烧区域的温度高于1500℃时发生,且随着温度的升高,NO的生成速率会显著增加。
快速型NOx:快速型NOx主要在碳氢燃料浓度较高的区域生成,其中燃料中的碳氢化合物与氮气、氧气以及羟基自由基(OH)等发生反应,生成NO。
这种反应方式在火焰前锋的富燃料区域中特别显著,因为这里的碳氢化合物浓度最高。
燃料型NOx:燃料型NOx的生成与燃料中的氮元素有关。
在燃烧过程中,燃料中的氮元素首先被氧化为氨(NH3)和氰化氢(HCN)等中间产物,这些中间产物再进一步与氧气反应生成NO和NO2。
燃料型NOx的生成量取决于燃料的种类和燃烧条件,如火焰温度、氧气浓度以及燃料与氧气的混合程度等。
在燃烧过程中,这三种NOx生成途径可能同时发生,但在不同的燃烧条件和燃料类型下,它们对总NOx生成量的贡献可能会有所不同。
例如,在燃气轮机和高温工业锅炉中,热力型NOx是主要的NOx生成途径;而在柴油机和某些燃煤锅炉中,燃料型NOx的贡献可能更为显著。

一、氮氧化物的产生及转变【教课目的】 1、掌握氮氧化物之间的转变2 、认识 NO 、NO 2 的物理性质3、认识氮氧化物对空气的污染及防治举措【教课过程】【问题导读】空气中含量最多的是,我们四周还有林林总总的。
是生命物质的重要组 成元素,人体内运输氧气的 和植物内催化光合作用的中都含有元素,是农作物必要的元素。
【引入】自然界中大多数氮元素以游离态存在于空气中,仅有少量植物能将游离态的氮转变 为可汲取的化合态的氮,我们把游离态氮转变成化合态氮的方法称为“固氮作用” 。
【简介】固氮作用:门路 举例自然固氮 → 闪电时, N 2 转变成 NO生物固氮→豆科作物根瘤菌将 N 2 转变成化合态氮工业固氮 →工业上用 N 2 和 H 2 合成氨【过渡】 乡村有句谚语“雷雨发庄稼” ,你知道此中的含义吗?【学生活动】对以上问题沟通议论,参照书 p97 图 4-12【总结概括】往常状况下,空气中的N 2 和 O 2 不发生反响,但在放电或高温下两者能够直接化 合生成 NO , NO 很简单在常温下与空气中的O 2 化合生成 NO 2, N放电2+O 22NO2NO+O2 2NO23NO 222HNO 3+ NO+ H O 【板书】一、一氧化氮和二氧化氮1、 一氧化氮和二氧化氮的生成N 2+O 2放电2NO (无色气体)2NO+O22 NO2(红棕色气体)3NO 2+H 2O2HNO 3 + NO【过渡】 NO 、 NO 2 是氮的两种重要的化合物,那它们有什么样的性质呢?【沟通议论】2、物理性质一氧化氮:无色无味的气体,有毒,不溶于水,比空气略大二氧化氮:红棕色有刺激性气味的气体,有毒,密度比空气大,可溶于水并与水反响。
3 、化学性质一氧化氮:不与水反响,在往常状况下易被氧气氧化成二氧化氮 2NO+O 2= 2NO 2 二氧化氮: 3NO 2+H 2O=2HNO 3+N O2NO2+H 2O=2HNO 3+NONO2+ SO = SO + NO (NO 拥有强氧化性)23 2*2NO 2N2O 4(故往常测 NO 2 的相对分质量大于它的实质值)*2NO + 2KI = I2+2KNO2【思虑】 1、怎样鉴识 NO 和 CO 气体?2、 NO 2 气体和溴蒸气都是红棕色,可否用淀粉碘化钾试纸差别NO 2 和溴蒸气?假如不能,应怎样鉴识?【过渡】氮元素对在生命活动中饰演着十分重要的角色,可是含氮化合物也给人类生活带来 了一些负面影响,如氮氧化合物致使空气污染等,那空气中氮氧化物的根源有哪些呢?氮氧化物的污染又表此刻哪几方面?我们又采纳哪些举措进行防治呢?【学生活动】1、氮氧化物的①氮肥生产、金属冶炼和汽车等交通工具使用的尾气②火山迸发、雷鸣电闪2、污染:①酸雨②光化学烟雾③臭氧空洞3、防治举措:①使用干净能源减少氮氧化物的排放;②为汽车等交通工具安装尾气转变壮装置(2NO+ 2CO N 2 + 2CO 2)③关于生产化肥、硝酸工厂排放的废气进行办理(NO+NO2+2NaOH = 2NaNO+ H 2O、2NO2+2NaOH = 2NaNO + NaNO3 + H 2O)【课外练习】1.据称 2004 年冬天将是自 1869 年人类有气象观察记录以来的四大暖冬之最。
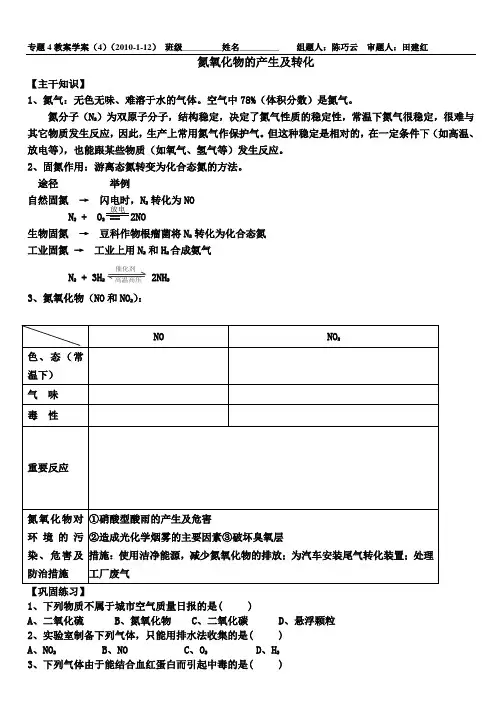
专题4教案学案(4)(2010-1-12) 班级_________姓名_________ 组题人:陈巧云 审题人:田建红氮氧化物的产生及转化【主干知识】1、氮气:无色无味、难溶于水的气体。
空气中78%(体积分数)是氮气。
氮分子(N 2)为双原子分子,结构稳定,决定了氮气性质的稳定性,常温下氮气很稳定,很难与其它物质发生反应,因此,生产上常用氮气作保护气。
但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
2、固氮作用:游离态氮转变为化合态氮的方法。
途径 举例自然固氮 → 闪电时,N 2 转化为NON 2 + O2 == 2NO生物固氮 → 豆科作物根瘤菌将N 2 转化为化合态氮工业固氮 → 工业上用N 2 和H 2合成氨气N 2 + 3H 2 催化剂 高温高压 2NH 3 3、氮氧化物(NO 和NO 2):【巩固练习】1、下列物质不属于城市空气质量日报的是( )A 、二氧化硫B 、氮氧化物C 、二氧化碳D 、悬浮颗粒2、实验室制备下列气体,只能用排水法收集的是( )A 、NO 2B 、NOC 、O 2D 、H 23、下列气体由于能结合血红蛋白而引起中毒的是( )放电成功不是将来才有的,而是从决定去做的那一刻起,持续累积而成。
A 、Cl 2B 、NOC 、O 2D 、CO4、鉴别NO 2和溴蒸汽的方法正确的是( )A 、用氢氧化钠溶液B 、用湿润的淀粉碘化钾试纸C 、用硝酸银溶液D 、用蒸馏水5、美国医学教授因发现X 物质在人体血管系统内具有传送信号的功能而荣获1998年诺贝尔生理学和医学奖。
因此 X 物质被誉为“生物信使分子”。
已知 X 是一种奇电子数分子,也是一种污染大气的无色气体且能使血红蛋白失去携氧能力。
则 X 是:( )A.COB.HFC.CO 2D.NO6、起固氮作用的化学反应的是 ( )A.工业上用氮气和氢气合成氨气B.一氧化氮与氧气反应生成二氧化氮C.氨气经催化氧化生成一氧化氮D.由氨气制碳酸氢氨和硫酸氨7、在NO 2与水的反应中,水( )A .是还原剂B .是氧化剂C .既是氧化剂又是还原剂D .既不是氧化剂又不是还原剂8、一定体积下,将等体积的NO 和O 2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原气体总体积的( )A 、41B 、43C 、81D 、839、在体积为VL 的密闭容器中通入a mol NO 和b mol O 2,反应后容器内氮原子数和氧原子数之比为( )A 、b aB 、b a 2C 、b a a 2+ D 、)2(2b a a +10、在标准状况下,将NO 2和O 2按体积比为4﹕1充满一个干燥的烧瓶,将烧瓶倒置于水中,瓶内液面上升,最后烧瓶内溶液的物质的量浓度为 ( )A 、0.045mol/LB 、0.036mol/LC 、0.026mol/LD 、0.030mol/L11、电闪雷鸣是人们司空见惯的自然现象,地球上每年平均发生315160余次闪电每当雷电交加之际,空气中可能发生如下反应:① ②③12、NO 分子因污染空气而臭名昭著。




燃烧过程中氮氧化物的形成机理一、引言随着工业化的快速发展,燃烧过程在人类生活中扮演着越来越重要的角色。
燃烧过程中产生的氮氧化物(NOx)对环境和人类健康造成了极大的危害。
因此,研究燃烧过程中氮氧化物的形成机理,对于减少污染物排放、保护环境具有重要意义。
本文将从理论角度出发,详细阐述燃烧过程中氮氧化物的形成机理。
二、燃烧过程中氮氧化物的形成1.1 氮氧化物的形成途径氮氧化物主要由两种形式存在:一氧化氮(NO)和二氧化氮(NO2)。
在燃烧过程中,这两种氮氧化物的形成途径如下:(1)燃料中的氮元素与氧气在高温下反应生成一氧化氮(NO):N2 + O2 → 2NO(2)一氧化氮与空气中的氧气反应生成二氧化氮(NO2):2NO + O2 → 2NO21.2 影响燃烧过程中氮氧化物形成的主要因素燃烧过程中氮氧化物的形成受到多种因素的影响,主要包括以下几个方面:(1)燃料特性:燃料中的氮含量、燃料中的硫含量、燃料中的微粒直径等都会影响燃烧过程中氮氧化物的形成。
一般来说,含氮量较高的燃料在燃烧过程中产生氮氧化物的可能性较大;含硫量较高的燃料在燃烧过程中容易产生硫酸盐型氮氧化物;微粒直径较小的燃料在燃烧过程中更容易形成NOx。
(2)空气特性:空气的温度、湿度、氧气浓度等都会影响燃烧过程中氮氧化物的形成。
一般来说,空气温度较高、湿度较低、氧气浓度较高时,燃烧过程中氮氧化物的形成可能性较大。
(3)燃烧器结构:燃烧器的形状、尺寸、材料等都会影响燃烧过程中氮氧化物的形成。
一般来说,火焰较宽、焰心较高的燃烧器在燃烧过程中产生氮氧化物的可能性较大。
三、燃烧过程中氮氧化物的形成机理分析2.1 燃料中的氮元素与氧气的反应燃料中的氮元素主要来源于化石燃料,如煤、石油、天然气等。
这些燃料在燃烧过程中,氮元素与氧气发生反应生成一氧化氮(NO)。
这一过程是一个经典的化学反应,其反应式为:N2 + O2 → 2NO在这个反应过程中,燃料中的氮元素和氧气的原子数之比决定了一氧化氮(NO)的产率。

氨气和氮氧化物化学方程式氨气和氮氧化物是两种常见的氮化合物,它们在大气环境中的生成和转化对空气质量和生态环境有重要影响。
下面将分别介绍氨气和氮氧化物的化学方程式,并解释它们的生成和转化过程。
一、氨气的化学方程式及生成和转化过程氨气的化学式为NH3,是氮的一种化合物。
氨气主要通过以下几种途径生成:1.1 氮化肥的分解氮化肥在土壤中分解时会释放氨气。
例如,尿素是一种常用的氮肥,其化学式为CO(NH2)2。
当尿素施用到土壤中后,尿素会被土壤中的酶水解为氨气和二氧化碳:CO(NH2)2 + H2O → 2NH3 + CO21.2 生物代谢过程生物体内的代谢过程也会产生氨气。
例如,人和动物的代谢产物尿液中含有尿素,尿素在水的作用下会分解产生氨气:CO(NH2)2 + H2O → 2NH3 + CO21.3 工业生产氨气也可以通过工业生产的方式获得,例如通过哈伯-Bosch合成反应。
该反应是将氮气和氢气在高温高压下催化反应生成氨气:N2 + 3H2 → 2NH3氨气在大气环境中也会发生一系列的转化过程。
例如,氨气可以与二氧化硫反应生成硫酸铵:2NH3 + H2SO4 → (NH4)2SO4氨气还可以与一氧化氮和二氧化氮等氮氧化物反应生成氮气和水:4NH3 + 6NO → 5N2 + 6H2O二、氮氧化物的化学方程式及生成和转化过程氮氧化物是指一系列含氮和氧元素的化合物,主要包括一氧化氮(NO)、二氧化氮(NO2)、氧化亚氮(N2O)和氮氧化物(NOx)。
它们主要通过以下几种途径生成:2.1 燃烧过程燃烧过程是氮氧化物的主要生成途径之一。
在高温条件下,氮气和氧气反应生成一氧化氮:N2 + O2 → 2NO一氧化氮进一步与氧气反应生成二氧化氮:2NO + O2 → 2NO22.2 工业生产氮氧化物还可以通过工业生产的方式获得,例如汽车尾气排放、燃煤和燃油等工业过程会释放大量的氮氧化物。
2.3 生物过程生物体内的某些代谢过程也会产生氮氧化物。


氮氧化物的产生及转化各位评委大家好!我说课的题目是苏教版化学、必修一、专题四、第一单元《生产生活中的含氮化合物》第一节氮氧化物的产生及转化,下面我将从教材分析、目标分析、教学过程、效果分析四个方面展开说课。
一、教材分析氮是生命物质必需的元素,含氮化合物在工农业生产和生活中存在重要的用途。
所以学习这一单元,不仅是学习非金属元素及其化合物的知识,也是学生获得未来生活和发展所需的科学素养的需要。
本单元内容选择充分考虑了学生已有知识和含氮化合物的实际应用。
氮气、氮氧化合物的污染、氮肥的使用等都是学生在以前的学习中接触过的内容。
通过这一单元的学习和探究,学生将意识到环境保护的重要性,形成正确的“环境保护与经济发展”的价值观。
二、学习目标的确立依据新课程理念,本着对教材结构和内容的理解,结合学生的学习基础和认知特点,确定学习目标如下:知识与技能1、理解NO、NO2的某些基本性质及用途;2、认识含氮化合物与人类生产、生活的密切关系。
过程与方法通过氮的氧化物间的转化实验,培养学生的观察能力、分析能力、推理能力,进一步激发学生的求知欲。
情感、态度、价值观逐步树立珍惜自然、爱护环境的观念,对经济发展与保护环境这两个相矛盾的因素有个客观公正的评价。
三、学习重、难点分析基于我对本节教材价值的认识和学生的实际学习能力,将教学重点确定为:NO、NO2的性质及相互转化。
难点:NO、NO2、O2和水反应的有关计算。
【教学展开分析】一、学情分析从学生的角度来看,学生在初中就已经接触了氮的氧化物,此外,学生此时已经初步学会了对比、分析、推理、实验的方法,所以本课应重视学生的自主探究。
二、教法设计俗话说:“兴趣是最好的老师”,因此在教学过程中密切联系实际,呈现给学生感兴趣的学习素材,这将能在很大程度上激发学生的学习热情;通过实验探究活动,让学生对实验事实进行归纳总结,从而获取相关知识,领略实验学习的乐趣,培养学生实事求是的科学态度,培养学生发现问题和解决问题的实验探究精神。

专题4 第二单元氮氧化物的产生及转化(第1次课)阳光化学吴一、教学目标:1.理解一氧化氮、二氧化氮的某些基本性质。
2.通过氮的氧化物间的转化实验,培养学生的观察能力、分析能力、推理能力,进一步激发学生的求知欲。
3.掌握氮氧化物、硝酸等含氮化合物的性质和用途。
4.运用演示实验手段,去学习N2与O2的放电反应。
5.学生进行自我的实验探究,通过具体的实验现象,去推导出NO(NO2)、O2与H2O反应的相关的计算方法。
6.认识含氮化合物与人类生产、生活的密切关系。
7.创设探究问题的情境,活跃学生思维,激发求知欲。
8.逐步树立珍惜自然、爱护环境的观念,对经济发展与保护环境这两个相矛盾的因素有一个客观公正的评价。
二、教学重难点:1.教学重点:NO、NO2的性质及相互转化。
2.教学难点NO、NO2、O2和水的有关计算。
三、教学方法:四、教学过程(一)课堂导入:(二)课程讲授:师在农村,有句谚语“雷雨发庄稼”,请问,怎样解释这一谚语呢?先看一个演示实验。
师(演示)氮气与氧气在放电条件下的反应生描述实验现象:矿泉水瓶中产生红棕色的气体,加入蒸馏水后,用蓝色石蕊试纸试验,试纸变红色。
推进新课师此现象说明了什么?生说明该红棕色的气体溶于水后,与水发生反应,生成了酸性物质。
师讲解原因:氧气和氮气在放电条件下,发生反应生成一氧化氮,一氧化氮遇空气中的氧气转化为二氧化氮,二氧化氮遇水转化为硝酸。
师(展示)预先收集好的2瓶气体:NO和NO2生仔细观察:师一氧化氮为无色无味气体,有毒,难溶于水,而二氧化氮为红棕色气体,有毒,能溶于水和水发生反应。
NO 、NO2都有毒,能导致肺部病变,出现咳嗽、气管炎、肺气肿等疾患。
板书:氧化物的产生及转化氮气与氧气的反应有关反应方程式:N2+O2放电2NO 2NO+O2====2 NO23NO2+H2O====2HNO3+NO师对学生提出要求:标出3个反应中氮元素的化合价,指出氧化剂、还原剂,标出电子转移方向和数目。
大气环境中氮氧化物的迁移与转化过程氮氧化物(NOx)是一类重要的大气污染物,包括一氧化氮(NO)和二氧化氮(NO2)。
它们主要来自于工业排放、机动车尾气以及燃煤等能源的燃烧过程。
氮氧化物的排放不仅对空气质量和人类健康造成直接影响,还与臭氧和细颗粒物的生成密切相关。
因此,了解氮氧化物在大气环境中的迁移与转化过程对于改善空气质量至关重要。
1. 氮氧化物的迁移氮氧化物在大气中的迁移受到多种因素的影响,包括气象条件、大气稳定度和氮氧化物浓度等。
氮氧化物在大气中的迁移主要通过对流扩散、湍流扩散和大气输送等方式进行。
对流扩散是指由于气温的变化导致气体的上升和下沉,从而使氮氧化物向上或向下扩散。
湍流扩散是指由于湍流的存在,使氮氧化物从一个地方向周围环境进行扩散。
大气输送是指氮氧化物在大气中随着气流的移动而迁移。
2. 氮氧化物的转化氮氧化物在大气中的转化是指氮氧化物之间的化学反应过程,主要包括光解、氧化、光化和光解的反应。
在光解反应中,氮氧化物可以通过吸收太阳辐射而分解成氧和氮气,从而减少氮氧化物的浓度。
在氧化反应中,氮氧化物可以与其他气体(如臭氧、挥发性有机物等)发生反应,生成新的化合物,如硝酸和硝酸盐。
在光化反应中,氮氧化物可以与有机物质一起吸收太阳辐射,产生臭氧,从而形成光化学烟雾。
在光解反应中,氮氧化物可以通过光解而分解成氮气和氧气。
3. 影响氮氧化物迁移与转化的因素除了气象条件和大气稳定度等因素外,还有一些其他因素可以影响氮氧化物在大气中的迁移与转化。
例如,大气中的颗粒物可以吸附氮氧化物,使其在大气中的浓度下降。
此外,氮氧化物的迁移与转化还受到地形和植被等因素的影响。
地形的不同会导致氮氧化物在山地和平原地区的迁移模式不同。
植被可以通过吸收氮氧化物和排放挥发性有机物等方式,影响氮氧化物的浓度和分布。
总之,大气环境中氮氧化物的迁移与转化过程是一个复杂的系统。
了解氮氧化物的迁移与转化对于制定有效的大气污染控制措施和改善空气质量至关重要。
氮氧化物的产生机理及脱氮技术原理:一、氮氧化物的产生机理在氮氧化物中,NO占有90%以上,二氧化氮占5%-10%,产生机理一般分为如下三种:(a)热力型燃烧时,空气中氮在高温下氧化产生,其中的生成过程是一个不分支连锁反应。
其生成机理可用捷里多维奇(Zeldovich)反应式表示。
随着反应温度T的升高,其反应速率按指数规律。
当T<1500℃时,NO的生成量很少,而当T>1500℃时,T每增加100℃,反应速率增大6-7倍。
热力型氮氧化物生成机理(Zeldovich反应式)在高温下总生成式为(b)瞬时反应型(快速型)快速型NOx是1971年Fenimore通过实验发现的。
在碳氢化合物燃料燃烧在燃料过浓时,在反应区附近会快速生成NOx。
由于燃料挥发物中碳氢化合物高温分解生成的CH自由基可以和空气中氮气反应生成HCN和N,再进一步与氧气作用以极快的速度生成,其形成时间只需要60ms,所生成的与炉膛压力0.5次方成正比,与温度的关系不大。
上述两种氮氧化物都不占NOx的主要部分,不是主要来源。
(c)燃料型NOx由燃料中氮化合物在燃烧中氧化而成。
由于燃料中氮的热分解温度低于煤粉燃烧温度,在600-800℃时就会生成燃料型,它在煤粉燃烧NOx产物中占60-80%。
在生成燃料型NOx过程中,首先是含有氮的有机化合物热裂解产生N,CN,HCN和等中间产物基团,然后再氧化成NOx。
由于煤的燃烧过程由挥发份燃烧和焦炭燃烧两个阶段组成,故燃料型的形成也由气相氮的氧化(挥发份)和焦炭中剩余氮的氧化(焦炭)两部分组成。
燃料中氮分解为挥发分N和焦炭N的示意图二、低NOx燃烧技术原理对于没有脱硝设备和脱硝燃烧器的燃煤锅炉来说,也就是采用低氮燃烧技术来减少NOx的生成机会。
1)在燃用挥发分较高的烟煤时,燃料型NOx含量较多,快速型NOx极少。
燃料型NOx是空气中的氧与煤中氮元素热解产物发生反应生成NOx,燃料中氮并非全部转变为NOx,它存在一个转换率,降低此转换率,控制NOx排放总量,可采取:(1)减少燃烧的过量空气系数;(2)控制燃料与空气的前期混合;(3)提高入炉的局部燃料浓度。
低氮燃烧知识点总结一、低氮燃烧技术原理1. 燃烧过程中氮氧化物的产生燃烧过程中,空气中的氮气和氧气在高温下会发生化学反应,生成氮氧化物。
其中最主要的产物是一氧化氮(NO)和二氧化氮(NO2),它们统称为氮氧化物(NOx)。
NOx的生成主要有两种途径,一是热力生成,即在燃烧温度高的情况下,氮气和氧气直接发生氧化反应生成NOx;二是燃料中的有机氮在燃烧过程中进入气相后再和氧气发生反应生成NOx。
2. 低氮燃烧技术原理低氮燃烧技术主要通过改变燃烧工艺和调整燃料供给,降低燃烧温度和燃烧产物中氧含量,从而减少NOx的生成。
具体包括以下几种技术:(1)提高燃烧温度通过提高燃烧温度,使氨和氧气在高温下尽量充分混合,可以提高NOx的生成速率,减少氨的耗损。
(2)燃烧空气预热采用热回收技术,将烟气中的热量回收并用于预热燃烧用空气,降低燃烧温度,减少NOx的生成。
(3)燃烧过程控制采用先进的燃烧控制系统,调整燃烧过程中的氧气供给和燃料供给,保持燃烧温度在适宜范围内,减少NOx的生成。
(4)利用催化剂在燃烧过程中引入催化剂,使NOx在催化剂的作用下还原成氮气和水蒸气,从而减少NOx的排放。
(5)选择低氮燃料选择低氮燃料,降低燃料中有机氮的含量,减少NOx的生成。
二、低氮燃烧技术应用1. 工业领域低氮燃烧技术在工业锅炉、热风炉、干燥设备等燃烧设备中得到了广泛的应用。
这些设备通常是大型的燃烧设备,燃烧过程中产生的NOx排放较大,采用低氮燃烧技术可以显著降低NOx排放,符合环保要求。
2. 能源领域在发电厂、燃气轮机、燃气锅炉等燃烧设备中,低氮燃烧技术也得到了广泛的应用。
能源领域的燃烧设备通常是大功率的设备,燃烧过程中产生的NOx排放对环境影响较大,采用低氮燃烧技术可以降低NOx排放,保护环境。
3. 其他领域低氮燃烧技术也逐渐应用于民用燃气壁挂炉、燃气热水器等小型家用燃烧设备中。
这些设备通常是近距离使用的设备,排放的NOx会直接对空气质量产生影响,采用低氮燃烧技术可以减少NOx排放,保护人们的健康。
氮气的氧化和还原反应氮气是大气中最重要的气体之一,它占据了大气的四分之三。
氮气不仅是生物体中的重要成分,还可以被用作肥料、火箭燃料等。
氮气也参与到了许多氧化还原反应中,这些反应在人类生活和工业生产中扮演着极为重要的角色。
一、氮气的氧化反应氮气的氧化反应是指氮气与氧气发生氧化反应,产生氮氧化物的过程。
氮氧化物包括氮一氧化物NO和二氧化氮NO2等,这些氮氧化物在大气中可以参与到臭氧层的形成与破坏中。
此外,柴油发动机、燃煤电厂等工业生产中也会排放大量的氮氧化物,对人体和环境造成威胁。
氮氧化物的生成反应式为:N2(g) + O2(g) → 2NO(g)该反应需要高温高压的条件催化下才能够达到较高的反应速率。
例如在汽车发动机燃烧过程中,高温高压的条件使得空气和汽油的氮和氧分子发生氧化反应,生成大量的氮氧化物。
这些氮氧化物在大气中能够参与到臭氧层的形成,对人类和环境造成很大的威胁。
二、氮气的还原反应氮气的还原反应是指当环境中存在还原物时,氮气分子可以还原成还原态的氮元素。
还原态的氮元素是生物体合成蛋白质、核酸和其他重要生物分子的重要原料。
在生物体内,氮元素经过一系列的代谢反应,被转化成各种重要分子,如ATP、DNA和RNA等。
氮气的还原反应误认为是固氮反应,以后也会说到这个概念。
许多微生物能够使用一种叫做氮酸还原酶的酶来催化氮气的还原反应,将氮气还原成氨,成为植物生长的营养来源。
氨是生物体生长和代谢过程中的重要原料之一,它是蛋白质和核酸的重要组成部分。
在自然界中,氧化亚氮化氢或铵离子的存在可以促进还原反应的发生。
氮气还原反应的反应式为:N2(g) + 6H+(aq) + 6e- → 2NH3(aq)其中,6个质子和6个电子都是为了将N2分子还原成NH3而提供的。
三、固氮反应固氮反应是指将氮气还原成氨的过程,也称为氮的固定,氮同化等。
固氮反应在自然界中的作用尤为重要,它是植物生长和生态系统的重要组成部分,也是食物链中的重要环节。
氮氧化物的产生及转化学历案课题:氮氧化物的产生及转化课程目标:1、了解氮的固定,掌握氮气的性质;2、掌握NO、NO2的重要性质及其与环境的关系。
学习目标:1、学生通过阅读了解氮氧化物的用途及对大气的污染,知道硝酸型酸雨形成的过程和防治方法;2、学生通过阅读从“雷雨发庄稼”原理中学会推理的科学方法;3、学生通过比较NO和NO2的性质学会类比的科学方法。
学习重点:N2、NO、NO2的化学性质及NO、NO2的相互转化学习难点:NO与H2O 的反应2学习过程:氮氧化物的产生及转化课前学习:1、氮气:氮气在空气中约占总体积的________。
通常情况下,N2是______色______味不溶于水的气体。
在自然界中既有______态氮又有______态氮,通过豆科植物的______能把空气中的氮气转化为______,工业合成氨属于固氮。
常温下,氮气性质稳定,可以代替稀有气体作保护气。
2、一氧化氮:常温下NO是______色______味溶于水的气体,密度与相接近。
3、二氧化氮:常温下NO2是_______色、有__________气味的气体,密度比空气____,易______溶于水。
4、SO2和NO2的主要来源及危害:__ ,________和__________的金属矿物的燃烧或冶炼,________尾气、硫酸厂、硝酸厂的尾气。
引起________污染,直接危害人体健康,溶于水形成________。
5、防治措施:(1)调整__________,发展__________;(2)研究煤的脱硫技术,改进燃烧技术,减少______和____________的排放;(3)加强工厂废气的回收处理;(4)改进汽车尾气的处理技术,控制汽车尾气排放标准。
课中学习:知识点一:氮气的化学性质:在一定条件下,N2能H2、O2、Mg等反应1、与氧气反应:2、与氢气反应:N2+H2---------3、与镁反应:N2+Mg--------知识点二:一氧化氮的化学性质:1、与氧气反应(还原性):NO+O2---------2、与强还原剂反应(氧化性):NO+NH3---------NO+CO---------3、毒性:与结合,引起人体缺氧中毒致死,与相同。