鲁教版九年级化学制取氧气
- 格式:ppt
- 大小:5.04 MB
- 文档页数:24


《探究氧气的实验室制法》说课稿刘占平尊敬的各位评委下午好!今天我说课的内容是鲁教版初中化学第四单元第三节第一课时《氧气的实验室制取》。
下面我从教材、学情分析、教法、学法、教学过程五个部分对本节课作如下说明:一、教材分析1、教材地位《氧气的实验室制取》是学生接触到的第一个气体制取实验。
通过对实验室制取氧气的原理和思路的分析,培养学生的实验探究能力和创新意识,更为今后学习其他气体的制取打下良好的基础。
2、教学目标根据本教材的结构和内容分析,结合初三学生的认知结构及心理特征,我制定了以下教学目标。
1、理解催化剂的定义和催化作用;2、掌握实验室制取氧气的方法(包括药品的选择、装置的选择和收集方法三个方面)。
3、教学重点、难点根据新课程标准,在吃透教材的基础上,我确定了以下教学重点和难点。
教学重点:氧气的实验室制法。
教学难点:对催化剂、催化作用的理解。
二、学情分析学生第一次制取气体,对这些操作比较陌生。
但学生具备一定的实验操作能力,而且对实验充满兴趣,有学习氧气的制取基础。
为了讲清教材的重难点,使学生能够达到该节设定的教学目标,我再从教法和学法上谈谈。
三、教法方法考虑到初三学生的现状,我主要采取学生活动的教学方法,让学生真正的参与活动,而且在活动中得到认识和体验,产生践行的愿望。
基于本节课的特点,我主要采用了以下的教学方法:1、直观演示法:2、小组探究合作法:3、集体讨论法:四、学法指导这节课在指导学生的学习方法和培养学生的学习能力方面主要采取以下方法:1、实验探究法:通过实验探究获得知识、培养能力。
2、合作学习法:通过合作探究,培养学生合作互助的团体意识。
五、准备实验用品药品:过氧化氢溶液、二氧化锰、氯化钠、氯酸钾、高锰酸钾、生土豆片等。
仪器:大试管、烧杯、锥形瓶、酒精灯、长颈漏斗、单孔橡皮塞、双孔橡皮塞、导气管、集气瓶、水槽、玻璃片等。
最后我来具体谈谈这一堂课的教学过程:六、教学过程在这节课的教学过程中,我注重突出重点,条理清晰,紧凑合理。

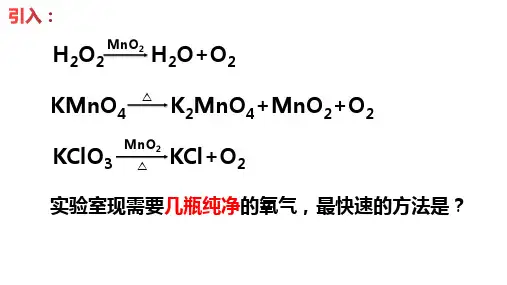
氯酸钾制氧计算变式根据化学方程式进行的计算,是化学计算的重要内容之一。
下面由一道例题谈谈根据化学方程式的简单计算,并对该题变形和拓展,以帮助同学们更好地掌握该部分内容。
例题 把氯酸钾和二氧化锰的混合物15.5 g 放入大试管中加热,充分反应后冷却、称量,剩余固体质量为10.7 g 。
剩余固体中存在哪些物质?各为多少?解析 二氧化锰催化氯酸钾制取氧气,是我们非常熟悉的一个反应。
根据题给信息可知,该反应为“充分反应”,故剩余的固体里没有氯酸钾,只有生成的氯化钾和催化剂二氧化锰。
二氧化锰是催化剂,其质量在化学反应前后不变。
因此,根据质量守恒定律,反应前氯酸钾与反应后氯化钾的质量之差就是氧气的质量。
根据氧气的质量,结合反应的化学方程式可计算出氯化钾的质量,最后求二氧化锰的质量。
答案 根据质量守恒定律可知,生成氧气的质量为:15.5 g-10.7 g=4.8 g 。
设:剩余固体中含氯化钾质量为x 。
二氧化锰的质量为:10.7 g -7.45 g =3.25 g答:剩余固体中含氯化钾的质量为7.45 g ,含二氧化锰的质量为3.25 g 。
点拨 本题是对教材练习题的一个变式,利用的原理和所求的问题是相同的,但给出的反应进行程度不同,本题中明确指出“充分反应”,计算较为简单。
因此,同学们在学习时,要特别重视教材习题的练习和掌握。
根据化学方程式进行计算,关键是找准相关纯净物质量代入计算,当题目中未给出纯净物质量时,我们就应换种思维思考:根据质量守恒定律看物质的总质量是否发生变化,从而进一步分析解题。
变式题 为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5 g 该样品与0.8 g 二氧化锰混合。
加热该混合物t 1时间后(假设杂质不参加反应),冷却,称量剩余固体混合物的质量,重复以上操作,依次称得加热t 1、t 2、t 3、t 4时间后剩余固体的质量,记录数据如下表所示:加热时间 t 1 t 2 t 3 t 4 剩余固体质量/g 2.48 2.41 2.34 2.34请仔细分析实验数据,回答下列问题:(1)在_________时间,该样品中氯酸钾已反应完全。

第三节氧气本节课主要介绍氧气的性质和一类重要的化学反应——化合反应,使学生初步了解物质间的转变,从而为学生学习化合反应、氧化反应等知识打下基础,也激发了学生对学习氧气的制法的迫切愿望,因此本节课起到承前启后的作用。
备课笔记易错提醒:不易溶于水并不是不溶于水,只是溶解的量较少而已。
备课笔记[方法总结]认识气体的物理性质,一般关注四个方面:一是颜色、气味、特别提醒:“光”一般指沸点高的固体物质燃烧产生的现象,“火焰”是气体或沸点低的固体物质或液体物质的蒸气燃烧产生的现象。
[提问]做铁在氧气中燃烧实验时,(1)实验前为什么在瓶底铺一层沙或少备课笔记在实验中,为了防止集气瓶底部炸裂,可在瓶底加少量水或细沙,但若产生一些有害气体,则只能在瓶底加入水等能吸收有害气体的液体,以防止污染空气和对人体造成危害。
备课笔记本节课我们学习了氧气的物理性质和化学性质。
氧气的物理性质:氧气是一种无色、无味的气体,密度比空气略大,不易溶于水,有三态变化。
氧气的化学性质:氧气是一种化学性质比较活泼的气体,在一定条件下能与许多物质发生反应,并放出热量,在化学反应中提供氧,具有氧化性,是常用的氧化剂。
另外,我们通过具体反应的讨论学习了化合反应、氧化反应等概念。
练习与应用(P36)1.验证一瓶无色气体是氧气的简单方法是将带火星的木条放入瓶中,木条复燃,证明瓶中为氧气。
2.分别写出下列物质在氧气中燃烧的文字表达式。
3.选择题4.你家用什么燃料烧水做饭?燃烧过程中你能观察到什么现象?燃料燃烧是不是化学变化?为什么?A.都是化合反应B.生成物都是固体C.都需要点燃D.都是非金属和氧气反应备课笔记课堂延伸:化合反应是初中化学所学的四大基本反应类型之一,氧化反应不属于四种基本反应类型,氧化反应又分为剧烈氧化和缓慢氧化两种。
【解析】化合反应的生成物只有一种,反应物是两种或两种以上,①②符合。
物质与氧气发生的反应属于氧化反应,故反应物中有氧气的反应属于氧化反应,布置作业:完成本课时对应练习,并提醒学生预习下一节的内容。

实验室制取氧气说课稿各位评委,老师们:大家好,我今天说课的内容是实验室制备氧气。
这是义务教育课程标准实验教科书(鲁教版)九年级化学第三单元第三节《性质活泼的氧气》,下面我将从几个方面来谈谈我对这节课的设计思路。
一.教材分析一)教学地位和作用第三单元《我们周围的空气》是初中内容的重要组成部分,这一单元所学知识也与我们的生活息息相关,而其中“性质活泼的氧气”就是我们要仔细研究的内容,本课程是典型的物质制取课,也是学生初次通过化学实验来获得新物质,初次体验科学的探究过程在这之前,学生已经对化学实验基本操作和氧气性质等内容的研究和探究有了一定的知识基础,这就为我们研究氧气的制备作了充分的准备,这节课的研究,也为以后研究其他气体奠定了一定的理论好实践基础。
二)教学目标1.知识与技能:1)、知道氧气的实验室制备方法、收集方法和检查装置气密性的方法。
2)、了解实验室制氧气的步骤及验证氧气的性质。
3)、知道二氧化锰的催化作用。
4)、认识制氧气所需仪器的名称及知道这些仪器的连接和使用方法。
5)、知道实验室收集氧气的方法(排水法和向上排空气法)的原理。
2.过程与方法:1)、通过观看教师的演示实验进步对实验的观察、比较能力。
2)、通过有无催化剂的对比实验学到自然科学研究的一种基本方法(对比法)3)、感悟用分类、对比的研究方法来研究化学的重要作用。
3.情感态度与价值观1)、通过实验探究来激发学生研究的积极性和主动性。
2)、实验初步养成严谨求实的科学态度。
3)、通过对演示实验的观察提高对化学科的兴趣。
三)讲授难点与重点1.重点:实验室制取氧气的制备方法、收集方法和检查气密性的方法。
2.难点:制取氧气的仪器连接和组装,氧气和验满和氧气性子的实验。
二学情分析一>学生情况九年级学生刚刚打仗化学,出格对于化学实验有浓厚的兴趣,通过前面的研究学生初步具备了简朴的实验操纵和观察能力,以是对于氧气的制取会更加进步学生的动手能力和小组协作能力。


加热高锰酸钾制取氧气(说课稿)work Information Technology Company.2020YEAR《加热高锰酸钾制取氧气》说课稿八庙乡初级中学张越各位领导、老师们:晚上好!我今天为大家说课的内容是《加热高锰酸钾制取氧气》,这节课我从教材分析、学情分析、教学目标、教学重难点、教法学法分析、教学准备、教学过程、教学效果预设、板书设计九部分内容进行说课。
一、教材分析《加热高锰酸钾制取氧气》是鲁教版九年级《化学》第四章第三节第一课时的扩展内容,是实验考试的必考内容,同时是义务教育阶段化学课程标准最重要的内容之一。
学习了制氧方法也可以为以后学习制取二氧化碳奠定知识基础。
本课题是气体制备的起始课,是学生对化学实验基本操作的综合应用,能为今后“物质的制备”奠定基础。
通过本节课的学习,学生不仅可以锻炼自己的动手操作能力,还能将重要的知识点铭记于心。
二、学情分析学生通过对教材的学习和活动,对氧气的性质及用途有了较深刻的认识,对氧气产生了浓厚的探究欲望,加之知识和实验技能的储备,学生早已渴望制取一瓶纯净的氧气。
本课题学生第一次学习气体的制备,没有头绪,所以在上周星期四,我已经让学生预习本实验相关步骤和注意事项,并布置了相关任务,为本节课的学习做了充分准备。
三、教学目标(1)知识目标:掌握实验室制氧气的药品、反应原理、仪器装置及操作注意事项。
(2)能力目标:培养学生的观察能力、思维能力、语言表达能力、动手能力。
(3)情感目标:培养学生学习化学的激情,使学生乐学、好学、勤学、会学。
四、教学重点、难点重点:实验室制取氧气的仪器装置、用品、反应原理及操作的注意事项,分解反应。
难点:培养科学的探究方法。
五、教法学法分析为了体现以“学生为主体,教师为主导”的观念,本节课采用了预设知识预习任务、考察预习效果、小组讨论并合作动手实验、老师提示引导相结合的教学方法。
在教学过程中,充分利用学生对相关知识的预习和教师的引导来激发学生的求知欲。



九年级化学制造氧气知识点氧气在化学中扮演着非常重要的角色,它是许多化学反应以及生物过程的必需物质。
在九年级的化学学习中,我们需要了解制造氧气的基本知识。
本文将介绍几种制造氧气的方法以及相关的化学原理。
一、通过分解过氧化氢制造氧气过氧化氢是一种常见的氢氧化合物,其化学式为H2O2。
通过催化剂的作用,过氧化氢可以分解成水和氧气。
化学反应的方程式如下:2H2O2 → 2H2O + O2这种方法制备氧气比较简单,只需要将过氧化氢注入反应瓶中,加入催化剂(例如二氧化锰),就能观察到氧气的产生。
但需要注意的是,过氧化氢是一种具有强氧化性的物质,在使用时要小心避免接触皮肤和眼睛。
二、通过电解水制造氧气电解水是另一种制造氧气的方法,它是利用电能将水分解成氢气和氧气。
化学反应的方程式如下:2H2O → 2H2 + O2在实验中,我们需要准备一个电解槽,将带有电解质(如盐或硫酸)的水注入至槽中,然后用电极通电。
正极(即阳极)会产生氧气,负极(即阴极)会产生氢气。
通过将导管引导到不同容器中,就可以分别收集到氧气和氢气。
三、通过过氧化钾和重铁盐制造氧气过氧化钾和重铁盐反应也可以制备氧气。
化学反应的方程式如下:2KClO3 + 2FeCl2 → 2KCl + 2FeCl3 + 3O2在实验中,我们需要先将过氧化钾和重铁盐混合,然后加热。
反应过程中会产生氧气气体,可以用来进行进一步的实验或观察。
四、通过高温分解金属氧化物制造氧气某些金属氧化物在高温下可以发生分解反应,生成氧气气体。
化学反应的方程式如下:2HgO → 2Hg + O2在实验中,我们需要将金属氧化物(如二氧化汞)加热,并烧结成固体,然后通过加热使其发生分解反应。
利用这种方法制造氧气时需要注意操作安全,避免接触高温器具以及对有毒物质的处理。
五、通过植物光合作用产生氧气在自然界中,氧气主要通过植物的光合作用产生。
光合作用是指植物利用阳光、水和二氧化碳产生氧气和葡萄糖的过程。