专题一:信息型氧化还原反应方程式的书写
- 格式:pptx
- 大小:1.74 MB
- 文档页数:31

高三化学复习——信息型氧化还原反应方程式书写的实例讲解1、向K2MnO4溶液中通入CO2,可制得KMnO4,同时产生黑色沉淀。
2、将Cl2通过二氧化钛和碳粉的混合物,可制得四氯化钛和一种有毒气体3、NH3与NaClO反应可制N2H4;4、向CuCl2溶液中通入一定量的SO2,微热,一段时间后可得CuCl白色沉淀。
离子方程式为5、SO2与KMnO4反应6、Na2SO3与酸性KMnO4反应7、FeCl2溶液中加入NaClO8、FeCO3浊液置于空气中,会出现红褐色沉淀9、K2FeO4强氧化剂,可由FeCl3溶液中加入KClO在强碱条件下制取,离子方程式:10、K2FeO4—Zn可组成碱性电池,则正极电极反应式:11、NaClO与Na2SO3反应离子方程式12、NaClO与NaHSO3反应离子方程式1、3K2MnO4+CO2==2KMNO4+MnO2+K2CO32、TiO2+2C+2Cl2==TiCl4+2CO3、2NH3+NaClO===N2H4+NaCl+H2O4、2Cu2++2Cl-+SO2+H2O==2CuCl+SO42-+4H+5、2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+6、2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O7、6Fe2++3ClO-+3H2O==2Fe(OH)3+4Fe3++3Cl -8、4FeCO3+O2+6H2O==4Fe(OH)3+4CO29、3Fe3++2ClO-+10OH-==3FeO42-+2Cl-+5H2O10、FeO42-+3e-+4H2O==Fe(OH)3+5OH-11、ClO-+SO32-==SO42-+Cl-12、ClO-+HSO3-==SO42-+Cl-+H+。

北大班量身定做卷(一)——信息型氧化还原反应方程式的书写命题人:年级领导签字:【3步法书写氧化还原方程式的步骤】第一步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第二步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式两端的电荷守恒。
第三步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
【练习】根据下列题干信息写出氧化还原反应1、在NaOH的环境中,Cl2与NaI反应,每l mol NaI完全反应转移6 mol电子,写出反应的化学方程式:_____________________________________________________________________2、FeCl3溶液与草酸(H2C2O4)反应,得到澄清溶液,同时生成一种能使石灰水变浑浊的气体,此反应的离子方程式为________________________________________________________________________3、KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。
三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式________________________________________________________________________4、已知:①MnO-4+e-―→MnO2-4(绿色)(强碱性条件)②MnO-4+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式________________________________________________________________________5、[2014·安徽理综,25(4)]ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。


信息型氧化还原反应方程式及离子方程式书写一、氧化还原反应类型的离子方程式的书写核心技巧:1)判断氧化剂、还原剂,再找到氧化剂对应的还原产物和还原剂对应的氧化产物(离子参加反应的直接找出发生反应的离子)2)根据化合价升降守恒配平以上物质的系数3)判定溶液的酸碱性。
若为酸性溶液,可根据电荷守恒,在方程式左边或右边添加适当数目的H+;若为碱性溶液,可根据电荷守恒,在方程式左边或右边添加适当添加适当数目的OH-;若为中性溶液,则只能在方程式的右边添加H+或OH-,使电荷守恒4)根据元素守恒,添加H2O ,配平方程式。
①将SO2气体通入FeCl3(aq)中②将NH3通入次氯酸钠溶液,生成N2H4③过氧化钠固体加入Na2S(aq)中,溶液中出现黄色固体④将双氧水滴加到硫酸亚铁的酸性溶液中⑤NaClO(aq)中滴加NaI(aq),溶液逐渐变为棕黄色⑥Fe(NO3)2溶液中滴加稀硫酸⑦酸性高锰酸钾溶液和浓盐酸混合制氯气(已知反应后Mn元素以+2价离子存在)⑧将铜粉加入稀硫酸和双氧水的混合溶液中,溶液逐渐变蓝二、综合练习⒈.配平下面的化学方程式:⑴□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O⑵□C2O42-+□MnO4-+□H+=□CO2↑+□Mn2++□H2O⑶KIO3+KI+H2SO4=K2SO4+I2+H2O⒉依据题给信息,完成反应。
⑴用高锰酸钾标准溶液滴定双氧水试样来测定H2O2含量:□MnO4-+□H2O2+□H+=□Mn2++□H2O+□⑵次磷酸钠(NaH2PO2)可用于化学镀镍。
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生反应:Ni2+ + H2PO2-+ →Ni + H2PO3-+⑶在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce5+转化为形成Ce(OH)4沉淀而得以分离:□Ce3++□H2O2+□H2O=□Ce(OH)4↓+□⑷FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为。
信息型氧化还原反应方程式书写教学目标:1、理解氧化还原反应的基本原理,能写出较简单的信息型氧化还原反应方程式及电极反应式。
2、掌握正确书写氧化还原反应方程式(含电化学电极反应式)的一般方法和基本技巧。
3、能够准确获取试题所给的有用信息,并与已有知识整合,在分析评价的基础上应用新信息,形成一定的信息素养。
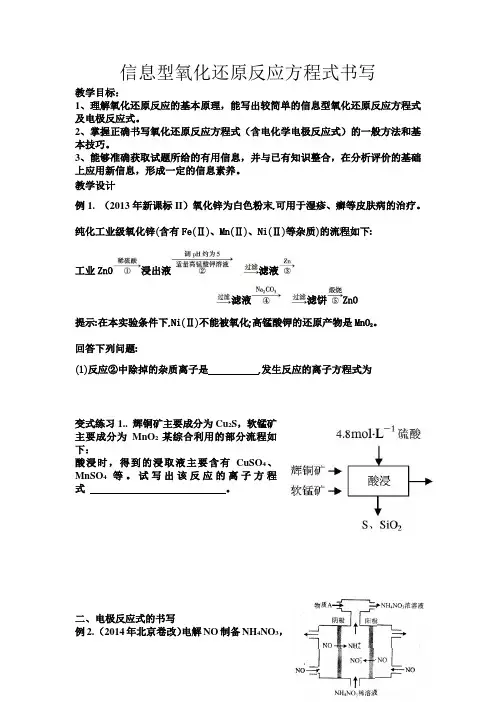
教学设计例1. (2013年新课标II)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程如下:工业ZnO浸出液滤液滤液滤饼ZnO提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO。
2回答下列问题:(1)反应②中除掉的杂质离子是,发生反应的离子方程式为S,软锰矿变式练习1.. 辉铜矿主要成分为Cu主要成分为MnO2某综合利用的部分流程如下:酸浸时,得到的浸取液主要含有CuSO4、MnSO4等。
试写出该反应的离子方程式。
二、电极反应式的书写例2. (2014年北京卷改)电解NO制备NH4NO3,其工作原理如右图所示,阳极反应为阴极反应式为 。
为使电解产物全部转化为NH 4NO 3,需补充物质A ,A 是________,说明理由:________________________________________.变式练习2.(2013北京)通过NOx 传感器可监测NO x的含量,其工作原理示意图如下:①Pt 电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO 电极的电极反应式:变式练习 3. 以甲醇作为燃料制成的燃料电池结构示意图如图所示,该电池的负极反应物为 。
变式练习4.尿素燃料电池结构如下图所示。
其工作时负极电极反应式可表示为 。
课后巩固练习:1.(2014课标II )(1)PbO 2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 _ _ 。
(2)PbO 2可由PbO 与次氯酸钠溶液反应制得,反应的离子方程式为_ _;PbO2也可以通过石墨为电极。
信 息 型 氧 化 还 原 反 应 方 程 式 的 书 写教学目标:掌握最小公倍数法对氧化还原反应进行配平,初步掌握缺项配平,逆向配平等方法。
能根据经验和信息书写出陌生的氧化还原反应。
一、知识储备1 .填写课本中常见氧化还原反应体系及其对应产物。
2、氧化还原反应方程式的基本配平方法 配平方法:最小公倍数法(本质:电子得失守恒) ①标好价列变化 ②确定基准物质 ③找岀升降数目 ④找最小公倍数 ⑤质量电荷守恒 二、信息型氧化还原反应方程式的书写1、平铺直述型例1、KMnO 4能与热的稀硫酸酸化的 Na 2C 2O 4反应,生成Mn 2+和CO 2,该反应的化学方程 式是 2KMnO 4+ 8H 2SO 4 + 5Na 2C 2O 4===2MnS04 + K 2SO 4 + 10CO 2f + 5Na 2SO 4 + 8H 2O 。
变式:H 3PO 2的工业制法是:将白磷 (P 4)与Ba(OH) 2溶液反应生成 PH 3气体和Ba(H 2PO 2)2,后 者再与H 2SO 4反应。
写岀白磷与歧化反应一一倒配法2、排列组合型 例2、某反应中反应物与生成物有 已知mol KBrO 3在反应中得到 式答案 Br 2 4H 2SO 4 + 5AsH 3 + 8KBrO3===5H 3ASO 4 + 4Br 2 + 4K 2SO 4 + 4H 2O方法提炼:1、根据信息或已有经验,找岀氧化剂、还原剂,氧化产物、还原产物马寅初中学 丁汉英Ba(OH) 2溶液反应的化学方程式A S H 3、H 2SO 4、KBrO 3、K 2SO 4、H 3ASO 4和一种未知物 x 。
mol e 「生成X ,则x 的化学式 _,试写岀该反应的化学方程2、配平(1 )、(2012高考江苏卷)H 2Q 与KMnO 反应的离子方程式如下: 2MnO + 5H2O+ 6H =2M n + + 5O4 + 8H 2O上述反应若不加稀硫酸酸化,MnO 被还原为MnO 2,其离子方程式为2MnO- + 3H2Q = 2MnCU + 3Q f + 2OH + 2H2O知识链接:KMnO 的氧化性随pH 的减小而增大,在酸性介质中还原产物是 MrT ;在中性或碱性介质中还原产物主要是MnO(2)、溶解在水中的 O 2在碱性条件下可以将 Mn 2+氧化成MnO(OH) 2,反应的离子方程式为 2Mn 才 + O 2+ 4OH 「===2MnO(OH) 2,而「可以将 MnO(OH) 2还原成 Mn ",I -被氧 化成12,该反应的离子方程式为Mn O(OH) 2+ 2「+ 4H 1===M n 2*+I 2+ 3H 2O 。




关于信息型氧化还原反应方程式的书写一、平铺直述型氧化还原反应方程式的书写1.根据信息书写相应的反应方程式:①硫化氢具有还原性,可以和许多氧化剂反应。
在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式: __。
②已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。
写出Cr2O2-7与FeSO4溶液在酸性条件下反应的离子方程式: ___。
③NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________________________________________________________________。
④鼓泡反应器中通入含有SO2和NO x的烟气,采用NaClO2溶液(在碱性中较稳定)作为吸收剂可同时对烟气进行脱硫、脱硝,请写出用NaClO2溶液将烟气中NO转化成NO-3的离子方程式:_________________________________________________________________________。
⑤KMnO4氧化酸性废水中Mn2+生成MnO2的离子方程式为 ______。
答案:① 5H2S+2KMnO4+3H2SO4===K2SO4+2MnSO4+8H2O+5S↓(2分)② Cr2O2-7+6Fe2++14H+===2Cr3++6Fe3++7H2O(2分)③ 4NaClO+4Ag+2H2O===4AgCl+4NaOH+O2↑(2分)④ 4NO+3ClO-2+4OH-===4NO-3+3Cl-+2H2O (2分)⑤ 3Mn2++2MnO-4+2H2O===5MnO2↓+4H+(2分)二.推断型氧化还原反应方程式的书写2.书写下列反应方程式:①PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 _。
②向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________________________________________。
