化工原理实验—吸收
- 格式:doc
- 大小:104.50 KB
- 文档页数:10


氧解析-化工原理-吸收-实验报告一、实验目的1. 学习氧解析法的基本原理和实验操作。
2. 了解化学吸收法的原理及其在氧解析中的应用。
3. 掌握氧解析实验中的基本操作技能。
二、实验原理1.氧解析原理氧解析的原理是利用红色五价铁离子与氧气发生氧化反应的原理,通过测定铁离子还原的电位差来确定氧气的含量。
具体反应式如下:Fe2+ + 1/4O2 + 2H+ → Fe3+ + 1/2H2O由于1mol电子交换可产生1.23V电势,通过测定铁离子还原电位和标准电极电位的差值,即可得到氧气的含量。
2.化学吸收原理化学吸收法是通过某种吸收剂与被测气体的化学反应来去除被测气体中的某种成分的方法。
吸收剂可选择性地吸收被测气体中的某种成分,然后通过吸收前后吸收剂的质量差来确定该成分的含量。
在氧解析中,选择NaOH作为吸收剂,用于吸收氧气。
三、实验步骤1. 洗涤仪器:将氧解析仪、吸收瓶、饱和盐水瓶和试管用酒精清洗干净。
2. 理顺连接线:将氧解析仪与吸收瓶通过橡胶软管连接,吸收瓶与饱和盐水瓶通过橡胶软管连接,饱和盐水瓶与试管通过橡胶软管连接。
3. 加入吸收剂:将20mL的0.1mol/L NaOH溶液倒入吸收瓶中。
4. 预处理:将氧解析仪的样品室和参比室用稀硝酸洗涤干净,然后用蒸馏水冲洗干净。
5. 校准:用样品室中的氧气校准氧解析仪,通过调节样品室中的Hg电极电势,使得氧解析仪显示的氧气浓度与标准气体浓度一致。
6. 吸氧:将被测气体(氮气与氧气混合气体)通过饱和盐水瓶并以一定流速进入吸收瓶,其中氧气被NaOH吸收,剩余的氮气流经氧解析仪,接着通过排气口排出实验室。
7. 计算:通过测定吸收剂的重量差和转化率计算氧气的含量。
四、实验结果与分析实验中测得的吸收剂重量差为0.23g,转化率为95%,因此氧气的含量为100%-95%=5%。
五、实验结论本实验通过氧解析法和化学吸收法,成功测定了氧气的含量。
实验结果表明本实验的测量结果较为准确,具有较高的稳定性和重复性,可有效满足实际应用需求。

1、吸收是根据混合气体中各组分()不同而将混合()进行分离的一种典型的单元操作2、吸收是分离()的单元操作。
3、吸收操作的目的(),依据是()4、吸收操作的应用:5、填料塔主要构件:6、常用填料:7、填料塔内提供气液两相接触的场所的是()。
8、填料应具有较()的(),以增大塔内传质面积。
9、吸收塔内填装一定高度的料层,作用是为气液两相提供足够的()10、对吸收操作影响较大的填料特性()11、常见的连续接触式的气液传质设备是()塔,塔内()为分散相,()为连续相,塔内顶部应设()装置,中部应设()装置。
12、吸收速度取决于(),因此,要提高气-液两流体相对运动速率,可以()来增大吸收速率将(),13、对一定操作条件下的填料吸收塔,如将填料层增高一些,则该塔的HOGN将()OG14、填料层高度的计算将要涉及()这三种关系式的应用15、在选取吸收剂时,首先要考虑是是所选用的吸收剂必须有()16、实验室用水吸收空气中的20C,基本属于()控制,其气膜中的浓度梯度()液膜中的浓度梯度,气膜阻力()液膜阻力17、易溶气体吸收过程,气膜传质阻力()液膜传质阻力。
其他条件不变,入口气量减少,气相总传质单元高度将();出塔气体组成y2将()18、在吸收操作中()压力和()湿度可提高气体的溶解度,有利于吸收。
19、易溶气体溶液上方的分压(),难容气体溶液上方的分压(),只要组分在气相中的分压()液相中该组分的平衡分压,吸收就会继续进行。
20、多组分吸收中的“关键组分”是指操作中必须保证其()达到预定指标21、对接近常压的溶质浓度低的气液平衡系统,当总压增大时,亨利系数E(),相平衡常数m(),溶解度系数H()。
22、由于吸收过程中气相溶质分压总是()溶质的平衡分压,因此吸收操作线总在平衡线的()。
增加吸收剂用量,操作线的斜率(),则操作线向()平衡线的方向偏移,吸收过程推动力()此斜率又称为()。
23、某气体用水吸收时,在一定浓度范围内,其气液平衡线和操作线均为直线,其平衡线的斜率可用()常数表示,而操作线的斜率可用()表示。



吸收的概念化工原理
吸收是一种常见的分离和纯化过程,它通过将一种物质(吸收剂)与另一种物质(被吸收物质)接触,使被吸收物质从气态或液态转移到吸收剂中。
吸收的概念化工原理如下:
1. 物质接触:吸收剂与被吸收物质之间需要有足够的接触面积,以便有效地传递质量和能量。
2. 传质:被吸收物质通过物质界面的传质过程,从气态或液态相转移到吸收剂中。
传质可以通过扩散、对流和反应来实现。
3. 反应:在吸收过程中,被吸收物质与吸收剂之间可能发生化学反应。
这些反应可以改变被吸收物质的化学性质,从而实现分离和纯化。
4. 热量传递:吸收过程可能涉及热量的传递,特别是在吸收剂中发生吸热或放热反应时。
热量的传递可以影响吸收过程的效率和控制。
5. 设备设计:吸收过程需要适当的设备来实现物质接触、传质、反应和热量传递。
吸收塔是常用的吸收设备,它通常由填料或板式结构组成,以提供大量的接触表面积。
吸收在许多工业和环境应用中都有广泛的应用,例如气体净化、溶剂回收、气体吸附等。
了解吸收的概念化工原理对于优化吸收过程的设计和操作至关重要。

吸收的实验原理吸收实验原理是指通过测量溶液中溶质对溶剂的吸收程度来确定溶质浓度的方法。
吸收实验原理基于光的吸收特性,通过比较吸收物质对光的吸收能力与标准样品的吸收能力之间的差别来确定溶质浓度。
光吸收是一种物质与光相互作用的现象,当光通过物质时,根据物质的性质,可能会发生无色的穿透、反射或吸收。
在吸收实验中,通常使用的是可见光或紫外光源。
可见光范围内的波长为400-700纳米,紫外光波长则更短,通常为200-400纳米。
光吸收的基本原理是根据物质与光的相互作用,物质吸收光的能力与其浓度成正比。
当光通过溶液中的溶质时,溶质分子会吸收或散射光的一部分能量,造成透射光的强度减弱。
透射率可以用来衡量溶质对光的吸收程度,透射率越低,表示溶质浓度越高,吸收能力越强。
贝尔-朗伯定律描述了光吸收与物质浓度之间的关系。
根据该定律,溶液中的溶质浓度与溶液的吸光度(或吸光值)之间存在着线性关系。
吸光度的定义是表示样品光吸收的相对大小,可以通过测量入射光和透射光的强度来计算得到。
吸光度值越高,表示溶质浓度越高,溶液对光的吸收能力越强。
在吸收实验中,一般会借助分光光度计或吸光光度计来测量样品的吸光度。
这些仪器可以通过将入射光和透射光之间的光强度差值转化为吸光度的数值。
具体操作时,首先需要设置一个基准样品,即已知浓度的溶液或纯溶剂,用来校准光度计。
然后,按照一系列浓度递增或递减的样品进行测量。
测量结束后,可以根据基准样品的吸光度和已知浓度之间的对应关系,来计算其他样品的浓度。
吸收实验也可以借助于光谱分析来确定溶质浓度。
光谱分析是一种通过测量物质在各个波长下的吸光度来研究其性质的方法。
通过绘制吸光度与波长之间的曲线,可以确定溶质的吸收峰位和吸收峰高度。
吸收峰高度与溶质浓度成正比,可以通过测定吸收峰高度与浓度之间的标准曲线来计算样品浓度。
总之,吸收实验原理基于物质对光的吸收特性,通过测量吸光度或吸收峰的高度来确定溶质浓度。
吸光度或吸收峰高度与溶液中溶质的浓度成正比,这种比例关系可以通过标准曲线或已知浓度的基准样品来建立。


填料吸收塔的操作及吸收传质系数的测定一、实验目的(1)了解填料吸收塔的结构和流程;(2)了解吸收剂进口条件的变化对吸收操作结果的影响;(3)掌握吸收总传质系数的测定方法.二、基本原理1.吸收速率方程式吸收传质速率由吸收速率方程式决定: Na = Ky A Δym式中 Ky 为气相总传质系数,mol/m2*h;A 为填料的有效接触面积,m2;Δym 为塔顶、塔底气相平均推动力。
a 为填料的有效比表面积,m2/m3;V 为填料层堆积体积, m3 ;Kya 为气相总容积吸收传质.系数,mol/m3*h。
从上式可看出,吸收过程传质速率主要由两个参数决定:Δym为过程的传质推动力,Kya的倒数1/Kya表征过程的传质阻力。
2.填料吸收塔的操作吸收操作的结果最终表现在出口气体的组成y2上,或组分的回收率η上。
在低浓度气体吸收时,回收率可近似用下式计算:η = (y1 - y2)/y1吸收塔的气体进口条件是由前一工序决定的,一般认为稳定不变。
控制和调节吸收操作结果的操作变量是吸收剂的进口条件:流率 L 、温度 t 和浓度 x2 这三个要素。
由吸收分析可知,改变吸收剂用量是对吸收过程进行调节的最常用方法,当气体流率 G 不变时,增加吸收剂流率,吸收速率η增加,溶质吸收量增加,出口气体的组成y2随着减小,回收率η增大。
当液相阻力较小时,增加液体的流量,总传质系数变化较小或基本不变,溶质吸收量的增加主要是由于传质平均推动力Δym的增大而引起,即此时吸收过程的调节主要靠传质推动力的变化。
但当液相阻力较大时,增加液体的流量,可明显降低传质阻力,总传质系数大幅度增加,而平均推动力却有可能减小(视调节前操作工况的不同而不同),但总的结果使传质速率增大,溶质吸收量增大。
吸收剂入口温度对吸收过程的影响也甚大,也是控制和调节吸收操作的一个重要因素。
降低吸收剂的温度,使气体的溶解度增大,相平衡常数减小。
对于液膜控制的吸收过程,降低操作温度,吸收过程的阻力随之减小,使吸收效果变好,y2降低,但平均推动力Δym或许会有所减小。

化工原理实验报告_吸收
实验名称:吸收实验
实验目的:
1. 掌握吸收塔的操作方法;
2. 熟悉吸收塔的工作原理;
3. 了解吸收塔在化工过程中的应用。
实验原理:
吸收是指将气体中的某种成分溶解在液体中的过程。
在工业生产中,吸收常用于气体分离和净化。
吸收塔是常用的吸收装置,常见的吸收塔有塔板吸收塔和填料吸收塔两种类型。
实验仪器及材料:
1. 塔式吸收塔;
2. 气源;
3. 转子流量计;
4. 吸收液;
5. 相应的连接管道。
实验步骤:
1. 将吸收液倒入吸收塔中,注意液位不要过高;
2. 连接气源至吸收塔的底部,控制气源流量;
3. 打开气源,调节气源流量;
4. 连接转子流量计并调节流量;
5. 观察吸收液的变化并记录实验数据。
实验数据记录和分析:
根据实验步骤所得到的数据,可以计算出气体吸收的效率和吸收塔的传质系数。
根据数据分析,可以得到吸收塔的工作效果和适用范围。
实验结果和结论:
通过实验可以得到气体吸收的效率和吸收塔的传质系数,进而评估吸收塔的性能。
根据实验结果,可以判断吸收塔是否适用于化工过程中的气体分离和净化。
根据实验结果和结论,可以调整吸收塔的操作方法和参数,进一步优化吸收塔的性能。
实验注意事项:
1. 操作吸收塔时需注意安全,避免发生意外事故;
2. 控制气源流量时需谨慎,避免发生压力过大或流量过大的情况;
3. 实验结束后,及时清洗吸收塔和相关设备。
第六章 吸收【例6-1】 总压为101.325kPa 、温度为20℃时,1000kg 水中溶解15kg NH 3,此时溶液上方气相中NH 3的平衡分压为2.266kPa 。
试求此时之溶解度系数H 、亨利系数E 、相平衡常数m 。
解:首先将此气液相组成换算为y 与x 。
NH 3的摩尔质量为17kg/kmol ,溶液的量为15kg NH 3与1000kg 水之和。
故0156.018/100017/1517/15=+=+==B A A A n n n n n x022403251012662...P p y *A *===436.10156.00224.0*===x y m由式(6-11) E =P ·m =101.325×1.436=145.5kPa或者由式(6-1) 3.1450156.0266.2*===x p E A kPa溶剂水的密度ρs =1000kg/m 3,摩尔质量M s =18kg/kmol ,由式(6-10)计算H382.0183.1451000=⨯=≈s s EM H ρkmol/(m 3·kPa )H 值也可直接由式6-2算出,溶液中NH 3的浓度为()()869.01000/10001517/15//=+=+==s s A A A A A m m M m Vn c ρkmol/m 3所以 383.0266.2869.0*===A A p c H kmol/(m 3·kPa )【例6-2】 在20℃及101.325kPa 下CO 2与空气的混合物缓慢地沿Na 2CO 3溶液液面流过,空气不溶于Na 2CO 3溶液。
CO 2透过厚1mm 的静止空气层扩散到Na 2CO 3溶液中。
气体中CO 2的摩尔分数为0.2。
在Na 2CO 3溶液面上,CO 2被迅速吸收,故相界面上CO 2的浓度极小,可忽略不计。
CO 2在空气中20℃时的扩散系数D 为0.18cm 2/s 。
化工原理吸收吸收是一种常见而重要的分离技术,在化工过程中广泛应用。
吸收是利用溶剂以物理或化学方式从气体、液体或固体中分离出物质的过程。
它在化工领域中的应用十分广泛,涵盖了多个行业,如石油化工、化肥、合成材料等。
吸收的基本原理是根据物质的相互作用力,并通过在溶剂中形成物质被吸附、溶解或反应的方式来实现物质的分离和纯化。
吸收过程一般分为两个阶段:传质和相平衡。
传质过程指的是溶质从气体、液体或固体相向吸收剂的传递过程。
相平衡指的是溶质在吸收剂中的浓度达到平衡状态。
吸收的过程可以通过多种方式实现。
其中最常见的是气体吸收。
气体吸收是将气态物质通过接触与吸收剂接触,然后进入吸收剂中的过程。
气体吸收的过程中,常使用物理吸收和化学吸收的方式进行。
物理吸收主要是利用溶质分子在吸收剂中溶解的溶解度差异来进行分离。
根据溶解度和吸收剂的选择,物理吸收一般具有以下几个特点:易于操作、能耗较低、对条件要求不高、纯化程度较低。
常用的吸收剂包括水、有机溶剂和溶液。
化学吸收则是通过物质在吸收剂中发生化学反应,使溶质与吸收剂发生反应,产生新的物质,在产生反应的同时将溶质分离出来。
化学吸收一般具有下面几个特点:通过反应能够得到较高的吸收效果;能够得到较高纯度的产品;操作较复杂,条件苛刻;产生的副产物难以处理。
常用的吸收剂包括酸、碱、氧化剂等。
化学吸收和物理吸收在实际应用中往往结合使用,通过化学反应实现更高效的物质分离。
在工业生产中,常常使用吸收塔进行吸收操作。
吸收塔是一个用于进行气体吸收的设备,一般由填料、进料与出料管道以及循环泵组成。
填料可以增加界面面积,提高吸收效果。
除了气体吸收外,液体吸收也是常见的一种吸收形式。
液体吸收一般是将液态物质通过接触与吸收剂接触并吸收的过程。
液体吸收主要用于分离和纯化液态物质,常见的应用有酸碱中和、有机溶剂回收等。
总之,吸收是一种常用的化工分离技术,通过物理吸收和化学吸收的方式,实现物质的分离和纯化。
吸收实验一、实验目的1、了解填料吸收塔的一般结构和工业吸收过程流程;2、掌握吸收总传质系数K a的测定方法;x3、考察吸收剂进口条件的变化对吸收效果的影响;4、了解处理量变化对吸收效果的影响。
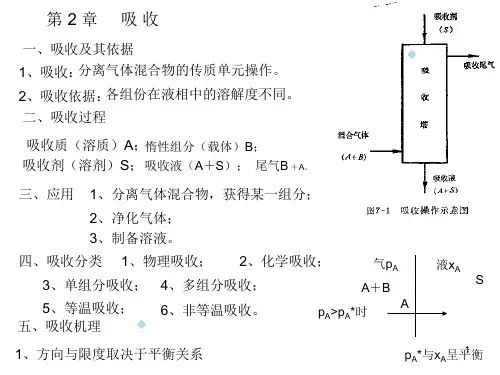
二、实验原理1、概述吸收过程是依据气相中各溶质组分在液相中的溶解度不同而分离气体混合物的单元操作。
在化学工业中吸收操作广泛应用于气体原料净化、有用组分的回收、产品制取和废气治理等方面。
在吸收研究过程中,一般可分为对吸收过程本身的特点或规律进行研究和对吸收设备进行开发研究两个方向。
前者的研究内容包括吸收剂的选择、确定因影响吸收过程的因素、测定吸收速率等,研究的结果可为吸收工艺设计提供依据,或为过程的改进及强化指出方向;后者研究的重点为开发新型高效的吸收设备,如新型高效填料、新型塔板结构等。
吸收通常在塔设备内进行,工业上尤其以填料塔用的普遍。
填料塔一般由以K a下几部分构成:(1)圆筒壳体;(2)填料;(3)支撑板;(4)液体预分布装置;(5) x液体再分布器;(6)捕沫装置;(7)进、出口接管等等。
其中,塔内放置的专用填料作为气液接触的媒介,其作用是使从塔顶流下的流体沿填料表面散布成大面积的液膜,并使从塔底上升的气体增强湍动,从而为气液接触传质提供良好条件。
液体预分布装置的作用是使得液体在塔内有良好的均匀分布。
而液体在从塔顶向下流动的过程中,由于靠近塔壁处的空隙大,流体阻力小,液体有逐渐向塔壁处汇集的趋向,从而使液体分布变差。
液体再分布器的作用是将靠近塔壁处的液体收集后再重新分布。
填料是填料吸收塔最重要的部分。
对于工业填料,按照其结构和形状,可以分为颗粒填料和规整填料两大类。
其中,颗粒填料是一粒粒的具有一定几何形状和尺寸的填料颗粒体,一般以散装(乱堆)的方式堆积在塔内。
常见的大颗粒填料有拉西环、鲍尔环、阶梯环、弧鞍环、矩鞍环等等。
填料等材质可以使金属、塑料、陶瓷等。
规整填料是由许多具有相同几何形状的填料单元组成,以整砌的方式装填在塔内。
化工原理吸收
化工原理中的吸收操作是一种常见的气体和液体分离技术。
通过将气体溶解在液体中,可以有效地将气体成分从气相转移到液相中。
吸收过程的基本原理是利用液体对气体的亲和力来实现分离。
通常,吸收塔中的液体称为溶液或吸收液,而气体称为被吸收物质或吸收剂。
在吸收过程中,气体在吸收液中的分子间发生物理或化学吸附,从而被有效地捕集和固定在液体中。
当溶液饱和或达到一定浓度时,吸收过程结束。
吸收操作常用于以下方面:
1. 气体净化:吸收操作可以去除气体中的污染物质,如二氧化硫、氨气等。
通过选择适当的吸收剂和调整操作条件,可以有效地将这些有害物质从气体中去除。
2. 气体回收:吸收操作可用于回收有用气体。
例如,在石油炼制过程中,吸收操作常用于回收烃类气体或气体中的有机物。
3. 气体分离:吸收操作可以实现气体的分离和回收。
根据气体在吸收液中的溶解度差异,可以将混合气体分离成不同组分的吸收器。
吸收操作的关键参数包括吸收剂的选择、操作温度、压力、气体流量和溶液流量等。
合理地选择和控制这些参数可以提高吸收操作的效果和经济性。
总之,吸收操作是一种重要的化工分离技术,可用于气体净化、
气体回收和气体分离等应用领域。
通过合理选择吸收剂和调整操作条件,可以实现高效、经济的气体和液体分离过程。
化工原理实验—吸收1. 引言吸收是化工领域中常见的物质分离和净化方法之一。
它通过将气体或液体中的有害或有用成分吸附到溶液或固体表面上来实现分离和净化的目的。
在本实验中,我们将学习和探索吸收的基本原理和应用。
2. 实验目的本实验的主要目的是通过实验操作和数据分析,加深对吸收原理的理解,掌握吸收过程中的计算和分析方法,并了解吸收在化工工程中的应用。
3. 实验原理吸收是指气体或液体中的溶质在吸收剂(例如溶液或固体)中被吸附或溶解的过程。
吸收剂可以选择根据目标溶质的特性,吸附剂的选择要考虑化学亲和力、溶解度、扩散速率等因素。
在吸收过程中,传质是一个重要的因素。
传质可以通过质量传递和动量传递来实现。
质量传递包括分子扩散、对流传质和表面吸附等。
動量传递則以氣體相、液體相間的質量轉移的能力來表現。
吸收实验可以使用装置,如吸收柱或喷淋塔,为气体和液体之间的接触提供更大的界面积。
此外,经过精确设计和调整,吸收装置可以提高传质效率,实现高效的吸收效果。
4. 实验步骤步骤一:准备工作•确保所有实验设备和试剂已准备齐全。
•检查实验装置是否正常,无泄漏和损坏。
步骤二:实验装置的组装和调整•根据吸收实验的要求,安装吸收柱或喷淋塔。
•调整气体和液体的流量控制,以确保适当的接触和传质效率。
步骤三:实验操作•启动气体和液体的进料系统,调整流量。
•收集样品以进行后续分析,记录有关流量、温度、压力等参数的数据。
步骤四:数据分析•根据收集的样品数据,计算吸收效率、传质系数等参数。
•对数据进行统计和图表分析,以便进行实验结果的评估和比较。
5. 实验注意事项•在实验操作过程中,要注意设备和试剂的安全使用。
•在实验前要明确吸收剂和溶质的性质,并根据需要进行必要的预处理。
•实验过程中要注意将气体和液体的流速和温度适当控制,以保证实验结果的准确性。
6. 实验结果与讨论根据实验数据进行分析后,我们可以得到吸收效率和传质系数等参数的计算结果。
对于不同的吸收剂和溶质,我们可以根据实验结果评估其吸附和溶解的效果,并对吸收过程中的传质机制进行讨论。
填料吸收塔的操作及吸收传质系数的测定
一、实验目的
1.了解填料吸收塔的结构和流程;
2.了解吸收剂进口条件的变化对吸收操作结果的影响; 3.掌握吸收总传质系数K y a 的测定方法 4. 学会使用GC
二、实验原理
吸收操作是分离气体混合物的方法之一,在实际操作过程中往往同时具有净化与回收双重目的。
因而,气体出口浓度y 2是度量该吸收塔性能的重要指标,但影响y 2的因素很多,因为吸收传质速率N A 由吸收速率方程式决定。
(一). 吸收速率方程式:
吸收传质速率由吸收速率方程决定 :
m y A y aV K N ∆=填 或 m y A y A K N ∆= 式中: Ky 气相总传系数,mol/; A 填料的有效接触面积,m 2; Δy m 塔顶、塔底气相平均推动力, V 填 填料层堆积体积,m 3;
K y a 气相总容积吸收传质系数,mol/。
从前所述可知,N A 的大小既与设备因素有关,又有操作因素有关。
(二).影响因素: 1.设备因素:
V 填与填料层高度H 、填料特性及放置方式有关。
然而,一旦填料塔制成,V 填就为一定值。
2.操作因素:
a .气相总容积吸收传质系数K y a
根据双膜理论,在一定的气温下,吸收总容积吸收传质系数K y a 可表示成:
a
k m a k a K x y y +=11 又有文献可知:a y G A a k ⋅=和b x L B a k ⋅=,综合可得b a y L G C a K ⋅=,显然K y a 与气体流量及液体流量均有密切关系。
比较a 、b 大小,可讨论气膜控制或液膜控制。
b .气相平均推动力Δy m
将操作线方程为:22)(y x x G
L
y +-=
的吸收操作线和平衡线方程为:y =mx 的平衡线在方格纸上作图,从图5-1中可得知: 2
12
1ln y y y y y m ∆∆∆-∆=
∆
图5-1 吸收操作线和平衡线
其中 ;11*1
11mx y y y y -=-=∆,22*222mx y y y y -=-=∆,另外,从图5-1中还可看出,该塔是塔顶接近平衡。
(三). 吸收塔的操作和调节:
吸收操作的结果最终表现在出口气体的组成y 2上,或组分的回收率η上。
在低浓度气体吸收时,回收率η可近似用下式计算:
1
21211y y
y y y -=-=
η 吸收塔的气体进口条件是由前一工序决定的,控制和调节吸收操作结果的是吸收剂的进口条件:流率L 、温度t 、浓度x 2三个因素。
由吸收分析可知,改变吸收剂用量是对吸收过程进行调节的最常用方法,当气体流率G 不变时,增加吸收剂流率,吸收速率N A 增加,溶质吸收量L 增加,那么出口气体的组成y 2减小,回收率η增大。
当液相阻力较小时,增加液体的流量,传质总系数K y a 变化较小或基本不变,溶质吸收量的增加主要是由于传质平均推动力Δy m 的增大而引起,即此时吸收过程的调节主要靠传质推动力的变化。
当液相阻力较大时增加液体的流量。
传质系数K y a 大幅度增加,而平均推动力可能减小,但总的结果使传质速率N A 增大,溶质吸收量增大。
吸收剂入口温度对吸收过程影响也甚大,也是控制和调节吸收操作的一个重要因素。
降低吸收剂的温度,使气体的溶解度增大,相平衡常数减小。
对于液膜控制的吸收过程,降低操作温度,吸收过程的阻力
a
k m
a K x y ≈1将随之减小,结果使吸收效果变好,y 2降低,而平均推动力Δy m 或许会减小。
对于气相控制的吸收过程,降低操作温度,过程阻力
a
k
a
K
y
y
1
1
不变.但平
均推动力Δy m增大,吸收效果同样将变好。
总之,吸收剂温度的降低,改变了相平衡常数,对过程阻力及过程推动力都产生影响,其总的结果使吸收效果变好,吸收过程的回收率增加。
吸收剂进口浓度x2是控制和调节吸收效果的又一重要因素。
吸收剂进口浓度的降低,液相进口处的推动的增大,全塔平均推动力也将随之增大而有利于吸收过程回收率的提高。
应当注意,当气液两相在塔底接近平衡(L/G<m)(见图5-2a)欲降低y2,提高回收率,用增加吸收剂用量的方法更有效。
但是当气液两相在塔顶接近平衡时(L/G>m)(见图5-2b)提高吸收剂用量,即增大L/G并不能使y2明显的降低,只有用降低吸收剂入塔浓度x2才是有效的。
a b
图5 - 2 L/G大小对操作的影响
三、实验要点
1.单元操作----- 吸收单元操作的特点;回收率η的影响因素;
2.实验结果----- 双膜理论、分析吸收过程属于气膜控制或液膜控
制;
3.实验测量----- 气体转子流量计的读数以及校正;
4.实验流程----- 液泛现象及预防,液封的作用及控制;
5.实验设备----- 填料吸收塔的结构及操作及填料介绍。
四、实验装置示意图及流程
五、实验步骤
(一).设备:
本实验装置是空气―丙酮混合气―水吸收系统,吸收塔为填料吸收塔,气体是经定值器将压力恒定的室温空气,进入丙酮容器鼓泡而出,得到的丙酮已达饱和的混合气,吸收剂为自来水,用色谱分析的方法,测定混合气进口浓度y1及混合气出口浓度y2。
(二).测试准备:
1.接通气路,打开水流量计开关,再打开定值器开关,将压力恒定在左右,然后,打开气体转子流量计,把水和气的转子流量计调节至测试时的最大值,仔细检查设备是否有漏液、液泛等不正常现象,如果一切正常,即可开始调试。
2.测试:
在上面的步骤完成后,用分别改变水流量、空气流量(均由小至大)、及水温(升高)的方法,测数组数据。
每改变一次水流量或空气流量,均需间隔数分钟取样,或出口水温基本恒定。
取样时,先取y1再取y2。
3. 注意事项:
气体流量不能超过600 L/h,液体流量不能超过7L/h,否则有可能液泛。
液封的液位高低由后面的阀门控制。
六、实验操作原则及内容
(一).实验操作原则:
1.先开水的开关,后开气的开关,并测量空气的温度。
2.y1每次都要测量,且要先测y2,后测y1,防止影响吸收的平衡。
3.注意控制液封的水位,且要防止液泛。
4.加热温度要小于50℃,。
(电压95伏左右)
5.改变控制条件时,要经过10 ~ 15 min时间稳定。
(二).实验内容:
1.在空气流量恒定条件下,改变清水流量,测定气体进出浓度y1、y2,计算组分回收率η,传质推动力面Δy m和传质系数K y a。
2.在清水流量恒定条件下,改变空气流量,测定气体进出口浓度y1、y2,计算组分回收率η,传质推动力面Δy m和传质系数K y a。
3.在空气流量和清水流量恒定条件下,改变清水温度,测定气体进出口浓度y1、y2,计算组分回收率η,传质推动力面Δy m和传质系数K y a。
七、实验数据记录及数据处理
(一). 设备参数:
填料:瓷质拉西环;气液接触方式:气~ 液逆流;
(二). 操作参数:
定值器压力:( 表压)
(三).原始数据记录:
1.常数:
填料塔直径D:40 mm;填料塔高度H:220 mm;
色谱仪系数:;室温:10℃;气压:
2.实验数据记录:
(四)计算结果
八、实验数据处理中注意事项说明:
1.气体流量计在下使用,与气体流量计标定时的状态不同,故需校正: 0
0PT T
P G G N
= 2.吸收剂的进口温度由半导体温度计测得,需计算全塔平均温度,来查得各组的m 值。
全塔平均温度为: 2
出
进t t t +=
3.色谱仪上读得的峰面积正比于取样气相浓度,进出口峰面积之比,等于气体进出口浓度y 1, y 2之比。
4. 丙酮的安托因方程系数 t C B
A lgP +-
=
P :mmHg A :: C :
t :℃ (5~45℃)
九、实验数据处理结果的讨论及要求
1.在空气流量恒定条件下,改变清水流量,讨论组分回收率η,传质推动力面Δy m 和传质系数K y a 的变化规律。
2.在清水流量恒定条件下,改变空气流量,讨论组分回收率η,传质推动力面Δy m 和传质系数K y a 的变化规律。
3.从实验数据分析水吸收丙酮是气膜控制还是液膜控制,还是两者兼而有之。
十、思考题
1.从传质推动力和传质阻力两方面分析吸收剂流量和吸收温度对吸收过程的影响
2.从实验数据分析水吸收丙酮是气膜控制还是液膜控制,还是两者兼而有之
3.填料吸收塔塔底为什么必须有液封装置,液封装置是如何设计的。
4.将液体丙酮混入空气中,除实验装置鼓泡器中用到的方法外,还可
有哪几种。