溶液表面吸附量的测定.
- 格式:pdf
- 大小:206.18 KB
- 文档页数:7

最大气泡压力法测量溶液中的吸附作用和表面张力摘要:本实验采用最大气泡法测量液体的表面张力。
通过测量不同浓度下正丙醇的表面张力,计算吸附量,求出正丙醇分子的横截面积。
并探讨了表面张力的性质、表面吸附,加深对表面自由能的理解和表面活性剂的了解。
关键词:最大气泡法 表面张力 吸附 横截面积0. 引言在日常生活中, 我们对见到的一些现象可能已经习以为常,比如, 下过雨后, 我们可以见到树叶、草上的小水珠都接近於球形;不小心打碎了体温计后, 里面的水银掉到地上, 小水银滴也呈球形.其实这些现象都与表面张力有关.液体与气体相接触时, 会形成一个表面层, 在这个表面层内存在着的相互吸引力就是表面张力, 它能使液面自动收缩.表面张力是由液体分子间很大的内聚力引起的.处於液体表面层中的分子比液体内部稀疏, 所以它们受到指向液体内部的力的作用, 使得液体表面层犹如张紧的橡皮膜, 有收缩趋势, 从而使液体尽可能地缩小它的表面面积.我们知道, 球形是一定体积下具有最小的表面积的几何形体.因此, 在表面张力的作用下, 液滴总是力图保持球形, 这就是我们常见的树叶上的水滴按近球形的原因.表面张力与我们生活息息相关。
1、实验部分1.1实验原理:物体表面的分子和内部分子所处的境况不同,因而能量也不同,如图11-1,表面层的分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面(∆A )所需耗费功(W )的量,其大小应与∆A 成正比。
-W =σ∆A (12-1) 如果∆A =1m 2,则-W =σ,即在等温下形成1m 2新的表面所需的可逆功。
故σ称为单位表面的表面能,其单位为N ·m -1。
这样就把σ看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
它表示表面自动缩小的趋势的大小。
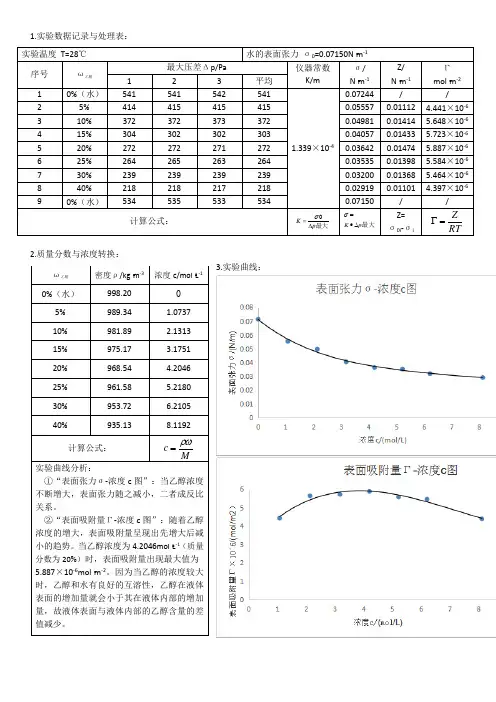
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。


溶液中的吸附作用及表面张力的测定中国科学技术大学少年班学院摘要:本实验通过最大气泡压力法对不同浓度的正丁醇溶液的表张力进行测定,并由此计算溶液界面上的吸附量并由饱和时吸附量的值计算得到正丁醇的分子截面积。
关键词:最大气泡压力法,表面张力,正丁醇,表面吸附1前言对于液体而言,其界面和表面处的性质尤为重要,可以决定其很多用处,而对于这部分性质而言,表面张力是其中最重要的一个数值,例如表面活性剂和表面吸附都要以表面张力为基础。
对于表面张力的测定则由很多方法,例如液膜法和泡压法,本实验采用的泡压法是利用溶液中气泡在涨破瞬间的压力来计算得到表面张力数值的。
2实验部分2.1实验仪器及试剂HK-2A型超级恒温水浴DMP-2B型数字式微压差测量仪Perfluid Model BT50b 气泵恒温套管,毛细管,100mL容量瓶,2mL移液管正丁醇,蒸馏水,铬酸洗液2.2实验设计2.2.1吸附量的求得吸附量定义为溶液中表层与里层浓度之差,曾经有人用刮下表层液膜并测定其中溶质浓度的方法来计算吸附量,这种方法虽然来自于最原始的对于吸附量的定义,但是用刀片刮下表层液膜这一点上操作起来十分困难,而吉布斯则从热力学上对吸附量的数值进行了推导,得到了吸附量与其他各个热力学函数之间的关系式:Γ=−cRT (ðσðc)T(1)其中σ为溶液的表面张力,c为溶液浓度,T为温度,溶液浓度和温度都容易得到,故此时的任务便是求得(ðσðc )T项,为了求出偏导数的值,则至少要测量多组表面张力-浓度数据,而其中表面张力的测定便要用到最大气泡压力法。
2.2.2最大气泡压力法测定表面张力对于毛细管口处的一个气泡而言,它受到内外两个压力差的作用,同时还受到毛细管口一圈处表面张力的作用,在表面张力的作用下,气泡仍然停留在管口处不溢出,而当气压差达到一定大小的时候,表面张力无法再维持住气泡,则气泡此时会从管口溢出,在溢出时,两个作用力大小应该相等,可以得到关系式:2πrσ=ρg∆P (2)等式左侧为气泡受到的表面张力,其中r为毛细管管口半径,右侧则为压力差在气泡上的作用力,在测定的时候,∆P的数值可以从微压计上读出,但是毛细管半径和溶液密度的数值则不易得到,而在溶液密度变化不大的情况下,对于两个情况下的表面张力和压力差数值,可以近似得到:∆P1∆P2=σ1σ2(3)由上式可以得知,只要在某种已知表面张力的液体中进行一次测定,之后每一次便都可以通过压力差的数值得到表面张力的数值,定义K′=σ1∆P1为毛细管常数,则对于某一固定的毛细管而言,此常数为一定值,而某一情况下的表面张力则可以表达为σ=K′∆P (4)由此便可以计算得到任意情况下的表面张力数值。


溶液表面吸附量的测定(3学时)一、目的要求1、了解溶液表面吸附量的物理意义及其测定原理。
2、了解最大气泡法测定溶液表面张力的基本原理和方法。
3、了解弯曲液面的附加压力与液面弯曲度、溶液表面张力之间的关系。
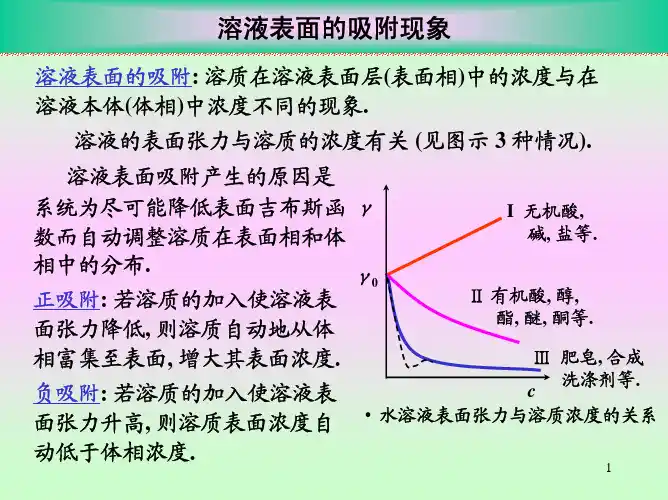
二、实验原理当一种溶质溶于水形成溶液时,溶质在溶液表面的浓度与其在溶液本体中的浓度存在着差别,这种现象称为溶液的表面吸附。
理论上,可用“表面吸附量”(或称表面超量)表示溶液的表面吸附程度大小,表面吸附量的物理化学意义是指溶质在溶液表面处的浓度与其在溶液本体中浓度的差值,通常用符号表示,其SI 单位为mol.m -2。
Γ在恒温、恒压条件下,表面吸附量(mol m -2)、溶液中溶质的活度和溶液表面张力Γa 三者之间的关系可用式(8.1)中的Gibbs 等温式进行描述:()1N m γ−(8.1)a d RT da γΓ=−在浓度不太大时,可以采用浓度代替活度,因此Gibbs 等温式可写成:()1mol L c −a (8.2)c d RT dc γΓ=−可见,只要通过实验测得溶液的表面张力与溶质浓度的关系曲线,即可利用公式γc (8.2)计算得到某一个浓度条件下的表面吸附量。
c Γ例如,图8.1为溶液表面张力随溶质浓度的变化曲线,若要求溶质浓度为时溶液的表1c 面吸附量,可在浓度轴上点作浓度轴的垂线,该垂线与关系曲线相交于A 点,1Γ1c ~c γ则曲线在A 点处切线AB 的斜率即为,由图8.1可知,AD 为纵轴的垂线,则有d dc γ。
又因为,则得到,代入到式(8.2)中即可DB AD d dc γ=1AD c =()1DB c d dc γ=求出浓度为时溶液的表面吸附量。
1c对于溶液表面吸附,可以采用Langmuir 理想吸附模型描述表面吸附量与溶液浓度Γc 之间的关系,即:(8.3)1kc kc θ∞Γ==Γ+γBD 1图8.1表面张力随浓度的变化关系曲线式(8.3)中,为溶质分子对溶液表面的覆盖百分率;为溶液的最大吸附量,对于θ∞Γ给定的体系,一定条件下是常数;为吸附常数∞Γk 可以将式(8.3)重排为直线形式:(8.4)1c c k ∞∞=+ΓΓΓ以对作图可得到一条直线,根据直线的截距和斜率可以求得最大吸c Γc 1k ∞Γ1∞Γ附量和吸附常数。

溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
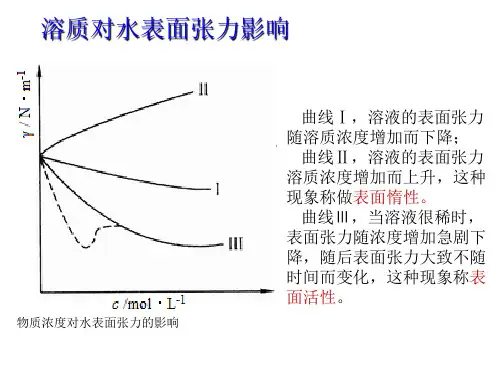
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc dσRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc dσ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc dσ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。


实验报告课程名称: 大学化学实验(P ) 指导老师: 成绩:_______________实验名称: 溶液表面张力的测定及等温吸附 实验类型: 测量型实验 同组学生姓名: 无 【实验目的】1. 加深理解表面张力、表面吸附等概念以及表面张力和吸附的关系。
2. 掌握用最大气泡法测定溶液表面张力的原理和技术。
【实验原理】最大气泡法测定表面张力:当表面张力仪中的毛细管尖端与待测液体相切时,液面即沿毛细管上升。
打开滴液漏斗的活塞,使水缓慢下滴而减小系统压力,这样毛细管内液面上受到一个比试管中液面上大的压力,当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时,气泡就从毛细管口逸出,这一最大压力差可由数字式微压差测量仪测出:p 最大=p 大气-p 系统 =p ∆。
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力与表面张力成正比,与气泡的曲率半径R 成反比,其关系式为:2P Rγ∆=如果毛细管半径很小,则形成的气泡基本上是球形的,当气泡刚开始形成时,表面几乎是平的,这时曲率半径最大,随着气泡的形成曲率半径逐渐变小,直到形成半球形,这时曲率半径R 与毛细管内半径r 相等,曲率半径达到最小值,由上式可知此时附加压力达最大值,气泡进一步长大,R 变大附加压力则变小,直到气泡逸出。
R = r 时的最大附加压力m p ∆2rγ=,从此式得2m r P γ=∆,当使用同一根毛细管及相同的压差计介质时,对两种具有表面张力为1γ,2γ的液体而言,γ正比于p ∆,且同温度下有:2121//p p ∆∆=γγ,若液体2的2γ为已知,则12121/p K p p ∆=∆∆=γγ式中:K 为仪器常数,可用已知表面张力的液体2来测得,因此,通过该式求得1γ。
本实验就是通过测定已知表面张力的水的2p ∆来求得不同浓度正丁醇溶液的表面张力。
溶质若能降低溶液的表面张力,则表面层中溶质的浓度就比溶液内部的大;反之,溶质若使溶液的表面张力升高,则它的表面层中的浓度比在内部的浓度小,这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
溶液表面吸附的测定摘要:本实验运用了最大气泡压力法测定不同浓度正丁醇水溶液的表面张力,用二次水作参照,求不同浓度正丁醇溶液的表面张力γ,再根据吉布斯吸附公式,结合OriginPro 8 作图软件,求算出不同浓度的溶液表面吸附量г,作“г-C ”图及“C/г-C ”图,通过斜率求Г∞ =6.33×10-6mol/m 2,从而计算q=0.262nm 2,最后计算最高正丁醇浓度时表面实际正丁醇分子面积为q c =0.248nm 2。
[引言部分] 一、实验目的 1、测定不同浓度正丁醇水溶液的表面张力,根据吉布斯公式计算溶液表面的吸附量以及饱和吸附时每个分子所占的表面面积; 2、通过最大气泡压力的测定,可进一步了解气泡压力与半径及表面张力的关系。
二、实验原理1.吉布斯吸附公式:对于两组分的稀溶液:c =-d ГRT dc γg式中Г为表面吸附量(mol g m -2) c 为溶液浓度(mol g dm -3) γ为表面张力(J/m 2)。
00,c d Гdc γ<>↑↓当时,为正吸附。
即,溶液表面张力。
c ↑反之,为负吸附,,溶液表面张力增加。
2.表面活性物质溶于液体中使表面张力降低的物质称为表面活性物质,在水溶液中,具有显著的不对称结构,由亲水基和憎水基构成。
正丁醇属于表面活性物质,它有亲水基氢氧基和疏水基烃基。
当浓度增加到一定程度时,被吸附分子占满表面,形成饱和吸附层。
3.吸附量Г计算方法以γ对c 作图,可得()=f c γ等温曲线,根据曲线,可通过作图求得Г与c关系,方法如下:在()=f c γ上去一点a ,通过a 点作切线和平行与横轴直线分别与纵轴交于b 和b ’,令z=bb ’,则:z=-c c d d γg由c =-cd ГRT d γg 得:z =ГRT取曲线上不同点,可求得多个z 值,从而得到Г与c 的关系。
4.饱和吸附量计算方法 Langmuir 提出Г与c的关系式c=1+c КГГК∞g(К为常数)取倒数可得:c c 1=+ГГКГ∞∞c-c Гγ∞若作图,所得直线斜率的倒数即为 5.饱和吸附时每个分子所占面积q 的计算方法1q=A ГN ∞由于Г是一个过剩量,即表示表面比溶液多的分子数,对于较浓的溶液,应考虑零吸附时原有分子,故浓度为c 时c 231q =+c A N A Г(N )6.γ的测量方法:全泡最大压力法设有一半径为r 的气泡,其周围为液体,p 和p 0分别平衡时气泡内外压力,则02p=p p rγ∆-=对于一个伸进水面的毛细管,打气时管内压力p 增大,将管中液体压至管口并形成气泡,曲率半径由小到大变化,当形成的气泡曲率半径最小时,它所能承受的压力最大。
实验十二溶液中的吸附作用和表面张力的测定摘要:本实验采用最大气泡压力法测定了液体表面张力,通过对不同浓度下正丙醇溶液的表面张力研究其和浓度之间的关系。
初步探讨了表面张力的性质、表面能的意义以及表面张力和吸附作用的关系。
关键词:吸附作用、表面张力、最大气泡法The measurement of the adsorption effect andsurface tensionAbstract:In this experiment, according to Gibbs formula and Langmuir equal-temperature equation, we apply the biggest bladder pressure method to research the relationship between the amount of absorption and the consistency of a substance in the solution besides the surface tension. The phenomenon show that the consistency of a substance in the surface of the solution is different from that inside is called absorption.Keyword:Surface tension, The biggest bubble pressure method, Absorption effect1. 序言物体表面的分子和内部的分子所处的境况不同,因此能量也不同,表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
物理化学实验报告溶液表面吸附的测量姓名:学号:班号:指导老师:溶液表面吸附的测量一、实验目的1) 掌握最大气泡压力法测定溶液表面张力的原理和方法。
2) 根据吉布斯(Gibbs )吸附方程式,计算溶质(乙醇)在单位溶液表面的吸附量Γ,并作Γ-c 图。
二、实验原理在定温下,纯物质液体的表面层与本体(内部)组成相同,根据能量最低原理,为降低体系的表面吉布斯自由能,将尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化,根据能量最低原理,若加入的溶质能降低溶剂表面张力时,则溶质在表面层的浓度比在溶液本体的浓度大,反之,若溶质使溶剂表面张力升高,溶质在表面层的浓度小于在溶液本体中的浓度。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关,其关系符合Gibbs 吸附方程T cRT c )(∂∂-=Γσ (C22.1) 式中:Γ吸附量;c 溶液浓度;T 温度;R 气体常数;σ表面张力或表面吉布斯自由能。
T c)(∂∂σ表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减小,即T c)(∂∂σ<0,则Γ>0,此时溶液中溶质在表面层中的浓度大于在溶液本体中的浓度,称为正吸附。
如果T c)(∂∂σ>0,则Γ<0,称为负吸附。
在一定温度下,测定不同浓度溶液的表面张力σ,以σ对c 作图,求不同浓度时的T c)(∂∂σ值。
由Gibbs 吸附方程求各浓度下的吸附量Γ。
求T c)(∂∂σ值,可以通过镜面法和平行线法,在曲线上做切线。
目前更好的方法是使用计算机处理数据,例如使用数据处理软件origin 或Excel 。
详细内容参见本书绪论部分。
测定液体表面张力的方法较多,如最大气泡压力法、滴体积法、毛细管升高法、环法等,本实验采用最大气泡压力法。
实验装置如图C22.1所示。
固体在溶液中的吸附实验报告
实验目的:研究固体在溶液中的吸附现象。
实验原理:固体在溶液中的吸附是指固体表面对溶液中的溶质发
生吸附作用。
吸附过程涉及到物质的表面化学性质和溶液中的溶质分
子结构,吸附剂的表面可以通过物理吸附和化学吸附两种方式发生吸
附作用。
实验步骤:
1. 准备实验装置:取一定量的固体样品并将其放置在一个玻璃容器中。
2. 准备溶液:根据实验需要,配制出一定浓度的溶液。
3. 将溶液倒入玻璃容器中,与固体样品接触。
4. 让溶液和固体样品充分接触,并保持一定的反应时间。
5. 根据实验要求,可以调节温度、PH值等条件,观察吸附效果的变化。
6. 取出固体样品,用适当的方法对其进行分析和测量,以获得吸附量
的数据。
7. 根据实验结果,分析固体在溶液中的吸附现象,并总结影响吸附效
果的因素。
实验结果:根据实验数据,可以得到固体在溶液中的吸附量,并
可以通过吸附等温线等图像来描述吸附效果。
实验结论:根据实验结果,可以得出固体在溶液中的吸附效果受
到多种因素的影响,包括溶液浓度、温度、PH等条件。
吸附等温线的
形状可以提供一定的信息,如吸附类型(物理吸附或化学吸附)和吸
附强度等。
实验总结:固体在溶液中的吸附现象是一个复杂的过程,需要考
虑多个因素的影响。
通过实验可以了解吸附行为,并为实际应用中的
吸附分离、废水处理等提供参考。
在实验过程中,需要注意实验条件
的准确控制和数据的准确测量,以保证实验结果的可靠性。
溶液表面吸附量的测定(3学时)一、目的要求1、了解溶液表面吸附量的物理意义及其测定原理。
2、了解最大气泡法测定溶液表面张力的基本原理和方法。
3、了解弯曲液面的附加压力与液面弯曲度、溶液表面张力之间的关系。
二、实验原理当一种溶质溶于水形成溶液时,溶质在溶液表面的浓度与其在溶液本体中的浓度存在着差别,这种现象称为溶液的表面吸附。
理论上,可用“表面吸附量”(或称表面超量)表示溶液的表面吸附程度大小,表面吸附量的物理化学意义是指溶质在溶液表面处的浓度与其在溶液本体中浓度的差值,通常用符号表示,其SI 单位为mol.m -2。
Γ在恒温、恒压条件下,表面吸附量(mol m -2)、溶液中溶质的活度和溶液表面张力Γa 三者之间的关系可用式(8.1)中的Gibbs 等温式进行描述:()1N m γ−(8.1)a d RT da γΓ=−在浓度不太大时,可以采用浓度代替活度,因此Gibbs 等温式可写成:()1mol L c −a (8.2)c d RT dc γΓ=−可见,只要通过实验测得溶液的表面张力与溶质浓度的关系曲线,即可利用公式γc (8.2)计算得到某一个浓度条件下的表面吸附量。
c Γ例如,图8.1为溶液表面张力随溶质浓度的变化曲线,若要求溶质浓度为时溶液的表1c 面吸附量,可在浓度轴上点作浓度轴的垂线,该垂线与关系曲线相交于A 点,1Γ1c ~c γ则曲线在A 点处切线AB 的斜率即为,由图8.1可知,AD 为纵轴的垂线,则有d dc γ。
又因为,则得到,代入到式(8.2)中即可DB AD d dc γ=1AD c =()1DB c d dc γ=求出浓度为时溶液的表面吸附量。
1c对于溶液表面吸附,可以采用Langmuir 理想吸附模型描述表面吸附量与溶液浓度Γc 之间的关系,即:(8.3)1kc kc θ∞Γ==Γ+γBD 1图8.1表面张力随浓度的变化关系曲线式(8.3)中,为溶质分子对溶液表面的覆盖百分率;为溶液的最大吸附量,对于θ∞Γ给定的体系,一定条件下是常数;为吸附常数∞Γk 可以将式(8.3)重排为直线形式:(8.4)1c c k ∞∞=+ΓΓΓ以对作图可得到一条直线,根据直线的截距和斜率可以求得最大吸c Γc 1k ∞Γ1∞Γ附量和吸附常数。
∞Γk 最大吸附量(mol m -2)的物理化学意义为溶液表面上紧密地排满一单层溶质分子时,∞Γ单位面积内包含的溶质的量,因此,求出最大吸附量后,可以利用下式计算得到每个溶∞Γ质分子占据的表面积:A (8.5)1A A N ∞=Γ式(8.5)中为Avogadro 常数。
A N 由以上的分析可以看出,要测定溶液的表面吸附量,需要测定不同浓度溶液的表面张Γ力,下面将对溶液表面张力的测定原理进行介绍。
γ溶液表面张力的测定方法有许多种,如滴重法、滴体积法、吊环法、最大气泡法等。
本实验将采用最大气泡法进行测定。
其基本原理如下:outp(a)in p (b)图8.2(a)溶液中的气泡(b )毛细管中气泡的生长out p 如图8.2(a )所示,液体中有一个半径为的气泡,该气泡被液体所包围,气泡内的压r 力为,气泡外的压力为。
当气泡内外压力达到平衡时,有in p out p (8.6)in out p p p =+∆式(8.6)中的为弯曲的气泡壁产生的附加压力。
与液体表面张力、气泡面的p ∆p ∆γ曲率半径之间的关系可用Laplace 方程进行描述:r (8.7)2p r γ∆=如图8.2(b )所示,将一根毛细管插入装有待测液体的容器中,使其下端口正好与液体表面接触,此时,毛细管内、外的压力和都为大气压。
若采取某种减压措施使容in p out p 0p 器中的气压减小,即减小图8.2(b)中的,则毛细管内的大气压会将毛细管中的液柱向下out p 压,随着减压过程的连续进行,连续减小,则会在毛细管的下端形成一个气泡,且气泡out p 会随着的减小而不断地增大(这个过程是气泡表面的曲率半径不断减小的过程),直out p r 到气泡的半径与毛细管的半径相等。
此时若继续减小,则气泡会发生破裂,破裂后的气out p 泡将外部气体带入的容器中,使有所上升,液柱又回到毛细管中。
若保持减压过程继续out p 进行,则随后将会重复气泡的形成和生长过程。
在气泡生长过程中,若气泡内、外压力是接近平衡的(即气泡内、外的压力相差一个微小量),则有公式(8.6)成立,且当气泡达到最大时(亦即气泡的半径达到最小),气泡内、外的压力差达到最大。
p ∆(8.8)max in out(min)0out(min)min 2 (22.8)p p p p p r γ∆=−=−=式(8.8)中的最小半径对于给定的毛细管来说是一个常数,因此,只要在实验中测出min r 最大压力差,即可由式(8.8)计算出待测液体的表面张力。
为了避免测量式(8.8)max p ∆γ中的以及校正其他因素引起的误差,可以采用标准物质进行标定。
min r 假设标准物质的表面张力为,用该标准物质测得的最大压力差为,用同一根s γ()max s p ∆毛细管测得待测样品的最大压力差为,被测样品的表面张力,则有式(8.9)和()max x p ∆x γ式(8.10)成立。
(8.9)()min x max x 2r p γ=⋅∆(8.10)()min s max s 2r p γ=⋅∆比较式(8.9)和式(8.10)可以得到被测定样品的表面张力为:(8.11)()()max x x smax s p p γγ∆=∆实验时,先测量已经准确知道表面张力的液体(如纯水)在气泡破裂前后的最大压s γ力差,再测量被测液体在气泡破裂前后的最大压力差,根据式(8.11)即可()max s p ∆()max x p ∆求得被测液体的表面张力。
x γ三、仪器及试剂仪器:恒温槽;表面张力管;毛细管;具嘴下口瓶;数字式微压差计;烧杯;阿贝折光仪;表面张力测定仪。
试剂:95%乙醇(AR )四、实验步骤用95%的乙醇配制质量分数分别为5、8、12、16、18、20、25、30、35、40、50左右的乙醇水溶液,置于试剂瓶中备用。
将一根端面磨平的毛细管及表面张力管洗净,再用温热的洗液浸泡30min左右,重新洗净,并浸入蒸馏水中备用。
按图8.3所示连接仪器,甩干毛细管中的液体,并将其垂直插入表面张力管中。
将表面张力管固定于恒温槽中。
用滴管从表面张力管另一侧的小支管中滴加入蒸馏水。
当水面接近毛细管端面时,应逐滴沿管壁缓慢加入,并避免振动,同时密切注视毛细管。
当水面刚与毛细管端面接触时,毛细管中会突然升起一段液柱,立即停止加液。
然后将表面张力管与下口瓶密封连接。
恒温10min以上。
图8.3表面张力测定仪(1.恒温浴槽;2.张力管;3.毛细管;4.下口瓶;5.烧杯;6.数字式微压差计)调节微压差计,使之读数为零。
微微打开下口瓶下方的旋塞,使下口瓶中的水慢慢流出,系统逐渐减压,观察毛细管,可以看到管中液柱逐渐下降,并产生气泡,直到气泡突然冲出管口而破裂。
以后以会重复上述现象。
调整下口瓶下方的旋塞,使毛细管尖端每隔一定时间(一般以10~20s为宜)冲出一个气泡,记下气泡突然破裂前微压差计显示的最大值,即为∆pmax(s)。
开启表面张力管,用滴管吸干表面张力管中的水,同法加入适量5%乙醇溶液,从毛细管中鼓气以充分搅匀溶液,并用该溶液洗涤毛细管内壁2~3次,用张力管中的待测溶液荡洗几遍滴管(不得将溶液吸走),再将表面张力管与下口瓶密封连接,恒温10min以后按步骤4记录∆pmax(x)。
读数完毕后,开启表面张力管,用荡洗过的滴管吸取少量张力管中的溶η液,在通以恒温循环水的阿贝折光仪上准确测量溶液在恒定温下的折光率。
为提高测量D准确度,需测量三次,取平均值作为测量结果。
测量完毕后,吸干张力管中的溶液并吹干毛细管中的溶液。
按步骤5和6,同法测量8、12、16、18、20、25、30、35、40和50%各组分乙醇溶液∆pmax(x)和折光率。
D η实验结束后,将表面张力管、毛细管洗净后,浸入蒸馏水中备用。
用吊环法测量纯水的表面张力,并与最大气泡法的测量结果相比较。
五、结果与讨论1.用表格列出实验数据。
由文献查出实验温度下纯水的表面张力,并由式(8.11)计算出各乙醇溶液的表面张s γ力。
x γ3.根据实验测定的各溶液的折光率值,利用标准数据,查出相应乙醇溶液的准确摩D η尔浓度,若标准数据表中没有实验测得的值,则可以使用内差法得到相应溶液的准确x c D η摩尔浓度值。
4.以表面张力对乙醇溶液的摩尔浓度作图得到一条曲线,在曲线上任取7~8个x γx c 点,根据式(8.2)计算相应浓度时的吸附量。
x Γ5.以对作图,从直线的斜率和截距可求得饱和吸附量和吸附常数。
再x x c Γx c ∞ΓK 由式(8.5)计算饱和吸附时每个乙醇分子所占据的面积A 。
六、注释1.杂质及污垢对表面张力的影响极大,所以本实验对张力管及毛细管的洗涤要求极严。
如果毛细管洗涤不干净,不仅影响表面张力值,而且会使气泡不能有规律地单个连续逸出。
要么就是一个气泡也没有,要么就是两个甚至更多个同时逸出,严重影响测量的进行,甚至造成实验的失败。
2.毛细管插入溶液中的深度直接影响测量结果的准确性,这是因为溶液的静压力会增加对气泡壁的压强,为了减少静压力的影响,应尽可能减少毛细管的插入和深度,使插入深度。
0h ∆→3.温度对表面张力的影响较大,实验时最好在恒温下进行。
如果无恒温条件有,则在测量时必须密切注视温度的变化。
4.若在测量时微压差计难以调节到零点,可记录其初始值,实验测量结果只要减去此值,即为∆p max。
七、问题与思考1、简述本实验的成败关键。
如果在实验时,下口瓶中水的流出速度过快,或毛细管不洁净,会产生何种现象?2、实验中为什么采用逐步滴加溶液的方法来确定液面与毛细管管口相切?3、如何通过测定溶液的表面张力确定临界胶束浓度CMC?4、分析实验中可能出现的误差。
八、参考文献1.刁国旺,阚锦晴,刘天晴编著,物理化学实验,北京:兵器工业出版社,1993,p182。
2.清华大学化学系物理化学实验编写组,物理化学实验,北京:清华大学出版社,1991,p287。
3.N.C.拉甫罗夫主编,赵振国译,徐克敏校,胶体化学实验,北京:高等教育出版社,1992,p19。
九、e网连接1.http://202.192.168.54/wulihuaxue/wuhuashiyan/index.htm2./files/syzx/f/10486_2_f_3/jcwhsy/3./Course/PhyChem/Experiment/(林曼斌)。